1. 前言
作为一种新型前沿材料,磁性纳米材料因具有特殊的量子尺寸效应、小尺寸效应,以及特殊的磁学特性,在我们日常生活中的各个方面,尤其在磁学、生物学等方面得到了广泛的应用 [1] [2] [3] 。又因为纳米材料在物理方面具有特殊的的稳定性、单分散性、可调控性等都大大拓展了它的应用范围和前景 [4] [5] 。尤为特殊的是,由于具有特殊的磁学性能,磁性纳米材料被用于与药物结合,使某些治疗更为精准,在生物医学方面取得了很大的进步 [6] [7] [8] 。
磁性纳米粒子的合成方法有很多,主要分为化学法、物理法。其中化学法主要包含四种分别是:沉淀法、溶胶-凝胶法、微乳液法和溶剂热法。物理方法主要有两种分别是:蒸发冷凝法和磁控溅射方法。利用化学共沉淀的方法合成的纳米粒子不管是从粒径还是分散性都比其他的方法要好得多 [9] 。因为裸露在表面的四氧化三铁磁性纳米粒子的原子活性很高,易产生聚沉现象 [10] 。将一些别的基团加在它的表面用来降低表面活性,使得不会产生聚沉现象。经修饰后的磁性纳米粒子不仅拥有反应灵敏性,还有生物相容性 [11] ,在分离纯化和一些检测上有很大的用处。
磁性纳米材料的一个重要应用是用于固定化酶,经固定后的酶具有极大优势,它有游离酶的特性,又克服了其不足。分离回收的方式简单,也可以重复的进行使用,稳定性相对于其他方式也很高。固定化酶技术研究的重点是如何筛选条件相宜的载体及合适的固定化方法。固定化酶技术研究的方法不尽相同 [12] ,在实验中需要根据酶的应用目的和特性,综合考虑选择出最恰当的方法。吸附法、包埋法以及交联法和共价结合法这四种方式是目前最常见最传统的方式 [13] 。
本论文主要是通过溶剂热一锅法,以乙二醇、氯化铁、醋酸钠和盐酸多巴胺为原料,合成出经盐酸多巴胺修饰的四氧化三铁磁性纳米粒子后,用戊二醛共价偶联固定化乙酰胆碱酯酶。对合成后的磁性四氧化三铁纳米离子进行红外光谱测定、XRD表征、热重分析、磁性能分析,从而达到对产物的结构和性质有更好的了解,并进一步研究固定化酶相关的反应条件优化。
2. 实验仪器、试剂及方法
2.1. 仪器与试剂
实验采用溶剂热一锅法,以乙二醇、氯化铁、醋酸钠和盐酸多巴胺为原料,合成出经盐酸多巴胺修饰的四氧化三铁磁性纳米粒子并进行表征及固定化酶的应用研究。用到的主要试剂和设备如表1和表2所示。
表1. 实验试剂
表2. 实验设备
2.2. 实验方法
2.2.1. 合成盐酸多巴胺DA修饰的磁性纳米粒子
首先在30 mL乙二醇中加入FeCl3并搅拌溶解,随后依次加入醋酸钠和盐酸多巴胺,对混合溶液进行加热且持续搅拌大约30 min至全部溶解。然后将混合溶液需转移至50 mL高压反应釜。烘箱中200℃反应72小时。自然冷却至室温,得到黑色的经盐酸多巴胺修饰的磁性纳米粒子,用乙醇进行多次洗涤,在60℃真空干燥箱中干燥24小时。
2.2.2. 戊二醛反应
用戊二醛作为双功能试剂,接枝盐酸多巴胺修饰的磁性纳米粒子,以便进一步负载乙酰胆碱酯酶。具体方法如下:在50 mL磷酸缓冲液PBS (1 u|mL,PH = 7)中加入0.79克Fe3-NH2磁性纳米微球,超声分散一小时。再往里加入戊二醛(5 mL,5%)溶液,室温条件下搅拌反应4小时。用磷酸缓冲液PBS (1 µ|mL,PH = 7)对磁分离后载体进行多次洗涤。(留存约0.1 g磁性纳米微球用来做考虑不同浓度的戊二醛2%、3%、4%、5%、6%、7%的影响)。
2.2.3. 磁性Fe3O4@SiO2-NH2纳米微球表面乙酰胆碱酯酶固定化方法
准确称取10 mg磁性Fe3O4@SiO2-NH2纳米微球于10 mL离心管中,向离心管中加入不同酶蛋白浓度(0.25、0.5、0.75、1、1.25、1.5、2.0 U/mL)、不同pH的乙酰胆碱酯酶溶液2 mL (分别由50 mM pH 5.0的乙酸-乙酸钠缓冲液;50 mM pH 6.0~8.0的磷酸氢二钠–磷酸二氢钠缓冲液;50 mM pH 9.0~10.0的甘氨酸-氢氧化钠缓冲液配制),一定温度下摇床反应一段时间,磁性分离,收集上清,用于测定蛋白含量。固定化酶清洗数次后,直至上清液中无蛋白含量吸收。将固定化酶之后的上清液和清洗液收集在一起测吸光度求吸附率。
3. 结果与分析
3.1. 磁性Fe3O4纳米粒子的结构与形态分析
3.1.1. 透射电镜分析
图1是多巴胺修饰的磁性纳米粒子和戊二醛接枝后的多巴胺修饰的磁性纳米粒子的透射电镜照片。由图可知,溶剂热一步法合成的盐酸多巴胺修饰的磁性纳米粒子的粒径在10 nm左右,而经戊二醛接枝后其粒径变为200 nm左右。可以发现经戊二醛接枝后,磁性纳米粒子的分散性变得更好。
3.1.2. 红外光谱(IR)分析
图2多巴胺修饰(a)及经戊二醛接枝后(b)的磁性纳米粒子的红外谱图。两种磁性纳米粒子分别在波数为568.62与567.71 cm−1处出现了Fe-O键的吸收峰,说明经多巴胺修饰的Fe3O4磁性纳米粒子及其进一步与戊二醛反应后,始终保持四氧化三铁的骨架结构。同时图(a)和图(b)中,波数为2346.97和2075.06 cm−1对应于四氧化三铁粒子表面的-OH伸缩振动吸收峰。在(a)图中的2075.06 cm−1和图(b)中的1572.06 cm−1处出现了新的吸收峰,属于C-H的伸缩振动吸收峰,载波数两图中分别为1795.62 cm−1和1460.00 cm−1处的吸收峰属于N-H的变动振动。由此说明多巴胺对对Fe3O4磁性纳米粒子的表面改性是成功的。
3.1.3. 磁性纳米材料的XRD分析
未与戊二醛反应的溶剂热直接合成的多巴胺修饰的Fe3O4@多巴胺的衍射谱峰2θ是30.30˚、35.58˚、43.00˚、53.98˚、57.64˚、62.46˚、这些衍射谱峰分别对应Fe3O4的(220)、(311)、(400)、(422)、(511)、(440)的晶面 [14] 。在图3中没有出现一些别的杂峰,这说明Fe3O4磁性纳米粒子是比较纯净的尖晶石结构,物

Figure 1. The TEM of magnetic nanoparticles modified by dopamine (a) and grafted by glutaraldehyde (b)
图1. 多巴胺修饰(a)及经戊二醛接枝后(b)的磁性纳米粒子的透射电镜图
 (a)
(a) (b)
(b)
Figure 2. The infrared spectrum of magnetic nanoparticles modified by dopamine (a) and grafted by glutaraldehyde (b)
图2. 多巴胺修饰(a)及经戊二醛接枝后(b)的磁性纳米粒子的红外谱图
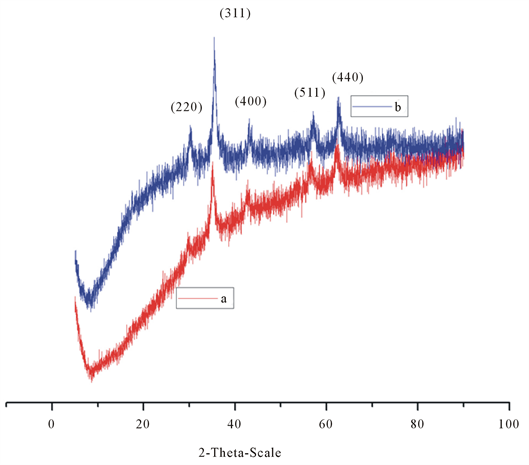
Figure 3. The XRD spectrogram of magnetic nanoparticles modified by dopamine (a) and grafted by glutaraldehyde (b)
图3. 多巴胺修饰(a)及经戊二醛接枝后(b)的磁性纳米粒子的XRD谱图
相比较单一。与戊二醛反应的溶剂热直接合成的多巴胺修饰的Fe3O4@多巴胺的衍射谱峰2θ是30.12˚、35.56˚、43.00˚、53.34˚,56.76˚、62.37˚。这样,在通过图中谱线的相互之间的比较,我们可以得到以下结论:与戊二醛反应的由溶剂热直接产生的多巴胺修饰的四氧化三铁和与戊二醛反应的由溶剂热直接产生的多巴胺修饰的四氧化三铁的出峰位置大体一样,这说明在经过表面修饰后修饰磁性纳米粒子的过程中以及与戊二醛反应后,Fe3O4的结构并没有受到损失,变化不大。从谱线中,可以看到,修饰后的磁性纳米粒子峰强有所变化,但是变化不大,这是由于修饰各种表面活性剂造成的。
3.1.4. 磁性能分析
图4是功能化的四氧化三铁磁性纳米粒子的室温磁滞回归线。在298 K时,四氧化三铁磁性纳米粒子和经多巴胺修饰的纳米粒子的饱和磁化强度值为分别为83.7 emu/g 75.0 emu/g。测试结果表明,制得的磁性纳米粒子的磁性能十分的优异是完全符合要求的。
3.2. 固定化酶的结果讨论
3.2.1. 不同酶蛋白浓度对蛋白吸附率的影响
首先分别量取为0.25、0.5、0.75、1.0、1.25、1.5、2.0 U/mL的乙酰胆碱酯酶溶液2 ml。然后加入10 mg氨基纳米微球。在摇床中反应十小时,摇床控制在30℃,200 rpm左右。考察蛋白吸附率因不同蛋白浓度的酶液产生的影响。
图5所示,主要考在浓度为0.2 U/mL、0.5 U/mL、1.0 U/mL、1.25 U/mL、1.5 U/mL、2.0 U/mL条件下,对蛋白吸附率的影响。由图可看得随着酶蛋白浓度的升高,蛋白吸附率随之增加,当达到1.5 U/mL酶蛋白浓度对吸附率的影响基本不变。

Figure 4. The magnetic analysis of magnetic nanoparticles modified by dopamine (a) and grafted by glutaraldehyde (b)
图4. 多巴胺修饰(a)及经戊二醛接枝后(b)的磁性纳米粒子的磁性分析

Figure 5. The effect of enzyme protein concentration on adsorption rate
图5. 酶蛋白浓度对吸附率的影响
3.2.2. 不同反应温度对蛋白吸附率的影响
首先量取1.0 U/mL的脂肪酶溶液2 mL。然后向溶液中加入氨基纳米微球10 mg。最后分别在6个不同温度(20℃、5℃、30℃、35℃、40℃、50℃)的摇床中反应10小时。考察酶蛋白吸附率因不同固定化温度产生的影响。
图6所示,我们研究了在20℃、5℃、30℃、35℃、40℃、50℃条件下,不同的温度对蛋白吸附率的影响。由图可以得出随着温度的升高,蛋白吸附率基本是不变化的,温度的变化对蛋白吸附率的影响基本不大。但是温度超过35℃后,温度升高使得蛋白吸附率逐渐下降。
3.2.3. 不同PH对蛋白吸附率的影响
首先准备5份反应体系pH值分别为5.0、6.0、7.0、8.0、9.0、10.0的酶液。随后加入10 mg氨基纳米微球。将混合后的溶液放在摇床中反应10 h。观察酶蛋白吸附率因不同体系pH值的产生的影响。
图7考虑了在PH分别为5、6、7、8、9、10下对蛋白吸附率的影响。由图可得随着PH的变化对蛋白吸附率影响逐渐升高。PH为9时达到最佳吸附率。
3.2.4. 不同反应时间对蛋白吸附率的影响
首先准备1.0 U/mL乙酰胆碱酯酶溶液2 mL。然互向溶液中加入10 mg氨基硅烷微球。分别于摇床中反应四小时、八小时、十二小时、十六小时以及二十四小时和三十二小时。测定酶蛋白吸附率因不同的固定化时间的影响。
图8是固定化时间对蛋白吸附率的影响曲线。由图可看出蛋白吸附率随着固定化时间的增加逐渐增大。达到15 h时为最佳时间,随后开始下降。
3.2.5. 不同戊二醛对蛋白吸附率的影响
戊二酵作为具有双功能基团的交联剂,其可使酶蛋白分子中赖氨酸的ε-NH2、N端的a-NH2、酪氨酸的酚基或半胱氨酸的巯基与氨基化硅胶载体上的-NH2发生Schiff反应,而相互交联成固定化酶。分别
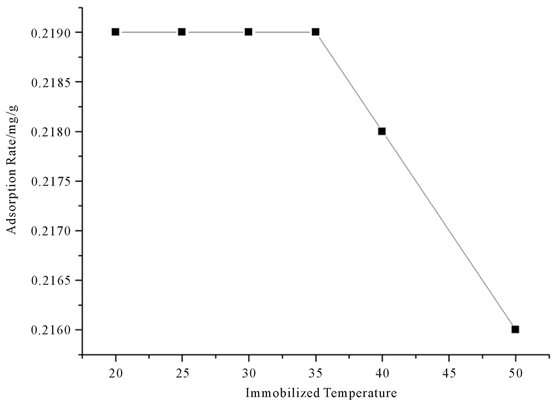
Figure 6. The effect of different reaction temperature on the rate of protein adsorption
图6. 不同反应温度对蛋白吸附率的影响

Figure 7. The effect of different PH on the rate of protein adsorption
图7. 不同PH对蛋白吸附率的影响

Figure 8. The effect of different immobilization time on the rate of protein adsorption
图8. 不同固定化时间对蛋白吸附率的影响
将0.2%、0.3%、0.4%、0.5%、0.6%、0.7% (体积分数)的戊二醛加入磁性纳米微球处理后,进行AChE固定,计算各浓度下酶活回收率η考察戊二酵用量对固定化酶的影响。
图9是戊二醛浓度在0.02、0.03、0.04、0.05、0.06、0.07下对蛋白吸附率的影响。由图可看出戊二醛浓度在0.05时蛋白吸附率达到最大值。其余浓度下蛋白吸附率基本不变。
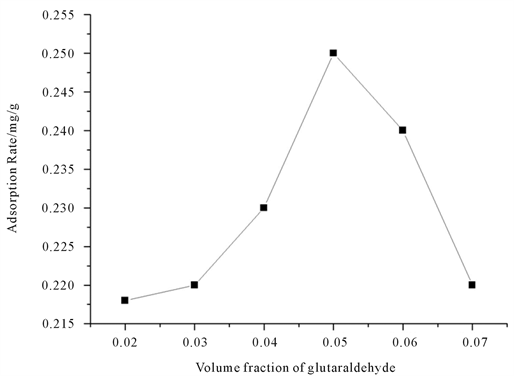
Figure 9. The effect of different glutaraldehyde concentration on the rate of protein adsorption
图9. 不同戊二醛浓度对蛋白吸附率的影响
综上所述,固定化酶的最优条件是酶蛋白浓度1.5 U/mL,反应温度为35℃反应PH为8,固定化时间是15 h,戊二醛浓度为0.5%。
4. 结论
1) 通过一种简单有效的溶剂热还原法,以FeCl3、乙二醇、醋酸钠、盐酸多巴胺为原料合成出了多巴胺修饰的四氧化三铁磁性纳米粒子,后用戊二醛共价偶联,随后用于固定化乙酰胆碱酯酶的应用研究。
2) 通过透射电镜、红外光谱、X-ray单晶结构衍射、磁性能分析等测试手段对实验产物的晶体结构进行表征。结果表明获得的多巴胺修饰的四氧化三铁磁性纳米粒子的粒径约为10~20 nm。红外光谱、X-ray衍射的结果表明对磁性纳米粒子进行的表面修饰是有效的。磁性能分析说明多巴胺修饰的四氧化三铁磁性纳米粒子,其饱和磁化值为75.0 emu/g,具有十分优秀的磁性能,并且固定化酶后容易进行控制和再次回收。
3) 将磁性纳米粒子用于乙酰胆碱酯酶的固定化应用研究表明,固定化酶的最优条件是:最优条件是酶蛋白浓度1.5 U/mL,反应温度为35℃反应PH为8,固定化时间是15 h,戊二醛浓度为0.5%。这种溶剂热合成磁性纳米粒子的方法有望得到更广泛的应用。
基金项目
国家自然科学基金(41406090)、青岛农业大学高层次人才启动基金(No. 631302)。