1. 引言
脑卒中后抑郁(post-stroke depression, PSD)是指脑血管疾病发生后临床上除脑卒中的各种躯体症状外,出现的以情绪低落、活动机能减退、思维迟滞为主要特征的一类情感障碍性疾病,属于继发性抑郁 [1]。关于PSD的发病率,各家报道不一,大样本流行病学调查的资料甚少,国内外文献报道多在40%~50% [2],其中重度抑郁大约占10% [3]。PSD对日常生活能力有不利影响,可延缓神经功能缺损和认知功能的恢复,给患者的康复训练带来困难,使患者和护理人员的生活质量显著下降,增加死亡率 [4] [5]。传统的抗抑郁药物治疗在一定程度上改善PSD预后,但效果不具备显著的优势,仍存在副作用大,病人易耐受,易复发,治疗费用高等不足 [6]。逐痰通络汤由大黄、胆南星、地龙、全蝎、天麻、郁金、石菖蒲、天竹黄等药物组成,具有化瘀逐痰、活血通络的作用,是临床治疗缺血性中风行之有效的方剂,但其是否对PSD亦有效及其机制目前尚未有研究。为此,本实验分别采用急性小鼠和慢性大鼠动物模型,从多层次多角度研究逐痰通络汤治疗PSD的多途径作用机制,有利于提高其在PSD防治中的临床价值。现报告如下。
2. 材料与方法
2.1. 实验动物
急性实验:选用清洁级昆明种小鼠,体重在18~22 g之间,雌雄各半,由温州医科大学实验动物中心提供[编号SPXK(浙)2016-0003]。小鼠。慢性实验:选用清洁级雄性SD大鼠90只,体重(250 ± 20) g,由温州医科大学实验动物中心提供[编号 SYXK(浙)2015-0061]。所有动物实验的操作均通过伦理委员会认可。
2.2. 药物及其制备
逐痰通络汤:大黄10 g、胆南星10 g、地龙10 g、全蝎6 g、天麻10 g、郁金10 g、石菖蒲6 g、天竹黄10 g,于常压100℃煎煮30 min去渣,8层纱布过滤,浓缩成生药2 g/mL,4℃保存备用。
2.3. 主要试剂
DA试剂盒、NE试剂盒、5-HT试剂盒、HVA试剂盒、5-HIAA (美国Sigma公司);单胺氧化酶底物β-PEA (美国Sigma公司);125 I-c AMP放免测定试剂盒(温州医科大学核医学实验室产品);盐酸氟西汀分散片(fluoxetine, FLU) (礼来苏州制药有限公司,批准文号:国药准字J20120001)。
2.4. 仪器与设备
64R超速冷冻离心机(Beckman Coulter公司);Anke 80-2C台式离心机(上海安亭科学仪器厂);Agilent 1100高效液相仪(美国Agilent公司);ANTEC电化学检测器(荷兰安泰克公司);Dikma-diamond C18 ODS色谱柱(250 mm × 4 mm,美国Dikma公司)。
2.5. 分组与造模
2.5.1. 急性实验
清洁级昆明种小鼠90只适应性饲养1周后随机分6组,分为正常对照组,逐痰通络汤组(1 g/kg,2 g/kg,4 g/kg,8 g/kg),阳性对照组(氟西汀10 mg/kg),每组15只小鼠,除正常对照组小鼠正常饲养,不行造模,其他组小鼠术前禁食、不禁水12 h,改进Longa法制作局灶性脑缺血再灌注小鼠模型。预防术后感染连续3 d腹腔注射4万U青霉素,术后常规饲养1周。
2.5.2. 慢性实验
SD大鼠90只适应性饲养1周后随机分6组,分为正常对照组,应激模型组,逐痰通络汤组(2 g/kg,4 g/kg,8 g/kg),阳性对照组(氟西汀10 mg/kg),每组15只大鼠,除正常组大鼠正常饲养,不行造模,其他组大鼠术前禁食、不禁水12 h、改进Longa法制作局灶性脑缺血再灌注大鼠模型。预防术后感染连续3 d腹腔注射4万U青霉素。术后常规饲养1周,第8天开始除正常对照组外其他组给予慢性不可预见温和刺激结合孤养。慢性温和刺激包括:昼夜颠倒12 h、鼠笼倾斜45˚,24 h、潮湿垫料24 h、禁食24 h、禁水24 h、夹尾3 min、振荡 40 min、束缚2 h。每天随机给予一种刺激,持续2周。
2.6. 干预方法
2.6.1. 急性实验
常规饲养一周后逐痰通络汤组小鼠按不同剂量灌胃给药,氟西汀组小鼠按10 mg/kg腹腔注射给药,正常对照组给予等体积蒸馏水,60 min后进行自主活动观察、悬尾试验、强迫游泳试验。
2.6.2. 慢性实验
慢性温和刺激14 d后逐痰通络汤组大鼠按不同剂量灌胃给药14 d,氟西汀组大鼠按10 mg/kg腹腔注射14 d,正常对照组、应激模型组给予等体积蒸馏水。
2.7. 观察项目
2.7.1. 急性实验
1) 自主活动的观察:干预后60 min将各组小鼠放入自主活动仪,观察3 min内活动次数。2) 小鼠强迫游泳试验:量筒内装21℃~23℃水至10 cm,量筒之间放置一个不透明板,防止小鼠彼此看到。干预后60 min,小鼠被投入量筒,并滞留6 min,计算后4 min的累计不动时间。判断不动的标准:停止挣扎,垂直体位,不动漂浮,仅做一些必要的活动使它的头露出水面。3) 小鼠悬尾试验:干预后60 min,用胶带在距离小鼠尾尖30 mm处将之固定于水平放置的棒状物上,中间用板隔开,防止彼此看到对方。小鼠距离最近的物体大约100 mm。悬挂6 min,记录后4 min的累计不动时间。判定不动的标准是动物停止挣扎,身体呈垂直倒悬状态,静止不动。4) 取样品及检测。实验结束后将小鼠断头快速取脑。在冰盘上剥离脑组织,用液氮快速冷冻并放入−80℃冰箱保存待测。采用高效液相法,检测小鼠前不同脑区(海马、皮层、纹状体、下丘脑)单胺递质及其代谢产物的水平(5-HT、DA、NE、5-HIAA、DOPAC),测量小鼠不同脑区(海马、皮层、纹状体、下丘脑)单胺氧化酶A和单胺氧化酶B的活性。
2.7.2. 慢性实验
1) 开野实验:末次给药后60 min给予开野实验,正方形开野实验箱为80 cm × 80 cm × 75 cm,底板用笔画成10 cm × 10 cm的方格,其正上方距离底板90 cm高处有一60 W白炽灯泡。测试时将大鼠置于开野箱中央,适应5 min,随后观察0~5 min和5~10 min内大鼠爬格次数、探究次数(两前肢离地1 cm以上的次数)。2) 穿梭箱实验记录逃避失败次数:末次给药后60 min给予穿梭箱实验,将大鼠置于穿梭箱的一端,适应测试环境3 min。然后进行30次回避实验:每次实验前4 s均出现噪声及光照信号,若此期间无回避反应发生,大鼠将受到0.8 mA足部电击;若电击4 s后仍然无逃避反应发生,则电击和光照信号将终止。记录大鼠在整个实验中逃避失败次数,即电击出现4 s期间大鼠未到达另一端箱子的次数。3)取样品及检测。实验结束后将大鼠断头快速取脑,在冰盘上剥离脑组织,快速冷冻并放入−80℃冰箱保存待测,用放射免疫法,测量大鼠不同脑区(海马、皮层) AC活性。
2.8. 统计学方法
采用SPSS13.0统计软件包进行统计学处理,数据以mean ± SEM表示,正常对照组与应激组间用t检验分析,药物作用及其组间差异(p < 0.05)用单因素方差分析中的Dunnett t检验分析。
3. 实验结果
3.1. 急性实验
3.1.1. 逐痰通络汤对小鼠悬尾测试和强迫游泳中不动时间的影响
悬尾测试中,与正常组相比,逐痰通络汤4 g∙kg−1、8 g∙kg−1能够显著降低不动时间,抑制率分别为25.5%和38.5% (F(5, 54) = 11.38,p < 0.01,p < 0.001;图1)。强迫游泳测试中,相同剂量的逐痰通络汤的抑制率分别是29.5%和35.8% (F(5, 54) = 6.17,p < 0.05,p < 0.01,p < 0.001;图2)。在这两个行为学测试模型中,逐痰通络汤的抗抑郁效果与临床上经典的抗抑郁药氟西汀(FLU)相似(10 mg∙kg−1,腹腔注射)。
 **P < 0.01 and ***P < 0.001与对照组相比。
**P < 0.01 and ***P < 0.001与对照组相比。
Figure 1. The effects of ZTTLT on the non-movement time of tail suspension in the model of PSD mice
图1. 逐痰通络汤对PSD模型小鼠悬尾不动时间的影响
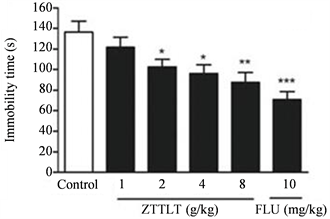 *P < 0.05,**P < 0.01 and ***P < 0.001与对照组相比。
*P < 0.05,**P < 0.01 and ***P < 0.001与对照组相比。
Figure 2. The effects of ZTTLT on the non-movement time of force swimming in the model of PSD mice
图2. 逐痰通络汤对PSD模型小鼠强迫游泳不动时间的影响
3.1.2. 逐痰通络汤对小鼠自主活动的影响
为了验证逐痰通络汤的抗PSD作用,排除给药后药物带来的神经兴奋性或抑制性作用,本研究检测了小鼠的自主活动。结果显示逐痰通络汤和氟西汀均不影响小鼠自主活动[F(5,54) = 0.97,p = 0.42],相同的剂量在悬尾和强迫游泳测试中均能显著减少不动时间(如图3)。
3.1.3. 逐痰通络汤对小鼠各脑区单胺递质及其代谢产物含量的影响
结果总结了海马、前额叶、下丘脑和纹状体中单胺递质及其代谢产物的含量。如表1所示,在给予逐痰通络汤(其中逐痰通络汤4 g∙kg−1、8 g∙kg−1对5-HT含量增加显著,
2 g∙kg
−
1、4 g∙kg−1、8 g∙kg−1对NE含量增加显著)和氟西汀后,海马中5-HT和NE含量显著上升[F(5,54) = 3.34, p < 0.05, p < 0.01]。同时逐痰通络、氟西汀有降低5-HIAA含量,从而导致5-HIAA/5-HT比值下降的趋势。前额叶皮层中如表2所示,5-HT水平在给予逐痰通络汤
4 g∙kg
−
1、8 g∙kg−1和氟西汀10 mg∙kg−1后,都有所增加[F(5,54) = 4.42, p < 0.05, p < 0.01]。同时给予相同剂量的逐痰通络汤和氟西汀后也能够增加NE的水平[F(5,54) = 3.35, p < 0.05, p < 0.01]。5-HT转化率(5-HIAA/5-HT)在上述剂量下也显著降低,其中海马[F(5,54) = 4.46, p < 0.05, p < 0.01],前额叶皮层[F(5,54) = 4.21, p < 0.05]。然而海马及前额叶脑区中DA及其代谢产物DOPAC的含量均无显著性差异。表3和表4中下丘脑和纹状体中单胺及其代谢产物含量均无显著性变化。

Figure 3. The effects of ZTTLT on the locomotor activity in the model of PSD mice
图3. 逐痰通络汤对小鼠自主活动的影响

Table 1. The effects of ZTTLT on monoamine transmitters and their metabolites in the hippocampus of PSD mice
表1. 逐痰通络汤对PSD小鼠海马脑区单胺递质及其代谢产物的影响
*p < 0.05 and **p < 0.01与对照组相比。

Table 2. The effects of ZTTLT on monoamine transmitters and their metabolites in the frontal cortex of PSD mice
表2. 逐痰通络汤对PSD小鼠额叶皮层脑区单胺递质及其代谢产物的影响
*p < 0.05 and **p < 0.01与对照组相比。

Table 3. The effects of ZTTLT on monoamine transmitters and their metabolites in the hypothalamus of PSD mice
表3. 逐痰通络汤对PSD小鼠下丘脑脑区单胺递质及其代谢产物的影响
*p < 0.05与对照组相比。

Table 4. The effects of ZTTLT on monoamine transmitters and their metabolites in the corpus striatum of PSD mice
表4. 逐痰通络汤对PSD小鼠纹状体脑区单胺递质及其代谢产物的影响
3.1.4. 逐痰通络汤对小鼠各脑区单胺氧化酶活性的影响
表5和表6总结了逐痰通络汤及氟西汀对小鼠各脑区单胺氧化酶A、B型活性的影响。给予逐痰通络汤
4 g∙kg
−
1、8 g∙kg−1,60min后,海马单胺氧化酶A活性抑制率分别是17.7%和22.4% [F(5,54) = 5.294, p < 0.05, p < 0.01],前额叶单胺氧化酶A活性抑制率分别是24.1%和26.9% [F(5,54) = 4.12, p < 0.05, p < 0.01],但是逐痰通络汤均不影响各脑区单胺氧化酶B活性。经典抗抑郁药氟西汀对海马和前额叶中单胺氧化酶A活性的抑制率分别是24.8%和29.2% (p < 0.01,p < 0.01),但不影响单胺氧化酶B活性。
3.2. 慢性实验
3.2.1. 逐痰通络汤对应激PSD大鼠开野实验中行为的影响
如表7所示,与正常大鼠相比,慢性PSD应激模型组大鼠在0~5 min和5~10 min内爬格次数及探究次数均减少。而在给予不同剂量的逐痰通络汤(2,4和
8 g
/kg)后,应激大鼠的行为明显改善,爬格次数及探究次数均出现不同程度的增加。氟西汀给药后大鼠活动次数下降,与应激对照组相比,差异有显著性。
3.2.2. 逐痰通络汤对应激大鼠在穿梭箱实验中主动逃避行为的影响
由图4可以看出,正常大鼠在穿梭箱实验中主动逃避电击失败的次数只有2次,而应激模型组大鼠在30次电击中逃避失败的次数约为10次,两者之间差异有显著性。逐痰通络汤
8 g
/kg和氟西汀10 mg/kg给药后,应激大鼠主动逃避电击失败的次数明显减少,与应激对照组相比差异有显著性。
3.2.3. 逐痰通络汤对慢性应激大鼠不同脑区AC活性的影响
表8显示,慢性应激PSD大鼠海马、皮层的AC活性较正常对照组明显降低,给予不同剂量逐痰通络汤后,两个脑区的AC活性显著增加,其中
8 g
/kg剂量逐痰通络汤能明显增加海马及皮层的AC活性,且
8 g
/kg逐痰通络汤组与10 mg/kg氟西汀组的作用强度相似。
4. 讨论
关于PSD的发病率,各家报道不一,大样本流行病学调查的资料甚少。国内外文献报道多在40%~50% [2],其中重度抑郁大约占10% [3]。关于PSD的发病机制目前存在两种学说,即“原发性内源性学说”与“反应性机制学说”。“反应性机制学说”认为脑卒中患者病后遗留语言、肢体功能障碍等残疾及由此带来的社会和家庭角色的改变,使其产生了无用感,绝望感和包袱感等,这对抑郁的发生或程度加重起了促进作用 [7]。而从器质性功能上来看,目前大多学者倾向于“原发性内源性学说”,即其认为PSD 的发生与大脑损害后的神经生物学改变有关。边缘系统、丘脑及蓝斑核等能使人类产生抑郁 [8],而这些神经结构间的沟通主要是通过各种神经递质传递来完成的,其中5-羟色胺能(5-HT)神经递质与去甲肾上腺素能(NE)递质系统相互作用,共同调节情绪、睡眠、认知及运动过程等神经活动;而患者脑卒中后产

Table 5. The effects of ZTTLT on monoamine oxidase A in the brain of PSD mice
表5. 逐痰通络汤对PSD小鼠各脑内单胺氧化酶A的影响
*p < 0.05 and **p < 0.01与对照组相比。

Table 6. The effects of ZTTLT on monoamine oxidase B in the brain of PSD mice
表6. 逐痰通络汤对PSD小鼠脑内单胺氧化酶B的影响

Table 7. The effects of ZTTLT on the activity in open field tests of chronic stress rats
表7. 逐痰通络汤对慢性应激PSD大鼠开野实验的影响
#p < 0.05 and ##p < 0.01与正常对照组相比,*p < 0.05 and **p < 0.01与应激模型组相比。

Table 8. The effects of ZTTLT on the concentration of AC of chronic stress rats
表8. 逐痰通络汤对慢性应激PSD大鼠AC浓度的影响
##p < 0.01与正常对照组相比,*p < 0.05 and **p < 0.01与应激模型组相比。
 ##p < 0.01与空白对照组相比,*p < 0.05与应激对照组相比。
##p < 0.01与空白对照组相比,*p < 0.05与应激对照组相比。
Figure 4. The effects of ZTTLT on the shuttle box test in the model of PSD and stress rats
图4. 逐痰通络汤对慢性应激PSD大鼠穿梭箱实验的影响
生部位病灶效应,破坏了去甲肾上腺素神经元,5-HT神经元及其通路,使神经元递质合成效能较低,从而引起抑郁症状 [9] [10]。DA通路在精神恍惚的抑郁样病人作用更明显 [11]。另有研究发现抑郁症的发病机理与腺苷酸环化酶(AC)有关 [9]。
目前对PSD的治疗策略常常通过减轻抑郁症的症状,但是由于病人对这些治疗方法的忍受性较差,因此还不能满足患者的需求。逐痰通络汤由大黄、胆南星、地龙、全蝎、天麻、郁金、石菖蒲、天竹黄等药物组成,具有化瘀逐痰、活血通络的作用,是临床治疗缺血性中风行之有效的方剂。研究发现,逐痰通络汤可以双相调节脑卒中大鼠体内的纤溶系统和免疫炎症系统,改善中风症状,加快康复 [12];并且逐痰通络汤对脑卒中大鼠的神经细胞有保护作用,可以提高神经营养因子如脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)和Bcl2的表达,保护神经细胞 [13],而逐痰通络汤是否对PSD亦有效及其机制目前尚未有研究。
化合物的抗抑郁活性首先需在动物模型上得到验证强迫游泳测试和悬尾测试是常见的两种行为绝望模型,目前被广泛得运用于抗抑郁药物活性筛选。本研究结果表明逐痰通络汤2~8 g∙kg−1均能降低这两个行为学测试中的不动时间,与经典抗抑郁药氟西汀作用效果类似。不动时间的改变也有可能是中枢神经系统的刺激或抑制引起的,因此给予药物后我们检测了小鼠的自主活动,结果表明逐痰通络汤不会引起中枢神经系统的刺激,因此存在选择性的抗抑郁样作用。
大多数的抗抑郁药如氟西汀,都是通过抑制单胺递质的重摄取来增加突触间隙内单胺递质的水平 [14]。可以推测,重摄取的三重抑制剂可能因其广泛的疗效和起效作用快将会成为较有前景的下一代抗抑郁药。先前有研究证明逐痰通络汤可以调节动物体内神经细胞的凋亡 [13]。因此本研究旨在扩展这些研究,评估逐痰通络汤抗PSD活性中单胺神经递质的作用。此外我们研究主要集中在海马、前额叶皮层、下丘脑、纹状体这4个脑区,这些脑区参与了包括抑郁、焦虑、学习记忆在内的多种重要行为的改变 [10]。目前主流研究认为边缘系统在抑郁症方面有着重要的作用,特别是海马和前额叶这两个脑区 [15]。研究认为这些脑区功能的紊乱是诊断抑郁症患者的一个重要依据 [16]。在本实验中,逐痰通络汤2~8 g∙kg−1能够显著增加海马和前额叶中5-HT和NE的水平,但是对DA含量无明显变化。逐痰通络汤均不影响下丘脑和纹状体的单胺递质含量。神经递质的利用率可以用代谢率来反应,本实验研究结果显示高剂量逐痰通络汤可以降低海马和前额叶中5-HIAA/5-HT比率,效果与氟西汀相似。
中枢单胺递质含量上升涉及抑制递质降解(如抑制单胺氧化酶活性)和抑制突触间隙递质重摄取。然而,逐痰通络汤具有清除氧自由基和羟基的作用,存在抗氧化活性。越来越多的证据显示抑郁发病机制与氧化应激和线粒体功能失调有关。目前及本研究没有建立逐痰通络汤抗PSD活性和抗氧化活性的直接联系,即使这样也不能排除这个可能。单胺氧化酶产生的单胺代谢产物是脑内过氧化氢和氧自由基的主要来源之一,这些过氧化氢和自由基特别对敏感度高的神经系统容易产生氧化应激 [11]。本研究进一步表明逐痰通络汤对多个脑区的5-HT和NE水平都有影响,并第一次表明这些结果是抑制单胺氧化酶活性的结果。抑郁症的炎症和神经变性这一新假说指出氧化应激的激活和炎症可能是抑郁症病程进展的重要原因。逐痰通络汤可以下调单胺氧化酶活性,可以减轻抑郁症状。
抗抑郁药的药效评价一般需要两种动物、两个模型相互验证。本研究另以慢性应激PSD大鼠模型为基础进行研究,结果发现逐痰通络汤2~8 g∙kg−1均对大鼠行为学测试开野实验和穿梭箱失败实验有一定改善,另选择反映情绪变化的中枢部位皮层、海马作为观察区域进行定位研究 [10],研究表明,逐痰通络汤2~8 g∙kg−1能够显著增加海马和皮层中AC活性,从而提示PSD的发病可能与AC有关,并且可能使情绪相关脑区发生变化。
因此本研究显示逐痰通络汤的抗抑郁作用与海马和前额叶皮层内的5-HT浓度、NE浓度、AC活性有关。上述脑区中单胺氧化酶A活性的抑制对增加单胺递质含量及逐痰通络汤的抗抑郁样活性起了重要的作用。
基金项目
温州市科技局课题(编号:Y20130179)。
NOTES
*通讯作者。