1. 引言
中国水仙(Narcissus tazetta var.chinensis)为石蒜科(Amaryllidaceae)水仙属(Narcissus)多年生草本植物。常见的中国水仙有2个品种:1) 单瓣水仙,花单瓣,花冠6裂,呈盘状、白色;副花冠黄色、浅杯状,又名“金盏银台”;2) 重瓣水仙,花重瓣,副花冠和雄蕊花瓣状,瓣形扭转呈簇,又名“玉玲珑” [1] 。水仙一般秋冬开始水养,春节前后即可开花。近年来,居室水养水仙已逐渐形成一种风尚 [2] 。为了提高水仙的观赏价值,人们用各种方法调控水仙生长 [3] 。有关中国水仙的研究,国外未见报道;国内主要研究矮壮素对花期及生长的影响,通过使用矮壮素处理,使水仙植株矮化粗壮,叶片碧绿,不易倒伏,增大花朵直径,减慢细胞解体的作用,延长花期,从而有效提高水仙的观赏价值 [4] - [10] 。也有从冷藏方面入手进行研究的报道 [11] [12] [13] [14] ;还有从生理生化变化、花芽分化、结构变化等方面着手进行研究的报道 [15] [16] [17] [18] 。低温贮藏后,水仙解剖结构方面的研究未见报道。本研究主要从解剖学的角度,研究低温贮藏后,在非正常观赏期,通过水养,观赏单瓣水仙、重瓣水仙花瓣和叶片的显微结构,与正常情况下用矮壮素处理的两个品种相应结构进行对比,了解其变化,为后续水仙生长延缓剂的研发和延长水仙的观赏期提供解剖学依据,也可为保鲜剂的制备提供理论依据。
2. 材料与方法
2.1. 实验材料
本实验材料为来自漳州百叶水仙基地的三年生单瓣水仙、重瓣水仙。
2.2. 水仙鳞茎低温处理方法
于元旦前,选择饱满、健壮、无损害、大小一致的单瓣水仙、重瓣水仙鳞茎,经除去干枯的鳞片叶、用多层吸水纸包裹鳞茎,置于冰箱的生物保鲜格,温度控制在1℃~4℃之间,贮藏时间为6~10 m。
2.3. 正常观赏期鳞茎水养处理方法
在春节前,各选取大小一致的两个品种水仙鳞茎,剥去鳞茎外表的褐色鳞片,并刮净旧根,放入市售矮壮素(主要成分为PP333)培养液,浸泡2 d,此后用清水培养,每天换水,置于
20 ℃
光照恒温箱中培养,保证12 h光照,12 h黑暗,水养至开花。并设4组对照。
2.4. 低温贮藏后鳞茎水养处理方法
在夏秋季节,选取低温保存6~10 m的两个品种水仙鳞茎,剥去鳞茎外表的褐色鳞片,并刮净旧根,放入清水中进行水培。置于
20 ℃
光照恒温箱中培养,每天换水,保证12 h光照,12 h黑暗,水养至开花。并设4组对照。
2.5. 组织切片制作方法
在水养的不同时期,分别切取不同处理方法、不同发育阶段的水仙叶片的中间部分及花,用卡诺氏固定液固定,爱氏苏木精整体染色、1%碱性品红酒精液复染。常规石蜡切片法制片,切片厚度为8 μm,光学树胶封固,Olympus显微镜观察并摄影。
数据测量、统计、计算方法:观察相同时期的15个视野的切片材料,对每个视野中的细胞大小、比值进行测量、计算,再统计其平均值。
3. 观察结果
低温保存的两个品种水仙,水养12~15 d后,可以观赏。从外观上看,花葶明显矮化,叶片翠绿,无倒伏现象,达到了添加矮壮素后的效果,但观赏时间较正常观赏的时间短。
低温保存、矮壮素处理的水仙,水养发育过程均可分为三个阶段:幼嫩期、生长期和成熟期。幼嫩期是浸水萌动到叶片抽出、可见绿叶前的时期;生长期是绿色叶片生长到花葶伸出、花苞破裂前的时期;成熟期是花苞破裂、花柄明显伸长到观赏结束的时期。
实验组与对照组的结构变化基本一致。
3.1. 成熟花瓣、成熟叶片的内部结构
在显微镜下观察可见:不同处理方法的两个品种水仙的成熟花瓣横切面由表皮、薄壁组织和维管束三部分组成。表皮细胞壁薄,排列紧密。薄壁组织细胞形状不一,有明显细胞间隙。维管束位于薄壁组织中,组成的薄壁细胞层数有区别,属有限外韧维管束(图版1、图版2)。副花冠的结构与花瓣的相似(图版3)。两个品种水仙的成熟叶片横切面由表皮,叶肉和维管束三部分组成,属等面叶。表皮细胞一层,有气孔器,外被角质层。叶肉由薄壁细胞组成,近表皮的细胞较小、含叶绿体较多,中部的细胞较大、不含或极少含叶绿体;具发达的胞间隙。维管束三列,与表皮层平行;有大型、小型之分,均为有限外韧维管束;大型维管束一列,位于叶肉组织的中央,单个维管束径向呈长条形;小型维管束位于近表皮层的叶肉薄壁组织中,上下各一列;呈圆形。每一相邻大型维管束间,均有1至数对小型维管束分布(图版4、图版5)。
3.2. 花瓣、叶片的内部结构比较
3.2.1. 幼嫩期花瓣的结构特点
在显微镜下,两个品种幼嫩期花瓣横切面可见:上、下表皮均1层细胞,细胞均排列紧密。副花冠:上表皮细胞厚度为15.6 ± 6.2 μm,下表皮细胞厚度为15.1 ± 5.4 μm。薄壁组织由3~6层薄壁细胞组成,无细胞间隙。维管束尚处于分化早期,一列位于薄壁组织中,呈近圆形,与表皮层平行,整体径向长度为35.3 ± 6.9 μm;木质部发育早于韧皮部(图版6)。花瓣:上表皮细胞厚度13.7 ± 6.1 μm,下表皮细胞厚度12.3 ± 6.2 μm。薄壁组织含薄壁细胞5~8层,无细胞间隙。维管束一列位于薄壁组织中,呈近圆形,木质部发育早于韧皮部,整体径向长度为45.3 ± 8.6 μm;维管束发育要晚于副花冠的(图版7)。重瓣水仙花瓣的结构与单瓣水仙花瓣结构相似;维管束的发育时间要比单瓣水仙的早,整体径向长度为27.9 ± 8.6 μm (图版8)。低温处理的花瓣与矮壮素处理的花瓣内部结构差别不大。不同处理方法的材料,在此阶段延续的时间不同:低温处理的持续的时间短,矮壮素处理的持续的时间长。
3.2.2. 幼嫩期叶片的结构特点
在显微镜下,两个品种幼嫩期叶片横切面可见:叶片呈弯月形,中部稍厚,两端渐渐收窄。上、下表皮细胞均为1层,排列紧密。上表皮细胞厚度为21.5 ± 4.7 μm,下表皮细胞厚度为22.3 ± 4.4 μm,表皮细胞外切向壁有轻微角质化。叶肉组织中部含12~25层薄壁细胞,细胞的形状不规则,胞间隙不明显,靠边缘的分化早;叶片边缘的薄壁细胞层数较中部的少,最端部有7~8层薄壁细胞。叶中央部位具维管束一列,位于薄壁组织中央,与表皮层平行,稍偏向上表皮,径向呈长条形带状;此时导管和筛管逐渐形成,导管发育早于筛管。维管束整体径向长度329.2 ± 38.2 μm。在近上表皮和下表皮部位的叶肉薄壁组织,具较密、较小,与大型维管束相间而生的小型维管束对的初始结构,这些小型维管束初始结构呈团状分布,尚未分化,组成细胞比较小、细胞核较大。小型维管束呈近圆形,径向长度为58.4 ± 8.7μm (图版9、图版10)。低温处理的叶片与矮壮素处理的叶片内部结构差别不大。不同处理方法的材料,在此阶段延续的时间不同:低温处理的持续的时间短,维管束分化较快;矮壮素处理的持续的时间长,维管束分化较慢。
3.2.3. 生长期花瓣结构的相同点
在显微镜下,两个品种生长期花瓣横切面可见:
花瓣:表皮由1层细胞组成;外切向壁有轻微角质化。上表皮细胞厚度为15.2 ± 3.9 μm,下表皮细胞厚度为16.3 ± 3.7 μm。薄壁组织由5~10层薄壁细胞组成,有细胞间隙。维管束一列呈椭圆形,整体径向长度为41.3 ± 9.6 μm (图版11)。副花冠:表皮的外切向壁有轻微角质化。上表皮细胞厚度为14.1 ± 3.9 μm,下表皮层细胞厚度为14.6 ± 3.7 μm,上表皮层边缘开始形成波浪状。薄壁组织由4~6层薄壁细胞构成。维管束一列位于薄壁组织中,整体径向长度为39.6 ± 5.4 μm (图版12)。
3.2.4. 生长期花瓣结构的区别点
在生长期,不同处理方法的两个品种花瓣横切面结构,除具上述相同结构外,有以下的区别(表1)。
3.2.5. 生长期叶片结构的相同点
在显微镜下,两个品种生长期叶片横切面可见:叶片呈弯月形,中部稍厚,两端渐渐收窄。上、下表皮细胞形态变为近椭圆形或长方形,外切向壁角质化明显。上表皮细胞厚32.3 ± 5.3 μm,下表皮细胞厚28.0 ± 3.0 μm。叶肉组织含18~31层薄壁细胞,靠近表皮的薄壁细胞较中部的薄壁细胞小,含叶绿体数量多,细胞间隙不明显。而中部的薄壁细胞形态不规则,越往中部体积越大;细胞高度液泡化,细胞间隙明显。位于叶片中部的大型维管束,呈长条状,早期整体径向长度为316.8 ± 33.6 μm;后期整体

Table 1. Comparison the structures of the petals in growth period
表1. 生长期花瓣的结构比较
径向长度为426.7 ± 35.6 μm。靠近上、下表皮层的小型维管束,早期近圆形,维管束整体径向长度为68.5 ± 6.8 μm;后期近圆形,维管束整体径向长度为85.2 ± 10.5 μm,木质部较韧皮部发达。小型维管束与表皮间的叶肉薄壁细胞含的叶绿体较多,两列小型维管束间的叶肉薄壁细胞含的叶绿体少或不含(图版18)。不同处理方法材料,在此阶段延续的时间不同:低温处理的持续的时间短,矮壮素处理的持续的时间长。
3.2.6. 生长期叶片结构的区别点
在生长期,不同处理方法的两个品种材料,叶片横切面结构除了上述相同结构外,具有以下的区别(表2)。
3.2.7. 成熟期花瓣结构的相同点
在显微镜下,两个品种成熟期花瓣横切面可见:上、下表皮细胞形态渐渐变得不规则,表皮细胞有向外突起、也有向内凹陷,细胞壁厚度随着植物生长发育逐渐增厚。薄壁细胞较大,且靠近中间的部分细胞比较大,近表皮层的逐步变小。维管束呈椭圆形,维管束整体径向长度为66.6 ± 9.2 μm (图版26)。副花冠也渐趋解体、萎缩;上、下表皮层的细胞逐渐变形,解体;维管束整体径向长度为50.8 ± 16.6 μm。
3.2.8. 成熟期花瓣结构的区别点
在成熟期,不同处理方法的两个品种花瓣、副花冠横切面结构,薄壁组织细胞胞间隙增大、部分薄壁细胞解体,花瓣非维管束部位出现明显空腔。除了上述相同结构外,具有以下的区别(表3)。
3.2.9. 成熟期叶片结构的相同点
在显微镜下,两个品种成熟期叶片横切面可见:上、下表皮层的细胞角质层加厚、细胞近方形;上表皮细胞厚度为23.4 ± 4.6 μm,下表皮细胞厚度为20.9 ± 4.4 μm。叶肉组织中央的大型维管束间的薄壁细胞解体,形成比生长期后期更大的空腔。位于上表皮与小型维管束、下表皮与小型维管束间的薄壁细胞相对保持较好;含有较多叶绿体、解体细胞少。大型维管束径向呈长条状、整体径向长度为550.1 ± 57.8 μm;小型维管束近圆形、整体径向长度为114.8 ± 28.0 μm (图版32)。不同处理方法的材料,在此阶段延续的时间不同:低温处理的持续的时间短,矮壮素处理的持续的时间长。
3.2.10. 成熟期叶片结构的区别点
在成熟期,不同处理方法的两个品种材料,叶片横切面结构中两大型维管束间薄壁组织形成的空腔大,大型维管束的薄壁细胞较多解体,除上述相同结构外,具有以下的区别(表4)。

Table 2. Comparison the structures of the leaves in growth period
表2. 生长期叶片的结构比较

Table 3. Comparison the structures of the petals in mature period
表3. 成熟期花瓣的结构比较

Table 4. Comparison the structures of the leaves in mature period
表4. 成熟期叶片的结构比较
4. 讨论
4.1. 低温保存后花瓣的结构变化与营养消耗相关
低温处理两个品种花瓣的薄壁细胞发育和解体的进程基本相似:薄壁组织细胞形态均不规则,细胞壁较薄。幼嫩期薄壁组织细胞排列紧密,无明显细胞间隙。随着植物生长发育,薄壁组织细胞排列越来越松散,出现了明显的细胞间隙并且逐渐增大。到了成熟期,上、下表皮细胞逐渐有凹陷、变形现象产生;薄壁细胞出现萎缩、解体,导致花瓣非维管束部位明显收缩。这是由于在非正常开花季节开花,鳞茎长时间低温贮藏,消耗了较多营养物质,花瓣组织因营养不足、细胞解体导致产生空腔;维管束木质部导管分子数目增多、呈线状排列,也与需加强水分及无机盐的运输、提高花瓣刚性以维持生长有关。由于贮藏时间较长,鳞茎内贮藏的营养物质消耗较多,此时的花期较正常观赏期处理材料的短。重瓣水仙薄壁细胞解体首先发生在外围的花瓣中,使花瓣出现衰老。解体部位位于上、下表皮之间,并随着解体范围的扩大形成空腔,重瓣水仙花瓣出现空腔数量比单瓣水仙的多、范围大、而且出现的时间早。低温处理材料花瓣与矮壮素处理的花瓣的主要不同点在于:薄壁细胞解体的时间提前及维管束在后期的变化。这是因为矮状素是一种生物生长延缓剂,能阻碍内源赤霉素的合成,延缓细胞伸长 [17] ,使植株纵向生长受到抑制 [18] ;并能减缓花瓣的生长发育进程,延缓衰老时间。相比营养物质消耗过多的低温处理材料,矮状素处理的材料各个阶段延续的时间长,水仙的观赏时间也长。
4.2. 低温保存后叶片的结构变化与合成的不足、营养消耗相关
低温保存后,两个品种水仙叶片薄壁细胞解体的时间和程度,以及小维管束后期明显的半周木类型,与矮状素处理的叶片有不同。矮壮素处理的叶片,发育进入到成熟期的中后段,其表皮细胞排列依旧紧密;叶肉薄壁细胞的胞间隙变大,并在大维管束之间薄壁细胞逐步解体,以后会逐渐增多,并涉及含叶绿体的细胞,从而形成空腔;部分表皮细胞下形成一些类似气孔下室的空腔,使叶片的刚性逐渐变小。低温保存处理的叶片,在生长期的时候,就出现了小范围内薄壁细胞解体现象及形成类似气孔下室的空腔;成熟期变化更加明显;刚性的增加导致相应的细胞增多,使半周木型维管束明显;但在生长期并不涉及那些含叶绿体的薄壁细胞,在成熟期时,涉及少量含叶绿体的细胞。
叶片中的薄壁细胞解体形成空腔,有认为是大型的贮水细胞破裂后,形成的贮水组织、或认为是气腔、也有认为是由大型的薄壁细胞发育形成分泌道,并认为它们可能起着分泌道和通气腔的作用,以增加叶片内的气体交换,从而适应光照弱和相对缺氧的阴生环境 [19] 。从实验结果可以看出:成熟期由于繁殖器官的发育,加上营养器官的代谢,细胞衰老导致的死亡增加,空腔是由薄壁细胞破裂而形成的,且未见分泌道在这阶段解体,这与石蒜科的其它种类有别。一般细胞原生质体被分解后,可再被组织吸收利用 [20] ,但低温处理的材料,由于营养消耗的原因,这种机率大大下降,同时叶肉细胞中的叶绿体结构出现不可逆转的损害,而使叶片呈现衰老特征,因此观赏期短于正常观赏期用矮壮素处理的材料。
薄壁细胞解体首先发生在大型维管束之间的薄壁细胞,并随着解体范围的扩大形成空腔,空腔的出现使植物的叶片刚性逐渐减小。矮壮素处理的破损程度相对较低,叶绿体的完好率较高,这主要是矮状素处理液中,含有抗氧化、清除自由基、减少乙烯的产生、还能降低溶液的pH值、抑制微生物的产生等作用的成分,可促使材料的气孔关闭,降低蒸腾作用;同时磷、钾、铝等元素,还有利于植株对糖份的运输作用 [10] 。因此在成熟期后期,矮壮素处理材料能延迟细胞解体、衰老等现象发生,有效提高观赏价值;低温处理的材料则没有这种变化。
4.3. 低温保存对水仙反季节栽培观赏及水仙保鲜剂研制的意义
传统的水仙观赏一般在元旦至春节期间开放,花期集中,观赏期有季节性限制。而低温保存后的水仙开花可推迟到8月份以后,实现反季节观赏,但观赏期较正常条件的短。低温保存后的水仙在夏秋时节进行水养,从外观上看,花葶明显矮化,叶片翠绿,无倒伏现象,达到了添加矮壮素后的效果,提高了观赏价值。
实验表明,低温贮藏水仙可以调整花期,使水仙反季节开花,所以研究冷藏保存下的水仙的解剖结构,对继续研究水仙的保鲜剂提供了依据。本次实验观察到水仙叶片和花瓣各种细胞的有规律的变化,为低温处理下的后续研究提供了资料。
图版说明
1、矮壮素处理成熟的单瓣水仙花瓣。比例尺 = 55 μm (×75)
2、低温处理成熟的重瓣水仙花瓣。比例尺 = 18 μm (×220)
3、低温处理成熟的单瓣水仙副花冠。比例尺 = 25 μm (×140)
4、矮壮素处理成熟的重瓣水仙叶片。比例尺 = 60 μm (×60)
5、低温处理成熟的单瓣水仙叶片。比例尺 = 70 μm (×75)
6、矮壮素处理幼嫩期单瓣水仙副花冠。比例尺 = 24 μm (×170)
7、矮壮素处理幼嫩期单瓣水仙花瓣。比例尺 = 20 μm (×150)
8、矮壮素处理幼嫩期重瓣水仙花瓣。比例尺 = 12 μm (×270)
9、低温处理幼嫩期单瓣水仙叶片。比例尺 = 42 μm (×70)
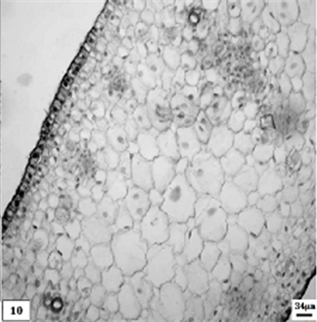
10、低温处理幼嫩期重瓣水仙叶片。比例尺 = 34 μm (×90)
11、低温处理生长期单瓣水仙花瓣。比例尺 = 9 μm (×330)
12、低温处理生长期单瓣水仙副花冠。比例尺 = 11 μm (×270)
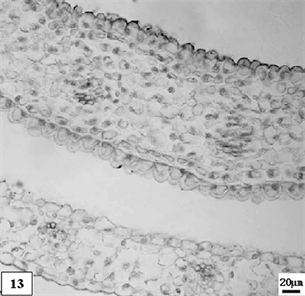
13、低温处理生长期单瓣水仙花瓣。比例尺 = 20 μm (×150)
14、低温处理生长期单瓣水仙副花冠。比例尺 = 11 μm (×320)
15、低温处理生长期重瓣水仙花瓣。比例尺 = 11 μm (×320)
16、矮壮素处理生长期单瓣水仙花瓣。比例尺 = 12 μm (×290)
17、矮壮素处理生长期重瓣水仙花瓣。比例尺 = 15 μm (×120)
18、矮壮素处理生长期重瓣水仙叶片。比例尺 = 35 μm (×80)
19、低温处理生长期单瓣水仙叶片,示针晶。比例尺 = 30 μm (×110)
20、低温处理生长期单瓣水仙叶片,示分泌腔。比例尺 = 16 μm (×220)
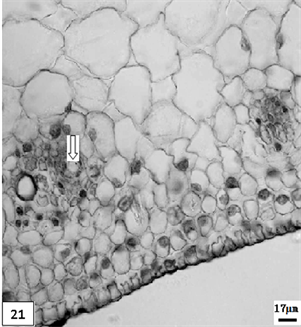
21、低温处理生长期单瓣水仙叶片,示分泌腔。比例尺 = 17 μm (×190)
22、低温处理生长期重瓣水仙叶片,示小型维管束。比例尺 = 14 μm (×250)
23、矮壮素处理生长期单瓣水仙叶片,示分泌腔。比例尺 = 55 μm (×70)
24、矮壮素处理生长期重瓣水仙叶片。比例尺 = 18 μ m (×220)
25、矮壮素处理生长期重瓣水仙叶片,示小型维管束。比例尺 = 36 μm (×110)
26、矮壮素处理成熟期单瓣水仙花瓣。比例尺 = 38 μm (×90)
27、低温处理成熟期单瓣水仙副花冠。比例尺 = 12 μm (×270)
28、低温处理成熟期单瓣水仙花瓣,示维管束。比例尺 = 11 μm (×320)
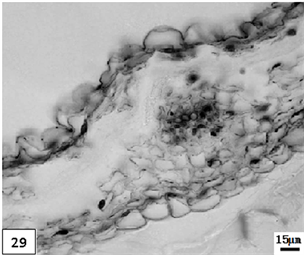
29、低温处理成熟期重瓣水仙花瓣。比例尺 = 15 μm (×260)
30、矮壮素处理成熟期单瓣水仙花瓣。比例尺 = 13 μm (×300)
31、矮壮素处理成熟期重瓣水仙花瓣。比例尺 = 13 μm (×300)
32、低温处理成熟期单瓣水仙叶片。比例尺 = 36 μm (×110)
33、低温处理成熟期单瓣水仙叶片,示小型维管束。比例尺 = 14 μm (×250)
34、低温处理成熟期重瓣水仙叶片,示小型维管束。比例尺 = 13 μm (×230)
35、矮壮素成熟期单瓣水仙叶片。比例尺 = 13 μm (×230)
36、矮壮素成熟期重瓣水仙叶片。比例尺 = 6 μm (×500)
Plate
1. The mature period petal of univalve flower treatments by the CCC. Scale bar = 55 μm (×75)
2. The mature period petal of multiple valve flower treatments by the low temperature preservation. Scale bar = 18 μm (×220)
3. The mature period catacorolla of univalve flower treatments by the low temperature preservation. Scale bar = 25 μm (×140)
4. The mature period leaf of multiple valve flower treatments by the CCC. Scale bar = 60 μm (×60)
5. The mature period leaf of univalve flower treatments by the low temperature preservation. Scale bar = 70 μm (×75)
6. The namely tender period catacorolla of univalve flower treatments by the CCC. Scale bar = 24 μm (×170)
7. The namely tender period petal of univalve flower treatments by the CCC. Scale bar = 20 μm (×150)
8. The namely tender period petal of multiple valve flower treatments by the CCC. Scale bar = 12 μm (×270)
9. The namely tender period leaf of univalve flower treatments by the low temperature preservation. Scale bar = 42 μm (×70)
10. The namely tender period leaf of multiple valve flower treatments by the low temperature preservation. Scale bar = 34 μ m (×90)
11. The growth period petal of univalve flower treatments by the low temperature preservation. Scale bar = 9 μm (×330)
12. The growth period catacorolla of univalve flower treatments by the low temperature preservation. Scale bar = 11 μm (×270)
13. The growth period petal of univalve flower treatments by the low temperature preservation. Scale bar = 20 μm (×150)
14. The growth period catacorolla of univalve flower treatments by the low temperature preservation. Scale bar = 11 μm (×320)
15. The growth period petal of multiple valve flower treatments by the low temperature preservation. Scale bar = 11 μm (×320)
16. The growth period petal of univalve flower treatments by the CCC. Scale bar = 12 μm (×290)
17. The growth period petal of multiple valve flower treatments by the CCC. Scale bar = 15 μm (×120)
18. The growth period leaf of multiple valve flower treatments by the CCC. Scale bar = 35 μm (×80)
19. The growth period leaf of univalve flower treatments by the low temperature preservation, show the crystal. Scale bar = 30 μm (×110)
20. The growth period leaf of univalve flower treatments by the low temperature preservation, show the secretory cavity. Scale bar = 16 μm (×220)
21. The growth period leaf of univalve flower treatments by the low temperature preservation, show the secretory cavity. Scale bar = 17 μm (×190)
22. The growth period leaf of multiple valve flower treatments by the low temperature preservation, show the small vascular bundle. Scale bar = 14 μm (×250)
23. The growth period leaf of univalve flower treatments by the CCC, show the secretory cavity. Scale bar = 55 μm (×70)
24. The growth period leaf of multiple valve flower treatments by the CCC. Scale bar = 18 μm (×220)
25. The growth period leaf of multiple valve flower treatments by the CCC, show the small vascular bundle. Scale bar = 36 μm (×110)
26. The mature period petal of univalve flower treatments by the CCC. Scale bar = 38 μm (×90)
27. The mature period catacorolla of univalve flower treatments by the low temperature preservation. Scale bar = 12 μm (×270)
28. The mature period petal of univalve flower treatments by the low temperature preservation, show the vascular bundle. Scale bar = 11 μm (×320)
29. The mature period petal of multiple valve flower treatments by the low temperature preservation. Scale bar = 15 μm (×260)
30. The mature period petal of univalve flower treatments by the CCC. Scale bar = 13 μm (×300)
31. The mature period petal of multiple valve flower treatments by the CCC. Scale bar = 13 μm (×300)
32. The mature period leaf of univalve flower treatments by the low temperature preservation. Scale bar = 36 μm (110)
33. The mature period leaf of univalve flower treatments by the low temperature preservation, show the small vascular bundle. Scale bar = 14 μm (×250)
34. The mature period leaf of multiple valve flower treatments by the low temperature preservation, show the small vascular bundle. Scale bar = 13 μm (×230)
35. The mature period leaf of univalve flower treatments by the CCC. Scale bar = 13 μm (×230)
36. The mature period leaf of multiple valve flower treatments by the CCC. Scale bar = 6 μm (×500)
图版