1. 引言
大黄酸在蓼科、豆科、芸香科及百合科等多种植物中广泛分布,具有抗病毒、抗肿瘤、抗炎以及降糖调脂等生物活性 [1] [2] [3] [4] 。从结构上看,大黄酸含有平面状的1,8-二羟基蒽醌结构单元,具有电化学氧化还原性质 [5] [6] ,其特殊的平面结构以及结构中存在的1位羟基、8位羟基和3位羧基导致该化合物溶解度差,生物利用度低。近年来,研究人员为了改善大黄酸类衍生物的理化性质,提高生物利用度,发现新的适应症,主要围绕大黄酸的1位羟基、8位羟基和3位羧基进行修饰 [7] ,以期得到成药性好的衍生物。值得一提的是,将大黄酸1位和8位的羟基乙酰化后得到双乙酰大黄酸(双醋瑞因,Diacerein)(结构如图1所示),作为治疗骨关节炎的药物已经在意大利上市,可被人体迅速代谢为大黄酸而发挥作用 [7] [8] [9] 。本文简要综述了大黄酸衍生物的合成及其在降血糖、消炎以及抗肿瘤等方面的生物活性研究进展。
2. 具降血糖活性的大黄酸衍生物
最初,曹贺 [8] 等人以大黄酸为母体,设计并合成大黄酸-酰胺类衍生物,得到化合物库1 (见图2)。在糖尿病肾病小鼠模型上的构效关系研究表明:当把3位羧基衍生化为酰胺时,这些衍生物均表现出明显的降血糖活性。为了丰富化合物的结构多样性,改善衍生物的生物利用度,Zhu [10] 等人用酸酐或TBSCl
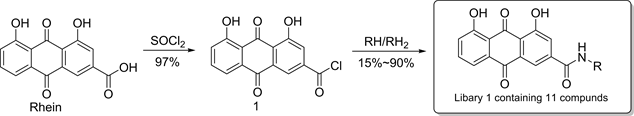
Figure 2. Synthesis of compound library 1
图2. 化合物库1的合成
保护大黄酸母核上的两个羟基,分别得到中间体2和3,然后在碱性条件下与各种类型的胺缩合,得到化合物库2(见图3)。
在HepG2细胞模型上摄取葡萄糖的能力研究结果显示 [11] ,当这些化合物浓度设定为10 mg∙L−1时,HepG2细胞吸收葡萄糖的能力较对照组大黄酸在相同浓度下HepG2细胞吸收葡萄糖的能力有所提升,通过测定其ClogP值对比发现,尤其化合物4(ClogP = 8.924)和化合物5(ClogP = 9.938)较对照组大黄酸(ClogP = −1.633)具有显著的差异。这些结果说明,一方面引入的TBS基团可以调节其脂水分配系数,改善其溶解度,进而使其生物利用度得到进一步提升,另一方面当把羧基修饰改造生成各种酰胺类化合物时,可明显提高其降血糖活性。
基于此,为了得到高活性的降血糖药物,Zhu [12] 等人设想:如果保留羧基,在母核上引入其他基团,还能否具有降血糖活性?他们以大黄素(Emodin)为原料,在大黄酸母核的6位引入烷氧基,设计并合成了化合物21-25,以期得到高活性降血糖化合物。具体合成路线如图4所示 [12] [13] ,首先以商品化合物大黄素为母体和不同链长的溴代烷烃于微波反应器中反应得到化合物6-10,然后在碱性条件下,化合物6-10和乙酸酐反应得到含乙酰氧基的化合物11-15,最后经过氧化和脱保护得到化合物21-25。
通过测定化合物21-25对α-葡萄糖淀粉酶的抑制活性研究显示 [12] ,所有化合物对酶均有抑制作用。当浓度为100 mg∙L−1时,化合物21和化合物22较对照组大黄素对α-葡萄糖淀粉酶的抑制活性有所提高,有意思的是,含正辛烷氧基的化合物23(Ki = 60.6%)对酶表现出最强的抑制活性,是大黄素(Ki = 23.6%)的3倍左右,而化合物24和化合物25抑制作用又逐渐减弱,说明取代基的链长对活性有明显的影响。这些结果显示,保留羧基,对大黄酸母核其他位置进行修饰改造,引入一些脂溶性基团,有利于改善溶解度,提高生物利用度和降血糖活性。有趣的是,随着引入的烷烃链的增长,化合物对α-葡萄糖淀粉酶的抑制作用也随之加强,但当碳原子数大于8时,其抑制作用又逐渐减弱 [11] 。这些结果说明,当引入的
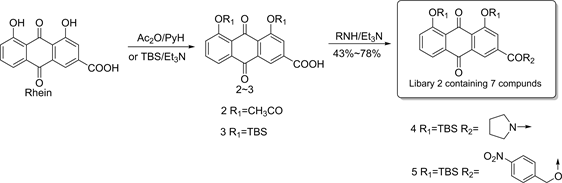
Figure 3. Synthesis of compound library 2
图3. 化合物库2的合成
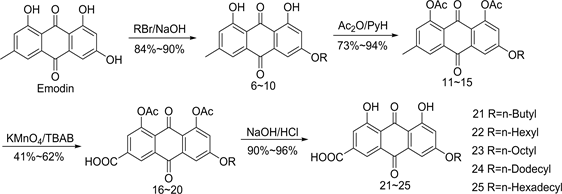
Figure 4. Synthesis of compound 21-25
图4. 化合物21-25的合成
烷烃链越长,产生的位阻就越大,从而会影响化合物与酶的相互作用。因此只有当引入适当链长的烷烃时,才具有较好降血糖活性。
3. 具抗炎活性的大黄酸衍生物
研究表明,大黄酸还具有显著的抗炎活性,Owton [14] 等人早期以大黄酸为母体,设计合成治疗骨关节炎的大黄酸衍生物。经对豚鼠口服给药后发现:当大黄酸的1,8-二羟基甲基化,5号位置连接氟原子时得到化合物26(图5),与双醋瑞因相比可以显著提高抗炎作用,但这类化合物具有遗传毒性 [14] 。为了克服以上缺陷,Baxter [15] 等人在大黄酸1,8-二羟基位置进行结构修饰,设计合成一系列大黄酸酯类衍生物,实验结果表明,化合物27(图6)抗炎作用最为显著,究其原因,主要在于连接的酯基不但能够改善其溶解度、降低胃肠道毒副作用,还可以阻碍抗炎因子的释放,从而大大增强抗炎活性。后来蔡进等人将以多聚醇为连接体,将大黄酸和非甾体抗炎药对接偶联,形成新型抗炎化合物,合成得到小型化合物库3和化合物库4。具体合成路线如图7所示 [16] [17] ,首先大黄酸先经过乙酰化和酰氯化得到化合物28,然后与不同链长的多聚醇(n = 1,2,3)反应得到化合物29-31,随后在碱性条件下,化合物29-31和非甾体抗炎药偶联得到化合物库3,化合物库3的化合物经去乙酰化得到化合物库4。
在体外活性测试结果表明 [16] ,化合物库3和化合物库4中的所有化合物对HAP(羟基磷灰石)都有一定的吸收能力。当剂量为80mg时,化合物32和化合物33对HAP的吸收率均能达到70%,表现了良好的骨靶向性。在体内活性测试结果表明,大部分化合物对耳廓肿大老鼠显示抗炎效果,其中化合物32和化合物33的抗炎作用最为突出。值得一提的是化合物32的抗炎效果明显优于双醋瑞因,这些结果为开发新型高效抗炎药物提供了思路。
4. 具抗肿瘤活性的大黄酸衍生物
研究显示,大黄酸具有一定的抗肿瘤活性,这主要与平面状的1,8-二羟基蒽醌结构单元有关 [18] 。Yang等人将大黄酸3位的羧基转换成氨基,设计并合成了小规模化合物库5 [19] ,以期得到具有抗肿瘤活性的化合物。具体合成路线如图8所示 [20] [21] ,首先将大黄酸的两个羟基和一个羧基甲基化,得到中
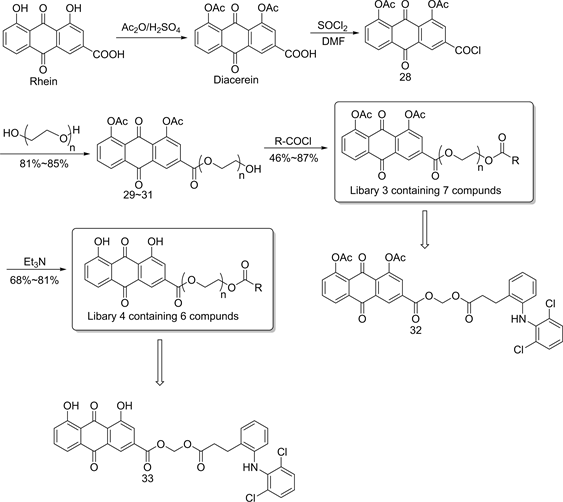
Figure 7. Synthesis of compound library 3 and 4
图7. 化合物库3和化合物库4的合成

Figure 8. Synthesis of compound library 5
图8. 化合物库5的合成
间体34,然后水解得到酸性中间体35,中间体35在碱性条件下和叠氮磷酸二苯酯反应得到化合物36,经库尔提斯重排(Curtius rearrangement)反应得到氨基化合物37,化合物37经去甲基化后得到化合物38,之后与氯乙酰氯反应得到化合物39,最后化合物39与不同的胺反应得到化合物库5。
在HeLa细胞和MOLT4细胞模型上的活性测试结果表明,这些衍生物对这2种细胞都有一定的抑制作用 [19] 。其中化合物39的抗肿瘤活性明显优于化合物库5中的所有化合物,对HeLa细胞(IC50 = 2.7 μmol∙L−1)和MOLT4细胞(IC50 = 0.6 μmol∙L−1)分别表现了良好的细胞毒活性。这些结果说明,化合物39连接的氯乙酰基侧链容易与DNA结合,使其构象发生改变,从而抑制肿瘤细胞的生长 [20] 。
此外,Huang [22] 等人将大黄酸3位的羧基通过酯化反应得到酯衍生物(化合物库6,见图9)。
HeLa细胞活性测试结果表明,随着化合物浓度的增大,这些酯类衍生物对HeLa细胞株的抑制作用普遍强于相同浓度下大黄酸对HeLa细胞株的抑制作用,其中化合物40在浓度为100 μg∙mL−1时,抑制作用最为明显,可达到70%,但低于对照组喜树碱在相同浓度下对HeLa细胞株的抑制作用。此外,随着酯基的位阻变大,衍生物对HeLa细胞株的抑制作用明显减弱,这些信息为设计、合成新型高效抗肿瘤的大黄酸衍生物提供了宝贵的思路。
在Huang等人的研究基础上,Tian [23] [24] 等人继续设计并合成了1,8-二乙酰基大黄酸-(2-溴)-乙酯(化合物41)。具体的合成路线如图10所示 [23] ,先将大黄酸的1,8-二羟基进行双乙酰化得双乙酰大黄酸,然后在碱性条件下,与1,2-二溴乙烷反应得化合物41。对比化合物41和大黄酸的LogP值,发现化合物41的LogP值明显小于大黄酸,说明化合物41的水溶性明显优于大黄酸。化合物41对骨肉瘤MG-63细胞的生长抑制结果表明,化合物41对骨肉瘤MG-63细胞的抑制作用明显高于相同浓度下大黄酸对MG-63细胞的抑制作用,有可能是因为引入的卤素增强了化合物与DNA的相互作用,从而提高化合物的抗肿瘤活性。
5. 总结与展望
综上所述,大黄酸作为生物活性广泛的天然产物,引起了国内外学者的广泛关注。对大黄酸及其衍生物在抗肿瘤、抗炎、降血糖等领域的研究成果,为后续进一步改善化合物的成药性和发现新的适应症积累宝贵的经验,也为基于天然产物发现新型药物的研发理念提供了新的案例。由于其特殊的平面结构导致化合物溶解度差,生物利用度低,但以双醋瑞因为代表的实例作为治疗骨关节的药物已经在意大利上市。因此,我们坚信在不久的将来会有成药性好的大黄酸药物出现,前景广阔,值得我们进一步探究。
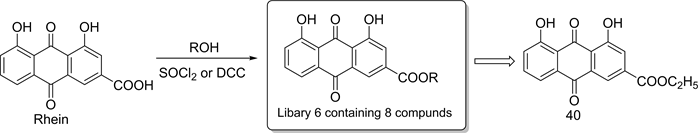
Figure 9. Synthesis of compound library 6
图9. 化合物库6的合成
基金项目
国家自然科学基金面上项目(21772068),江苏省产学研前瞻性联合研究项目(BY2016022-37)。
NOTES
*通讯作者。