1. 引言
虾夷马粪海胆(Strongylocentrotus intermedius)又称中间球海胆,原产于日本北海道及以北沿海,在俄罗斯远东地区的萨哈林岛等地也有分布。大连海洋大学于1989年将其从日本引进到中国,现已成为中国北方沿海特别是辽东和山东半岛重要的养殖种类,其养殖规模也越来越大,随着海胆养殖业的发展,其也面临着多种病害的威胁,因此研究其免疫相关基因的表达模式就显得尤为重要,也能为虾夷马粪海胆的免疫学基础研究提供参考依据。目前虾夷马粪海胆的NLR基因家族 [1],TLR基因家族 [2] 等均有其与免疫相关的研究结果,通过这些免疫相关的研究已经对虾夷马粪海胆的免疫应答有了初步的了解,但并不完善。通过对高通量测序得到的虾夷马粪海胆转录组数据的分析 [3],发现了一个与免疫反应相关的基因LRCH2-like基因,该基因可能与NLR信号通路有关,参与NLR信号通路中的一条途径的免疫反应。本研究通过对虾夷马粪海胆转录组数据的分析,筛选出LRCH2-like基因的部分片断,采用cDNA末端快速扩增(RACE)技术克隆得到了一条虾夷马粪海胆LRCH2-like基因的全长cDNA序列,通过实时定量的方法研究了LRCH2-like基因在虾夷马粪海胆的不同组织中的表达情况,使用5种病原对虾夷马粪海胆的体腔细胞进行刺激,对不同时间点的体腔细胞进行实时定量PCR检测LRCH2-like基因的表达量变化。
LRCH2样蛋白是LRCH (leucine-rich repeat and calponin homology domain-containing protein)蛋白亚家族的一员,该蛋白亚家族隶属于LRR蛋白超家族。LRR蛋白至少可以分为7个不同的亚家族,如核糖核酸酶抑制剂(RI)样的亚家族,包括核糖核酸酶抑制剂(RI)和GTP酶活化蛋白malp;SDS22样亚家族,包括Rab脂酯转移酶(geranylgeranyltran sferase),internalin B,动力轻链蛋白1(dynein light chain 1);含半胱氨酸的LRR亚家族,包括Skp2,SLRP,NLRR,LRRC4;细菌LRR,包括YopM,lpa4,lpa7;植物特异性LRR;TpLRR;典型的LRR蛋白 [4] 。LRR蛋白中富亮氨酸重复序列的数目可以从血小板糖蛋白中的1个,到植物疾病抑制蛋白Cf-2中的38个。真核LRR蛋白的富亮氨酸重复基序一般为20~29个,LRR最常见的长度一般为23~24个含保守亮氨酸的氨基酸残基。LRR蛋白广泛存在于病毒、酵母和哺乳动物的各个组织中 [5],越来越多含LRR的蛋白已被发现 [6] [7] [8] [9],其表达定位十分广泛,可以定位在细胞浆、细胞核、细胞质基质、血清和细胞膜的膜内区和膜外区。LRR蛋白在不同生物体中的分布促使其具有不同的细胞定位和功能。根据LRR蛋白细胞定位的特点可以将其分为两类,一类为细胞内LRR蛋白,另一类为细胞外或跨膜LRR蛋白。细胞内的LRR蛋白,如人的flightlessUL37,果蝇flightlessLRR47,秀丽线虫sur-8,鼠rsp1,酵母腺苷酸环化酶等,这些细胞内LRR蛋白的共同特点是其序列具有高度相似性,可以与Ras-like GTP酶相互作用,调控Ras-like GTP酶的活性 [10] 。细胞外或跨膜的LRR蛋白的功能主要是作为细胞粘附分子或受体参与神经系统的生长、发育及重塑 [11] 。这类LRR蛋白的LRR重复序列的两端通常由富含半胱氨酸的N端和C端LRR包裹。这两端的LRR具有高度保守性。含有LRR的蛋白参与多个生物学过程,如信号转导,细胞粘附,细胞凋亡,细胞重塑,细胞周期的调控,细胞支架,酶的抑制,DNA修补,RNA的加工和转录等。
LRCH蛋白是一类新发现的在进化上相对保守的LRR蛋白亚家族,该蛋白含有LRR (leucine-rich repeats)重复结构和一个CH (calponin homology domain)结构域,具有细胞骨架蛋白的特性,LRR重复结构提供了一个蛋白与蛋白之间相互作用的结构骨架 [12],而CH结构域通常被看作是一个肌动蛋白结合结构 [13] 。尽管LRR重复结构和CH结构域在真核生物中是普遍存在的,但是这两个结构域的组合同时出现在一个蛋白中仅限于动物物种。LRCH蛋白首次在果蝇中发现,人类与果蝇的dLRCH表现出高度相关性的蛋白只有4种(hLRCH1-4),说明它们共有一个进化起源,根据它们保守的氨基酸序列表明它们是细胞骨架的支架因子 [14] 。
2. 材料与方法
2.1. 研究流程

2.2. 海胆的饲喂和组织获取
试验用2龄虾夷马粪海胆取自大连海洋大学农业部北方海水增养殖重点实验室,海胆饲养于16℃~25℃的海水中,每日投喂新鲜的海带。抽取体腔细胞前一日停止投喂。
选取8枚健康的海胆(雌、雄各4枚),分别用注射器抽取虾夷马粪海胆的体腔液,在4℃下离心10 min,转速为5000 r/min,离心后丢弃上清,收集沉淀的体腔细胞,接着解剖海胆个体,获得围口膜、肠、管足、卵巢和及精巢,并将这些组织放置于液氮中冻存,最后转移至-80℃冰箱中保存。
2.3. 海胆个体的免疫诱导
虾夷马粪海胆体腔细胞是主要的免疫组织,我们选取四种病原物(脂多糖(LPS)、肽聚糖(PGN)、葡聚糖(WGP)和聚肌胞苷酸(polyI:C))和一种致病菌(强壮弧菌(Vibrio fortis))对健康的海胆个体进行免疫刺激,来检测目标基因对免疫刺激的应答情况。强壮弧菌是虾夷马粪海胆的一种致病菌,属于革兰氏阴性菌,可以用来诱导虾夷马粪海胆的免疫反应 [15] 。脂多糖是革兰氏阴性菌细胞壁中的一种成分,也是细菌内毒素的主要成分,具有抗原性,是一种内源性免疫增强剂 [16] 。肽聚糖是细菌(主要是革兰氏阳性菌)等原核生物细胞壁内的一类大分子聚合物,在革兰氏阳性菌中肽聚糖含量高达30%~95%,在革兰氏阴性菌中也有5-20%的含量,是一种重要的水产动物免疫增强剂 [17] 。葡聚糖是存在于酵母细胞壁中一种具有增强免疫力活性的多糖,可刺激机体免疫反应 [16] 。聚肌胞苷酸是一种合成型的双链RNA类似物,一种病毒感染相关的分子模式,是用来模拟RNA病毒的免疫抑制剂。
采用直接体腔注射的方法对虾夷马粪海胆个体进行免疫刺激,同时体腔注射磷酸盐缓冲液(PBS)作为对照组。强壮弧菌使用半致死量注射50只海胆,防止由于死亡导致数量不足。其余4种病原物的注射量为LPS:2 mg/ml、PGN:200 µg/ml、WGP:600 µg/ml,每组注射20只,PBS注射20只。体腔细胞在注射后6 h、12 h、24 h、48 h、72 h五个时间点进行抽取,按前面的方法处理后保存于−80℃冰箱中备用。
2.4. RNA的制备及cDNA合成
按照RNAprep Pure Tissue Kit 总RNA提取试剂盒(天根生化科技(北京)有限公司)方法提取虾夷马粪海胆各组织总RNA,用凝胶电泳检测RNA的质量,核酸蛋白检测仪检测RNA浓度。为了减少个体差异及性别对试验结果的影响,各组织均使用4枚海胆的RNA等量混合后用于反转录,其中精巢、卵巢各使用4枚雄性或雌性海胆,其余组织均使用2枚雄性海胆和2枚雌性海胆。制备好的RNA样品保存于-80℃冰箱中备用。
使用cDNA第一链合成试剂盒(北京全式金生物技术有限公司)合成cDNA第一条链。反转录产物于−20℃冰箱保存用于实时定量PCR检测。按照SMARTer RACE cDNA Amplification Kit试剂盒(Clontech公司)说明进行反转录,合成cDNA第一条链,反转录产物于−20℃冰箱保存用于RACE克隆。
2.5. 引物设计
根据虾夷马粪海胆转录组数据 [3] 中筛选到的LRCH2-like基因部分片段设计引物,应用Primer 5.0软件分别设计扩增LRCH2-like 基因全长3’和5’的RACE引物和用于实时定量的引物,内参基因选取18S rRNA,内参基因的引物根据GenBank中虾夷马粪海胆的18S rRNA(D14365)序列设计。所有引物由上海生工生物有限公司合成(表1)。
2.6. LRCH2-like基因cDNA全长的克隆及回收测序
使用SMARTer RACE cDNA Amplification Kit试剂盒(Clontech公司)进行RACE克隆虾夷马粪海胆

Table 1. Primers used in this experiment
表1. 本实验使用的引物
LRCH2-like基因全长cDNA的克隆。以合成的cDNA第一链为模板,分别用LRCH2-5和LRCH2-3与试剂盒提供的UPM引物配对进行PCR扩增。使用降落PCR进行扩增:94℃预变性5 min;94℃ 30 sec,72℃ 3 min共5个循环;94℃ 30 sec,70℃ 30 sec,72℃ 3 min共5个循环;94℃ 30 sec,65℃ 30 sec,72℃ 3 min共25个循环;72℃ 10 min;4℃保存。取5 μL进行1%琼脂糖凝胶电泳检测。
按照EasyPure Quick Gel Extraction Kit胶回收试剂盒(北京全式金生物技术有限公司)方法对目的片段进行胶回收,使用全式金公司的p-easy-T1载体,进行TA克隆,使用M13通用引物进行菌液PCR扩增,鉴定重组子。取5 µl进行1%的琼脂糖凝胶电泳检测,确认包含重组子的克隆,将得到的阳性克隆菌株送至上海英俊有限公司进行测序,使用通用引物进行测序。
2.7. 利用生物信息学方法进行序列拼接及分析
将测序结果进行序列拼接,完成全长拼接后,首先使用NCBI的blastx (http://blast.ncbi.nlm.nih.gov/Blast.cgi)在线工具进行比对,确认为目的序列后,用NCBI上的CDD (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行保守结构域分析,寻找信号肽和跨膜结构域,使用clustalw与其他物种相似序列进行相似性比对,并根据比对结果用MEGA5.0软件构建进化树。
2.8. 使用实时定量PCR进行表达特征分析
采用实时荧光定量PCR法检测LRCH2-like基因在健康虾夷马粪海胆体腔细胞、围口膜、肠道、管足、卵巢和精巢中的表达情况,同时也检测它在免疫刺激之后的虾夷马粪海胆体腔细胞中的表达情况。
选取虾夷马粪海胆的18S rRNA为内参基因,在life technology的7500实时定量PCR仪上进行qRT-PCR,按照试剂盒SYBR Premix EX Taq Ⅱ Kit(takara公司)使用说明进行实时定量PCR扩增反应。PCR反应体系(20 µl):SYBR Realtime PCR Master Mix 10 μl,上下游引物 (10 μM) 各0.8μl, ROX Reference Dye (50×) 0.4 μl,cDNA模板 2 μl,RNase free H2O 6 μl。PCR反应条件:95℃ 30 sec预变性;95℃ 5 sec,60℃ 34 sec,40个循环;在检测引物特异性及制备标准曲线时需加上溶解曲线的过程:95℃ 15 sec,60℃ 1 min,95℃ 15 sec,60℃ 25 sec。每个样本重复检测三次。应用2–ΔΔCt 法检测LRCH2-like基因的表达情况。
3. 结果与分析
3.1. LRCH2-Like基因全长cDNA的克隆及序列分析
通过条件优化,虾夷马粪海胆LRCH2-like基因的RACE克隆获得了较好的结果,条带单一,符合预期片段大小,将选取的单克隆送去测序,测序结果去除载体后进行分析,获得LRCH2-like基因的3’RACE和5’RACE片段。将转录组筛选到LRCH2-like基因的部分片段,与3’RACE和5’RACE去除载体后得到的片段进行拼接,得到LRCH2-like基因的全长cDNA,利用NCBI网站的blastx工具进行比对分析,发现与该基因相似性最高的是紫海胆(Strongylocentrotus purpuratus)的LRCH2-like基因,该基因为LRR基因家族的一员,故命名为SiLRCH2-like。SiLRCH2-like基因全长cDNA为2446 bp,其中编码区为1644 bp,3’-UTR为609 bp,5’-UTR为193 bp。编码区编码547个氨基酸,预测的蛋白分子量为59.9 KDa,理论等电点为4.07,为酸性蛋白(图1)。保守结构域分析发现该基因的蛋白中含有1个Na-Ca-ex-superfamily结构域,该结构域的主要功能是调节细胞内Ca2+浓度,以及7个LRR重复,该结构域是NLR家族蛋白识别病原体的主要区域。通过序列比对发现,SiLRCH2-like基因的LRR结构域非常保守,存在多个LxLxLxxN/CxLx结构域重复,该结构域赋予了SiLRCH2-like蛋白辅助NLR家族蛋白识别病原体的功能,但是SiLRCH2-like的LRR结构域较短,可能与SiLRCH2-like基因识别的病原体种类有关。
3.2. 系统发育分析
利用MEGA5软件对来自紫海胆等13个物种的LRCH同源蛋白氨基酸序列进行了系统发育分析,以
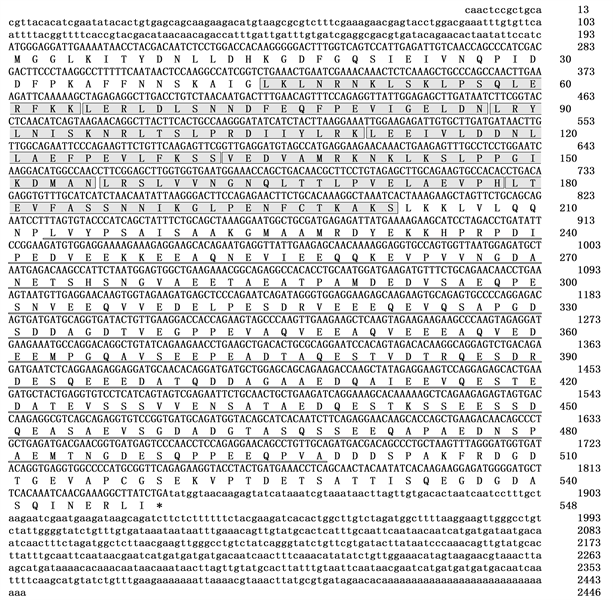
Figure 1. The cDNA sequences (above) of SiLRCH2-like gene with deduced amino acid sequences (below) (7 LRR domains are marked with shadow boxes, Na-Ca-ex-superfamily domain is marked with underlines, and the asterisk indicates the stop codon)
图1. SiLRCH2-like基因全长cDNA序列(上)及预测的氨基酸序列(下) (7个LRR结构域用阴影方框标识, Na-Ca-ex-superfamily结构域用下划线表示,星号表示终止密码)
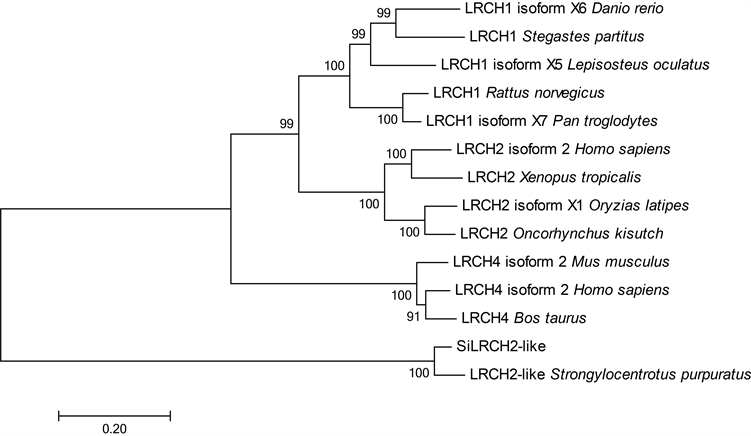
Figure 2. Phylogenetic analysis of LRCH homologous proteins (The scale represents the genetic distance, and numbers at branch nodes represented the confidence level of 1000 bootstrap replications)
图2. 基于氨基酸序列的LRCH同源蛋白系统进化树(标尺表示遗传距离,分支处数字代表自展置信值,重复1000次)
邻接法构建系统进化树,设定Bootstrap值为500。如图2所示,所有的脊椎动物的LRCH同源蛋白聚为一支,这些物种有斑马鱼(Danio rerio)、深裂眶锯雀鲷(Stegastes partitus)、斑点雀鳝(Lepisosteus oculatus)、大鼠(Rattus norvegicus)、黑猩猩(Pan troglodytes)、人(Homo sapiens)、小鼠(Mus musculus)、牛(Bos taurus),而虾夷马粪海胆SiLRCH2-like与紫海胆(S. purpuratus)的LRCH 2-like单独形成最外缘的一簇。结合物种的分类地位,可以推测,海胆的LRCH2-like基因很有可能和脊椎动物的LRCH同源蛋白源于共同祖先。
3.3. SiLRCH2-like基因在虾夷马粪海胆不同组织的表达情况
采用相对定量的方法对未经过处理的虾夷马粪海胆各个组织进行表达量的检测,使用18S rRNA作为内参基因,检测结果如图3所示,SiLRCH-2like基因mRNA在所有检测的组织中均进行转录,但是在不同的组织中表达量有差异。SiLRCH2-like基因在卵巢中表达量最高,其次是肠道、管足,体腔细胞和围口膜中表达量较少,在精巢中表达相对来说很低。
3.4. 免疫刺激后SiLRCH2-like基因的表达特征
本实验使用四种病原物LPS、PGN、PolyI:C、WGP以及病原菌强壮弧菌(V. fortis)对虾夷马粪海胆的体腔进行刺激后,检测SiLRCH2-like基因在实验选取的病原体刺激后的6 h,12 h,24 h,48 h,72 h的表达量变化(图4)。
经过LPS处理后(图4(a)),SiLRCH2-like基因在24 h出现了一个表达高峰,表达量增加了0.5倍,但未出现显著性差异变化,说明SiLRCH2-like基因对LPS刺激并无明显应答。经PGN处理后(图4(b)) SiLRCH2-like基因在12 h达到表达高峰,显著性上调,在24 h表达量趋近于0,随后又呈现上升趋势,SiLRCH2-like基因对PGN的刺激表现出强烈的应答。Poly I:C处理后(如图4(c)),SiLRCH2-like基因表达量变化不大,与0 h相比,其他5个时间表达量都在下降,在72 h表达量最低,说明Poly I:C抑制SiLRCH2-like基因的表达使其表达量下降,呈现下调趋势。WGP处理后(图4(d)),SiLRCH2-like基因表达量持续降低,在48 h表达量达到最低,呈现表达下调的趋势,说明WGP同样抑制SiLRCH2-like基因的表达使其表达下调。经过强壮弧菌处理后(图4(e)),SiLRCH2-like基因在12 h表达量达到最大,其余时间表达量都在下降,SiLRCH2-like基因表达量整体无明显变化,说明SiLRCH2-like基因对强壮弧菌的免疫应答不明显。由此可见,SiLRCH2-like基因对LPS和强壮弧菌的刺激并未产生明显表达反应,说明LPS和强壮弧菌对SiLRCH2-like基因有一定的免疫刺激,但并不剧烈;对PolyI:C和WGP的刺激出现表达下调,说明PolyI:C和WGP对SiLRCH2-like没有免疫刺激,甚至抑制SiLRCH2-like基因的表达;PGN通常是NLR受体识别的分子模式,SiLRCH2-like对PGN的刺激产生的表达反应最剧烈,由此可以推测SiLRCH2-like基因可能参与NLR信号通路的免疫反应。
4. 讨论
在使用RACE技术得到SiLRCH2-like基因的全长cDNA后,通过序列比对发现,SiLRCH2-like基因的LRR结构非常保守,属于LRR-RI超家族,该家族的LRR通常由20~29个氨基酸残基组成,存在于多种蛋白中,参与蛋白与蛋白之间的相互作用,有许多不同的功能和细胞定位。LRR重复对应的结构单位是由一个β片层和一个α螺旋组成,β片层是一保守的LxxLxLxxN/CxL序列 [18],这段序列包含12个片层与11个全重复相一致,与之前在该超家族观察到的范围一致,作为RanGTPase激活蛋白发挥作用,LRR也可作为富亮氨酸重复受体激酶发挥作用,还可作为LRR蛋白参与包括信号转导、细胞调亡、细胞重塑、固有免疫反应、细胞支架,激素受体的相互作用或者酶的抑制等多个生物学过程。由于LRR是NLR家族蛋白识别病原体的主要区域,因此可以表明SiLRCH2-like基因参与NLR信号通路的免疫反应,但是SiLRCH2-like基因的LRR重复域较短,可能与SiLRCH2-like基因识别的病原体种类有关。
从SiLRCH2-like基因在虾夷马粪海胆组织中的表达量结果中可以发现,SiLRCH2-like在卵巢中的表达量最高,而在精巢中表达量很低。这可能是因为有性繁殖动物具有性别二态性的特点,性别二态性的形成与不同基因的表达有关 [19] [20],雌性性腺作为海胆繁殖的重要器官,在进行取样时处于发育成熟期,而SiLRCH2-like基因在细胞生长发育、分化和凋亡等方面发挥重要作用,因此SiLRCH2-like基因在雌性性腺中的表达量最高,这也可能与保护卵子存在一定关系。
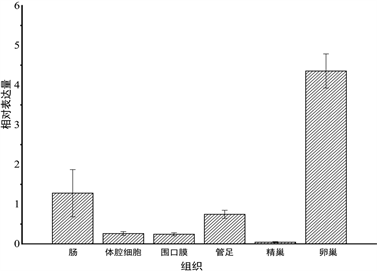
Figure 3. Expression profiles of SiLRCH2-like gene in various tissues from normal sea urchin. The longitudinal axis values represent relative expressions and the transverse axis is different tissues
图3. SiLRCH2-like基因在健康虾夷马粪海胆不同组织中的表达情况。纵轴数值表示相对表达量,横轴为不同组织
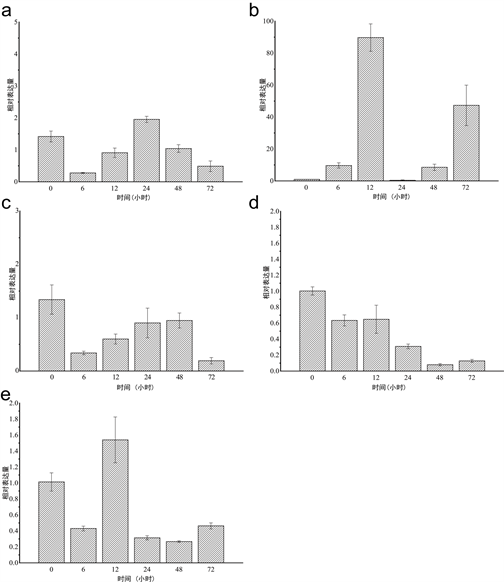
Figure 4. Expression profiles of SiLRCH2-like gene in sea urchin coelomocytes after immune stimulation: The expression of SiLRCH2-like was stimulated by LPS, PGN, Poly I:C, WGP and Vibrio fortis. The longitudinal axis values represent relative expressions, the transverse axis are different periods after immune stimulation
图4. 免疫刺激后SiLRCH2-like基因在体腔细胞中的表达特征(a)-(e):SiLRCH2-like分别在LPS、PGN、Poly I:C、WGP及强壮弧菌刺激下的表达情况。纵轴数值表示相对表达量,横轴为免疫刺激后不同时间点
图4中,我们可以发现PGN刺激的体腔细胞表达量显著上升,在12 h达到表达高峰,呈表达上调。PGN是细菌等原核生物细胞壁特有的成分,在天然免疫中,PGN是一种重要的病原体相关分子模式,是免疫系统的激活剂,宿主可以通过模式识别受体识别PGN结构,对入侵的细菌作出相应的免疫应答,通过不同的信号转导途径释放免疫调控物质,发挥免疫功能 [21] 。研究证明NOD蛋白可以识别细菌PGN,而NOD1作为胞质受体识别革兰氏阴性菌的PGN,NOD2作为胞浆受体识别革兰氏阳性菌的PGN [22] [23],由NOD2的LRR结构域介导PGN直接与NOD2相互作用 [24] 。SiLRCH2-like基因对PGN的刺激反应剧烈,而PGN是NLR信号通路中参与NOD2反应途径的反应物,说明SiLRCH2-like基因可能参与了NOD2介导的NLR信号通路。LPS作为一种内源性免疫增强剂,主要作用于巨噬细胞和嗜中性白细胞,对许多动物的免疫系统都有深远的影响,它能刺激许多真核生物包括鱼类等的非特异性免疫,提高机体的免疫力 [25],经过LPS处理的体腔细胞表达量在24 h达到高峰,在其余的时间并没有显著变化,上述实验结果表明,虽然LPS对SiLRCH2-like基因有一定的刺激,可以作为免疫刺激物激发SiLRCH2-like基因的表达,但对SiLRCH 2-like基因的刺激作用微弱,这可能与LPS内毒素的核心结构类脂A的高度保守有关 [26] 。WGP通常存在于真菌的细胞壁中,应用于水产动物的WGP大多为酵母葡聚糖,即β-葡聚糖。WGP可以选择性地作用于吞噬细胞、自然杀伤细胞和颗粒细胞的特异性受体并激活这些细胞,通过吞噬作用来吸收、破坏和清除侵入体内的病原微生物,同时还能产生细胞因子来增强鱼类对细菌病原体的抵抗力 [16] [27] 。WGP可以使SiLRCH2-like基因表达下调,表明SiLRCH-like基因对WGP没有免疫应答,也进一步暗示了SiLRCH2-like基因不参与真菌引发的免疫反应。Poly I:C作为一种模拟RNA病毒的免疫抑制剂刺激体腔细胞,抑制SiLRCH2-like基因的表达,可以推测SiLRCH2-like基因不参与RNA病毒引发的免疫反应。强壮弧菌是虾夷马粪海胆条件性致病菌,实验证明强壮弧菌对虾夷马粪海胆的半致死浓度是105 cfu/ml [15] [28],用半致死浓度刺激体腔细胞,其表达量在12 h达到最高,表达量整体差异不大,可以推测SiLRCH2-like基因不是直接参与强壮弧菌引发的免疫反应。
5. 结论
本实验获得了虾夷马粪海胆LRCH2-like基因的全长cDNA,并对其在不同组织以及不同病原刺激后的表达情况进行了分析,并推测虾夷马粪海胆的LRCH2-like基因是一个免疫相关基因,参与了NLR信号通路。本实验为后续有关SiLRCH2-like基因作用机制研究奠定了基础。
基金项目
国家自然科学基金“海胆天然免疫分子NLR家族的免疫应答机制研究”(31101923)辽宁省自然科学基金“海胆抗菌肽的基因克隆、表达特征分析及原核表达”(2015020761)。
NOTES
*通讯作者。