1. 引言
多组分反应(MCRs)作为一种有效的合成方法在有机合成中具有广泛的应用价值,利用多组分反应可以合成一系列化学结构复杂,生理活性显著的有机化合物 [1] 。此方法与传统意义的有机合成方法相比,其大多数多组分反应具有操作简便、高选择性、原子利用率高、减少分离纯化步骤、提高反应产率和环境友好等特点 [2] [3] 。因此,多组分反应合成方法现已成为有机合成领域中不可或缺的重要方法而受到越来越多科学家的关注。
离子液体具有非挥发性、热稳定高、低毒性及环境友好等诸多优点,在有机合成中具有广泛的应用。基于以上原因本文发展了一种高效的合成方法:在[Bmim]BF4催化条件下,以1-(4-羧基苯基)-3-异丙基吡唑-5-酮,芳香醛和和丙二腈为起始原料经三组分一锅法反应合成多取代吡喃并[2,3-c]吡唑类化合物。此类化合物具有各种潜在的生理活性,如抗炎 [4] [5] 、抗菌 [6] [7] 、酶抑制剂 [8] ,在医药和农药领域具有广泛的应用价值。
2. 实验部分
2.1. 仪器与试剂
产物的熔点用瑞士BUCHIB2540型熔点仪测定(温度计未校正);质谱用API 2000质谱仪测定;核磁共振用VARIAN INOVA 400型核磁共振仪测定(CDC13,DMSO-d6为溶剂,TMS为内标);红外光谱BRUKER-EQUINOX5红外光谱仪测定(KBr压片);元素分析用EA-1110元素分析仪测定。实验所用试剂均为分析纯,除特殊说明外未经处理直接使用。
2.2. 离子液体的合成
离子液体[Bmim]BF4的合成原理图1所示:1-丁基-3-甲基咪唑四氟硼酸盐的合成路线分为2步,即中间体[Bmim]Br的合成和阴离子交换制备[Bmim]BF4。
1) 将12 ml N-甲基咪唑加入圆底烧瓶中,再加入19.2 ml溴代正丁烷在70℃搅拌48 h。冷却,用乙酸乙酯洗涤3次得到固体,抽滤,放入真空干燥箱干燥8 h,制得中间体[Bmim]Br。
2) 称取中间体0.2 mol加入250 ml圆底烧瓶,按摩尔比1:1.2加入氟硼酸钠及100 ml二氯甲烷,45℃下搅拌48 h。冷却,抽滤,减压蒸馏,真空干燥8 h得到目标产物1-丁基-3-甲基咪唑四氟硼酸盐[Bmim]BF4。
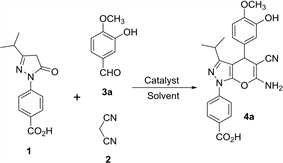
2.3. 吡喃并[2,3-c]吡唑类化合物4a-4f的合成及结构表征
化合物4a-4f的反应如图2所示。将1.0 mol 1-(4-羧基苯基)-3-异丙基吡唑-5-酮,1.0 mol芳香醛和1.0 mol

Figure 1. The synthesis of ionic liquid [Bmim]BF4
图1. 离子液体[Bmim]BF4的合成

Figure 2. Synthesis of pyrano[2,3-c]pyrazoles 4a-4f
图2. 合成吡喃并[2,3-c]吡唑类化合物4a-4f
丙二腈溶于5 mL EtOH中,加入[Bmim]BF4 (20 mol%),混合均匀后在75℃反应2 h。通过薄层色谱(TLC)追踪直至反应完全结束,放置过夜析出晶体,减压蒸馏旋出溶剂,得到粗产品,然后用DMF/EtOH重结晶得到目标化合物4a-4f。
4a: 1H NMR (400 MHz, CDCl3): δ 12.97 (s, 1 H), 8.87 (s, 1 H), 8.04.(d, 2 H), 7.96 (d, 2 H), 4.60 (s, 1 H), 2.51 (s, 1H), 1.05 (d, 3H), 0.87 (d, 3H) ppm; IR (thin film): 3545, 3445, 3232, 3205, 2194, 1692, 1664, 1603, 1511, 1484, 1385, 1262, 1082, 861, 802, 755 cm−1; HRMS (TOF MS ES+) m/z [M + H]+ calcd. for C24H22N4O5 447.1677, found 447.1673.
4b: 1H NMR (400 MHz, CDCl3): δ 12.97 (s, 1 H), 8.03 (d, 2 H), 7.97 (d, 2 H), 7.33 (d, 2 H), 7.22 (s, 2 H), 7.16 (d, 2 H), 4.77 (s, 1 H), 2.44 (s, 1 H), 1.04 (d, 3 H), 0.84 (d, 3 H) ppm; IR (thin film): 3433, 3445, 3325, 2184, 1719, 1661, 1607, 1526, 1395, 1236, 1091, 856, 815, 776 cm−1; HRMS (TOF MS ES+) m/z [M + H]+ calcd. for C23H19FN4O3 419.1577, found 419.1573.
4c: 1H NMR (400 MHz, CDCl3): δ 12.98 (s, 1 H), 8.05 (d, 2 H), 7.98 (d, 2 H), 7.41 (d, 2 H), 7.32 (d, 2 H), 2.45 (s, 1 H), 1.04 (d, 3 H), 0.87 (d, 3 H) ppm; IR (thin film): 3447, 3344, 3177, 2185, 1715, 1644, 1614, 1536, 1384, 1265, 1118, 815, 788 cm−1; HRMS (TOF MS ES+) m/z [M + H]+ calcd. for C23H19ClN4O3 435.1167, found 435.1165.
4d: 1H NMR (400 MHz, CDCl3): δ 12.99 (s, 1 H), 8.04 (d, 2 H), 7.98 (d, 2 H), 7.55 (d, 2 H), 7.26 (d, 2 H), 7.25 (s, 2 H) ppm; IR (thin film): 3474, 3294, 3175, 2188, 1707, 1655, 1607, 1527, 1484, 1394, 1205, 1086, 857, 804, 774 cm−1; HRMS (TOF MS ES+) m/z [M + H]+ calcd. for C23H19BrN4O3 479.0679, found 479.0677.
4e: 1H NMR (400 MHz, CDCl3): δ 12.96 (s, 1 H), 9.31 (s, 1 H), 8.04 (d, 2 H), 7.96 (d, 2 H), 7.15 (d, 2 H), 7.04 (d, 2 H), 6.70 (d, 2 H), 4.61 (s, 1 H), 2.51 (s, 1 H) 1.04 (d, 3 H), 0.85 (d, 3 H) ppm; IR (thin film): 3478, 3294, 3168, 2191, 1708, 1654, 1605, 1517, 1492, 1392, 1225, 1087, 857, 813, 792 cm−1; HRMS (TOF MS ES+) m/z [M + H]+ calcd. for C23H24N4O4 417.1576, found 417.1574.
4f: 1H NMR (400 MHz, CDCl3): δ 12.99 (s, 1 H), 9.31 (s, 1 H), 8.04 (d, 2 H), 7.98 (d, 2 H), 7.18 (s, 2 H), 7.13 (t, 1 H), 6.71 (d, 1 H), 6.65 (t, 2 H), 6.63 (t, 1 H), 2.51 (s, 1 H), 1.06 (d, 3 H), 0.89 (d, 3 H) ppm; IR (thin film): 3463, 3354, 3184, 2197, 1714, 1667, 1604, 1532, 1398, 1274, 1096, 814, 783 cm−1; HRMS (TOF MS ES+) m/z [M + H]+ calcd. for C23H20N4O 4 417.1577, found 417.1575.
3. 结果与讨论
3.1. 反应条件的筛选
以1-(4-羧基苯基)-3-异丙基吡唑-5-酮1 (1.0 mmol),丙二腈2 (1.0 mmol),4-甲氧基-3-羟基苯甲醛3a (1.0 mmol)为起始原料经一锅法三组分反应为模型,我们探讨了溶剂、催化剂类型、催化剂用量、反应时间以及反应温度对模型反应产率的影响(表1)。
首先筛选了不同的催化剂对模型反应的影响(表1,entries 1~3)。从表中可以看出,无催化剂条件下反应不能进行,离子液体[Bmim]BF4的催化活性要比HBF4高。其次,考察了EtOH、H2O、CH3CO2Et、CH2Cl2、CH3CN、MeOH、Toluene七不同溶剂对反应体系的影响(entries 3~9),结果表明在H2O溶液中此反应不发生,EtOH溶剂条件下反应产率最高。随后对反应时间和温度进行筛选(entries 10~12),当反应时间延长到5 h时目标产物的产率并没有增加,说明模型反应在2 h时已经完全反应,将温度调为80℃

Table 1. Optimization of reaction conditions
表1. 反应条件的优化
a分离产率,b反应不发生。

Table 2. Investigation of substrate scope
表2. 底物普适性研究

a分离产率。
和65℃时产物产率均有所下降。最后对催化剂的加载量进行考察(entries13),当催化剂的量为30 mol%时产物的产率并无增加。因此,此反应的最优反应条件为:EtOH溶剂中,离子液体[Bmim]BF4 (20 mol%)为催化剂,75℃条件下反应2 h。
3.2. 目标产物的普适性研究
根据上述建立的最优化反应条件(表1,entry 3),得到了较高产率的目标化合物4a-4f,我们对该反应的底物普适性进行了研究,结果如表2所示。从表中可以看出,芳香醛3a-3f的苯环上无论带有强吸电子基还是弱吸电子基在[Bmim]BF4催化作用下都能很好的参与反应,得到83%~88%较高产率的目标化合物。因此,离子液体[Bmim]BF4催化合成多取代吡喃并[2,3-c]吡唑类化合物具有很好的底物普适性。
4. 结论
本论文报道了一种有效简便的方法合成多取代吡喃并[2,3-c]吡唑类化合物,通过离子液体[Bmim]BF4催化以1-(4-羧基苯基)-3-异丙基吡唑-5-酮,芳香醛化合物和丙二腈为起始原料经三组分一锅法反应得到目标化合物。该方法具有操作简便、反应时间短和环境友好等特点。
基金项目
新疆教育部研究生科研创新项目基金(NO.XJGRI2014019)。