摘要:
目的:前部缺血性视神经病变(anterior ischemic optic neuropathy, AION)是严重损害中老年患者的常见视神经疾患,目前对其发病机理尚不十分清楚,疗效也不令人满意。因此,通过建立AION动物模型来探讨其发病机理就成为研究的关键。方法:比较光动力(photodynamic therapy, PDT)与经瞳孔温热治疗(transpupillary thermal therapy)造模的优劣。采用随机数字表将体重1.3~2.8 kg的12只家兔分为2组,A组为PDT模型组,B组为TTT模型组。2组均采用右眼造模,左眼作为空白对照组。PDT模型组从家兔耳缘静脉注射维替泊芬光敏剂,使用689 nm激光对视盘中上范围进行照射;TTT模型组采用810 nm红外激光进行照射。造模后第一天观察家兔眼底,1周后对A,B组模型眼与对照眼进行眼底彩色照相,无赤光眼底照相,荧光素眼底血管造影(fundus fluorescence angiography, FFA)检查,观察视盘的组织形态变化。结果:造模后第一天TTT模型组右眼视盘上半水肿,PDT模型组右眼视盘无变化,2组左眼视盘无变化。1周后眼底彩色照相显示2组模型右眼视盘上半色素淡白,无赤光照相显示右眼视盘上半色泽暗,FFA显示2组造影早期右眼视盘上半弱荧光,15 min后2组右眼视盘上半荧光素轻微渗漏,视盘荧光素染色。2组对照眼视盘FFA未见异常荧光表现。结论:经PDT,TTT建立的r AION模型,经眼底照相,FFA检查是成功的,为人类的AION研究提供了动物模型研究基础。
Abstract:
Anterior ischemic optic neuropathy (AION) is a common optic neuropathy severely affecting the visual function on middle and elder population. However, the pathogenesis of AION is not com-pletely clear and its treatment results are dissatisfactory. Therefore, the current research on AION is focused on establishing the suitable animal model and the pathogenesis of AION. Methods: Comparing the model of photodynamic with transpupillary thermal therapy, 12 rabbits of weight from 1.3 to 2.8 kg were divided into two groups at random. A group was PDT model and B was TTT model. All of the right eyes were the model eyes and the left ones were the control. After Photo-sensitizer, visudyne was injected from ear edge vein of rabbit. The rabbit middle-up area of optic disc was treated with wave length of 689 nm laser; TTT was treated with wave length of 810 nm laser on B model group. Using fundus photo, green photo and fundus fluorescence angiography (FFA) observed and recorded retinal vascular filling process and optic disc ischemic edema after induction one week. Results: TTT model revealed superior optic disc edema after induction and PDT model eyes and control eyes non-changed after induction one day. Both of two groups model optic disc became white on fundus photo, and the color was dark on green photo after induction one week. In early FFA, hypofluorescence appeared at the superior optic disc of both two model groups eyes. And in 15 min. later stage, the superior showed fluorescence leaking, revealed hyperfluorescence after one week induction. Conclusion: PDT and TTT methods are simple, reliable and successful by fundus photo, green photo and FFA. And they are helpful for the fundamental study of the human NAION.
1. 引言
前部缺血性视神经病变(anterior ischemic optic neuropathy, AION)是多种因素导致的视盘部分缺血损害的视神经病变 [1] [2] [3] 。除外因巨细胞动脉炎引起的动脉炎性AION,对于非动脉炎性(non-arteritis anterior ischemic optic neuropathy, NAION)的确切病因及发病机制尚没完全了解。因缺乏理想的,相对经济的动物模型阻止了对NAION病理过程与有效治疗的验证。目前国内外均采用血卟啉或孟加拉玫瑰红做光敏剂,采用532 nm绿光做动力光源的方法造模,血卟啉或孟加拉玫瑰红光敏剂属于模拟PDT [4] [5] ,532 nm激光曝光时间短,容易造成组织光凝固。故这两种方式的NAION模型与人类的NAION发病机制相差较远。因此我们尝试以维替泊芬做光敏剂的PDT造模,并与TTT造模比较,证实两者的可靠性。
2. 对象与方法
2.1. 材料
2.1.1. 实验动物
健康家兔12只,体重1.3~2.8 kg,雌雄不拘,购自广东省实验动物中心,饲养于深圳市眼科医院眼科研究所动物室。家兔自由饮水,进食,饲养环境为光/暗周期12/12 h,室温19~23度。试验动物的使用与管理遵循国家科学技术委员会颁布的“实验动物管理条例”
2.1.2. 主要设备与试剂
复方托品卡胺滴眼液(北京双鹤现代医药技术有限公司),10%荧光素钠注射液(广州白云山制药有限公司),10%水合氯醛(深圳市第二人民医院制剂室),维替泊芬光敏剂(visudyne,瑞士诺华制药)。实验仪器:super-scan半导体多波长眼底激光机(法国光太公司),德国海德堡激光共聚焦眼底血管造影系统(HRA II) (德国Heidelberg公司),50NT眼底彩色照相机(日本Topcon公司),PDT激光机(北京仪和仪美公司)。
2.2. 方法
2.2.1. 实验动物分组
采用随机数字表将体重1.3~2.8 kg的12只家兔分为2组,A组为PDT模型组,B组为TTT模型组。2组均采用右眼造模,左眼作为空白对照组。
2.2.2. 前部缺血性视神经病变动物模型的制备
实验家兔先用复方脱品卡胺散瞳,10%水合氯醛腹腔注射(0.35 ml/100 g体重) [4] 进行全身麻醉,用0.1%地卡因做家兔眼表面麻醉;PDT模型组根据VIP研究 [6] ,以家兔的体重,身长计算体表面积来计算维替泊芬光敏剂用量,平均维替泊芬光敏剂用量0.54 ± 0.12 ml,再用5%的葡萄糖注射液配成含光敏剂3 ml的混合注射液经家兔耳缘静脉注射并放置留置针管。注射完毕后将家兔放置固定于裂隙灯显微镜下,用黄斑视网膜激光镜,使用卡波母凝胶做为偶合剂,采用PDT激光或810 nm红外激光对家兔视盘照射。PDT激光参数:波长689 nm,光斑面积1/2上半视盘,照射时间83 s,激光能量50 mJ/m2,PDT激光照射后视盘色泽没有发生改变,激光术后避光48 h [6] 。TTT激光参数:激光波长810 nm,光斑面积1/2上半视盘,照射时间60 s,激光能量400 mw,以达到视盘色泽轻度灰白改变为激光能量标准。
2.2.3. 家兔眼底彩色照相
无赤光照相与FFA造模后一周再次10%水合氯醛灌胃麻醉,先拍摄眼底彩色照相,无赤光照相,再自家兔耳缘静脉注射10%荧光素钠0.3ml使用海德堡HRA II激光共聚焦眼底血管造影系统进行FFA。将家兔视网膜中央动脉荧光出现(12 s内)设为造影早期荧光相,5 min后为晚期荧光相,两者之间为中期荧光相。观察造影各期的视盘荧光变化。
2.3. 采用spss16.0统计学软件进行统计学分析
计量资料采用均数±标准差表示。PDT与TTT视盘缺血面积采用两组间独立样本t检验,p < 0.05为差异有统计学意义。
3. 结果
3.1. 家兔视盘的彩色眼底相与无赤光相表现
12只家兔中PDT模型组6只6眼,均为右眼,左眼为空白对照组;TTT组同为6只6眼,均为右眼,左眼做为空白对照组。实验中PDT组1只家兔麻醉意外死亡,余共11只进入结果分析。PDT组,TTT组和空白对照组在基线观察时间点眼底检查未见视盘异常改变。两组造模后1 d眼底检查可见视盘上半水肿,边界模糊,持续至第7天视盘水肿消退.PDT组家兔模型眼眼底彩色眼底照相显示视盘上半色淡,水肿,边缘毛细血管扩张,出血,视盘边界模糊(图1,图2)。TTT组2只模型眼视盘上半色淡,水肿,视盘边缘模糊,视盘边缘见片状出血,4只模型眼未见视盘边缘出血(图3,图4)。

Figure 1. Control left eye of PDT rabbit model showed optic disc light red color and the edge of optic cup clear (blue arrow)
图1. 家兔PDT模型左眼对照眼显示视盘色淡红,视杯边缘清晰(蓝色箭头所示)

Figure 2. Right eye of PDT rabbit model showed supper optic disc white color, edema and the edge of optic disc capillary dilated, hemorrhage (blue arrow)
图2. 家兔右眼PDT模型,视盘上半色淡,水肿,边缘毛细血管扩张,出血(蓝色箭头所示)
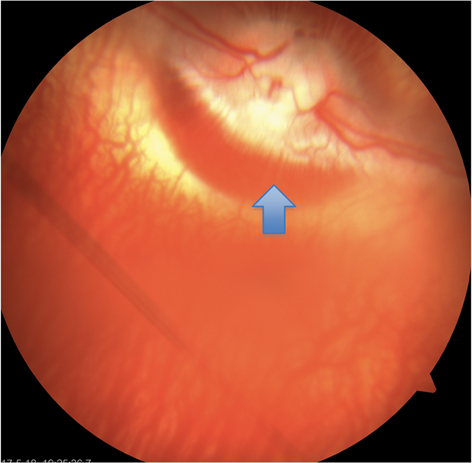
Figure 3. Control left eye of TTT rabbit model showed the edge of optic disc clear and the edge of optic cup capillary dilated (blue arrow)
图3. 家兔TTT模型左眼对照眼显示视盘边缘较清晰,视杯边缘毛细血管扩张(蓝色箭头所示)

Figure 4. Right eye of TTT rabbit model showed supper optic disc white color, edema and the edge blurred (blue arrow)
图4. 家兔右眼TTT模型,视盘上半色淡,水肿,视盘边界模糊(蓝色箭头所示)
3.2. 家兔视盘的FFA表现
FFA检查显示:两组空白对照组眼底均未见异常荧光改变。PDT模型组造模后7 d视盘上部始终表现为弱荧光,视盘边缘表面毛细血管扩张,晚期视盘荧光素渗漏,轻微荧光染色(图5)。视盘缺血面积0.050 ± 0.021 mm2;TTT模型组造模后7 d视盘上中部也始终表现为弱荧光,边缘视盘表面毛细血管扩张,2例2眼视盘弱荧光边缘见出血遮蔽荧光,视盘缺血面积0.091 ± 0.017 mm2,两组比较TTT模型组视盘缺血范围较PDT组大。(t = 2.28, p < 0.05) (图6)。
4. 讨论
NAION的临床发病机理尚缺乏统一的共识 [7] 。目前多数认为与小视盘造成的视盘神经纤维拥挤与供应视盘的睫状动脉分支发生梗阻有关。但目前缺乏NAION视盘及视网膜神经纤维缺血后所发生的病理变化的实验研究报告 [5] ,为明确NAION的发病机理并探寻更精准的治疗方法,进行NAION的动脉模型研究显得非常必要。近年来国内外眼科学者对AION的动物模型造模有几种选择方法:激光视盘局部光凝,激光的选择有532 nm的绿光,647 nm的红光 [4] [5] 。光动力造模,光敏剂选用血卟啉衍生物或孟加拉玫瑰红(Rose Bengal, RB)。实验动物选择大鼠或小鼠。啮齿类动物如大鼠与小鼠与人的生理机能相似,而且廉价,生命周期短,是进行青光眼等视神经疾病,糖尿病视网膜病变等视网膜血管病的理想动物模型 [6] 。但大鼠等啮齿类动物较小,鼠尾静脉不易注射,且鼠眼较小,进行眼底照相与FFA都相对困难。血卟啉衍生物在人体内代谢的半衰期是25~30 h,在大鼠体内的半衰期为5~7.0 h,脑组织的血药高峰为2~2.5 h [5] 。采用647 nm的红光结合血卟啉衍生物来做光动力造模要维持实验动物2 h以上全麻状态非常困难,而且追加麻醉出现麻醉过量的可能性较大。孟加拉玫瑰红是较为理想的实验动物造模光敏剂,
 (a)
(a)  (b)
(b)  (c)
(c)
Figure 5. Right eye of rabbit PDT model showed optic disc hypofluorescence at early stage of FFA, the edge capillary dilated, optic disc fluorescence leakage and stained at late stage
图5. 家兔右眼PDT模型:FFA造影早期视盘弱荧光,边缘毛细血管扩张,造影晚期视盘荧光素渗漏,轻度荧光染色
 (a)
(a)  (b)
(b)  (c)
(c)
Figure 6. Right eye of rabbit TTT model showed optic disc hypofluorescence at early stage of FFA, the edge capillary dilated, optic disc fluorescence leakage and stained, still showed capillary dilated at late stage
图6. 家兔右眼TTT模型:FFA造影早期视盘弱荧光,边缘毛细血管扩张,造影晚期视盘荧光素轻微渗漏,荧光染色,边缘仍可见毛细血管扩张
但532 nm的绿光属于短波长激光,造模时激光照射更多的是激光短时间曝光的光凝作用,而不仅是激光活化RB产生单线态氧与自由基。激光光凝可引起视盘神经纤维层的损害而与真实的AION由于睫状动脉阻塞引起的缺血病变机理相差较大。Visudyne是目前唯一的人眼用光敏剂,化学名称苯卟啉衍生物单环酸,90%与血浆中的脂蛋白结合,药物半衰期48小时,在人体内的血药浓度高峰15分钟后即可达到。最早由美国TAP (光动力治疗年龄相关性黄斑变性)研究用于治疗人年龄相关性黄斑变性中的经典型CNV以及高度近视,黄斑拟组织胞浆菌病继发的CNV [8] 。PDT治疗是通过689 nm激光照射,基态(非活化)的维替泊芬吸收光子而活化。在这一活化状态下,维替泊芬开始光化学反应,直接形成活性的游离基,或者间接将能量转移给基态氧而转化为高度活性的单体氧。从而引发细胞毒性作用。其中活性游离基通过介导细胞膜的脂质反应引起细胞结构和功能的损伤;活性单体氧通过直接影响细胞结构而引起细胞损伤。在这两种机制的共同作用下,启动凝血机制,促进血栓形成。visudyne具有极高的选择与精准性,即被照射组织出现光化学反应而理论上对其他未照射组织没有损害 [9] 。TTT采用波长810 nm的红外激光,40 s以上的较长曝光时间来缓慢组织加温的光凝治疗,临床上常用来治疗眼底肿瘤,黄斑区CNV疾病。由于TTT治疗是缓慢增加组织温度最终达到光凝的作用,比较532绿激光在0.1~0.3 s时间的光凝固效果,TTT可在光凝出现前停止激光照射,达到使组织出现缺血缺氧而又不产生因光凝作用造成的组织坏死。本研究中PDT与TTT造模比较。造模后第一天TTT模型组右眼视盘上半水肿,PDT模型组右眼视盘无变化,1周后眼底彩色照相显示2组模型右眼视盘上半色素淡白,无赤光照相显示右眼视盘上半色泽暗,FFA显示2组造影早期右眼视盘上半弱荧光,晚期视盘弱荧光区边缘荧光素渗漏轻微染色。表明PDT与TTT均能成功在家兔的视盘进行NAION的造模。而FFA结果显示TTT模型组视盘的缺血面积较PDT模型组大,我们考虑TTT仍属于热激光治疗,光凝固与热效应使缺血面积大于光斑面积。故从NAION造模精准性考虑PDT优于TTT。
5. 结论
综上所述,visudyne联合PDT与810 nm的红外激光经瞳孔温热治疗诱导家兔NAION造模稳定,可靠,尤其PDT方法在病理生理机制和发病过程上更类似于人的NAION。但本研究的样本数较少,且缺乏视觉诱发电位的研究,也缺乏与啮齿类动物的对比研究。尽管建立啮齿类动物NAION模型较为困难,但考虑到啮齿类动物是视神经疾病的理想模型 [6] ,故下一步我们的研究要进行啮齿类动物的PDT与TTT造模,为NAION的相关基础研究提供帮助。并且可在此模型基础上进行目前治疗NAION药物有效性的实验,进行NAION病理,免疫组化以及分子生物学的研究。
基金项目
深圳市科技创新委知识创新计划(JCYJ20150402152130699)。