1. 引言
草鱼(Ctenopharyngodon idella)属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)、雅罗鱼亚科(Leuciscinae)、草鱼属(Ctenopharyngodon),是我国养殖密度最大的淡水养殖品种 [1] ,2017年产量高达589.88万吨 [2] 。如今,草鱼种质资源衰退严重,疾病频发,其中草鱼出血病严重地制约着我国水产养殖业的发展,目前尚没有特别有效的方法针对该疾病 [3] 。
赤眼鳟(Squaliobarbus curriculus)属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)、雅罗鱼亚科(Leuciscinae)、赤眼鳟属(Spualiobarbus)。赤眼鳟不仅形态上与草鱼相似,研究还表明赤眼鳟对GCRV具有较强的抗性 [4] [5] [6] [7] ,是草鱼理想的杂交对象。
随着我国草鱼养殖规模的不断扩大,草鱼出血病给我国草鱼养殖业带来的经济损失也在不断加剧 [8] ,提高草鱼的抗病能力迫在眉睫。通过杂交的方式提高鱼类的抗性是鱼类品种改良的有效方式 [9] [10] 。
本实验以团队前期获得的普通草鱼(♀) × 赤眼鳟(♂) (正交F1)和赤眼鳟(♀) × 草鱼(♂) (反交F1)以及草鱼、赤眼鳟为材料,通过比较四种实验对象对细菌和病毒的抗性差异,以期为草鱼抗病新品种的选育、鱼病防治以及提高草鱼养殖生产效益等方面提供科学依据。
2. 材料和方法
2.1. 材料
试验鱼来自湖南农业大学水产基地,五月龄,正交F1 (15.80 ± 2.68 g)、反交F1 (15.92 ± 5.63 g)、草鱼F1 (33.82 ± 9.21 g)、赤眼鳟F1 (13.50 ± 5.06 g),每种鱼按50尾/组分好;嗜水气单胞菌、草鱼出血病病毒GCRV-104来自于湖南农业大学微生物实验室。
2.2. 人工感染实验
2.2.1. 病毒感染
a、实验鱼暂养
挑选健康的实验鱼暂养14 d,水温27℃ ± 2℃,持续充氧,及时清理粪便和残饵。
b、人工腹腔注射
用丁香油将4种实验鱼短暂麻醉,分别腹腔注射制备的病毒上清液,注射剂量按10 ul/g计算,注射后,养殖条件不变,移入养殖桶中暂养,以非注射处理鱼作对照。
c、浸泡感染
浸泡感染实验参照文献 [11] - [16] ,用曝气自来水稀释GCRV-104病毒悬液至105倍TCID50。
先用含6% NaCl的曝气自来水浸泡处理实验个体90 s,然后立即放入20 L含105 TCID50的病毒的曝气自来水中浸泡1 h,最后移入养殖桶中暂养。另取1组鱼作为对照组,浸泡后放入不含GCRV病毒的桶中暂养。
d、观察并记录数据
连续7 d记录每组鱼的表现症状和每天死亡数量。
2.2.2. 细菌感染
a、实验鱼暂养
养殖条件同病毒感染实验。
b、人工腹腔注射
将4种实验鱼短暂麻醉,人工腹腔注射0.2 mL浓度分别为:3 × 108 CFU/mL、3 × 107 CFU/mL和3 × 106 CFU/mL的菌液,每种浓度每种鱼处理1组,以非注射处理鱼作对照。
c、浸泡感染
用含6% NaCl的曝气自来水浸泡90 s,然后立即放入20 L含10 mL 3 × 108 CFU/mL、3 × 107 CFU/mL和3 × 106 CFU/mL3个菌液浓度的的曝气自来水中浸泡1 h,最后移入养殖桶中暂养。对照组浸泡6% NaCl的曝气自来水90 s后移入不含嗜水气单胞菌的桶中。
d、观察并记录数据
连续7 d记录每组鱼的表现症状和每天死亡数量。
3. 结果
在腹腔注射和浸泡感染环节中,通过观察实验鱼从发病至死亡阶段所表现的症状(图1~6),与草鱼出血病症状极为相似,主要症状表现为摄食下降、活力减弱,随后出现为呼吸加速,感染部位红肿,死亡体表充血,眼眶充血,眼球突出,肛门红肿,肌肉出血,鳔壁充血,与王铁辉 [16] 、杜雄伟 [17] 、孙峰 [18] 的结果一致,因此可认定为感染嗜水气单胞菌和GCRV导致草鱼出血病。
3.1. GCRV感染结果
经腹腔注射和浸泡感染GCRV-104后,实时观察各组鱼从发病至生命活动区域稳定共7天内的情况,在腹腔注射和浸泡感染实验中,结果表明杂交F1对GCRV的抵抗力明显强于普通草鱼和赤眼鳟(表1、图7、图8)。
在腹腔注射感染实验中,通过记录实验鱼每天的死亡数情况(表2、图9),草鱼每天均有死亡,第3天至第7天每天的死亡数量均超过7条,累计死亡数达到40,累计死亡率为80%;赤眼鳟第1天未出现死亡,从第2天持续至第7天每天出现死亡,第3天死亡数达到最高,随后死亡数逐天降低;正交F1只有第1、3、4、5天出现死亡,且死亡的实验鱼数量少,死亡数最多的一天为4条;反交F1第一天和第二天均出现1条死亡,第三天出现5条死亡,第四天出现死亡数达到最高,死亡数为6,统计结果表明,在腹腔GCRV感染实验中,草鱼累计死亡40条,赤眼鳟累计死亡25条,正交F1累计死亡10条,反交F1累计死亡15条,对照组中无死亡现象。
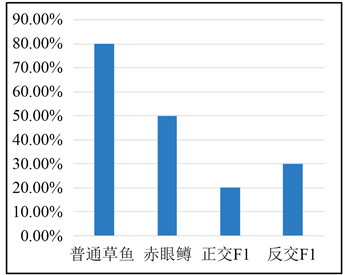
Figure 7. Cumulative mortality statistics by intraperitoneal injection of GCRV
图7. 腹腔注射GCRV累计死亡率统计
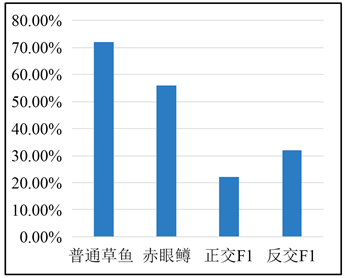
Figure 8. Cumulative mortality statistics by bath exposure of GCRV
图8. 腹腔注射GCRV累计死亡率统计

Table 1. The infection results among four species infected by GCRV
表1. GCRV感染结果统计

Table 2. The results daily death statistics among four species by intraperitoneal inject GCRV
表2. 腹腔注射GCRV每天死亡结果统计
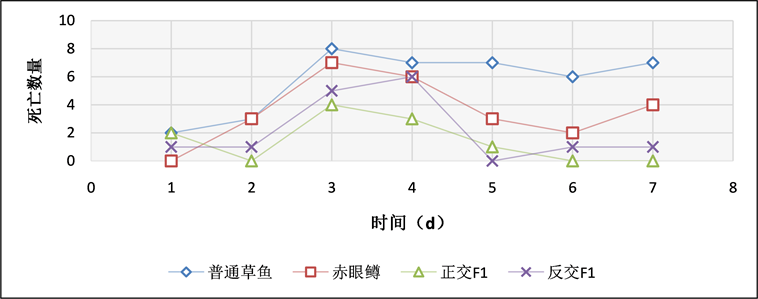
Figure 9. The results daily death statistics among four species intraperitoneal inject by GCRV
图9. 腹腔注射GCRV每天死亡结果统计
在浸泡染实验中,通过记录实验鱼每天的死亡数情况(表3、图10),攻毒后,草鱼和赤眼鳟从第1天开始每天均有死亡,第4天死亡数达到最高;草鱼、赤眼鳟分别死亡9条和10条;正交F1一共出现11条鱼死亡,发病时间主要集中在第3~4天,第3天死亡5条,第4天死亡4条,占死亡总数的81.82%;反交F1一共出现16条鱼死亡,发病时间同样主要集中在第3~4天,第3天死亡5条,第4天死亡8条,占死亡总数的81.25%。统计结果表明,在浸泡GCRV感染实验中,草鱼累计死亡36条,赤眼鳟累计死亡28条,正交F1累计死亡11条,反交F1累计死亡16条,对照组中无死亡现象。
以上结果初步说明杂交F1的抗GCRV的能力远远优于其父母本。

Table 3. The results daily death statistics among four species by bath exposure of bacteria
表3. 浸泡感染GCRV每天死亡结果统计
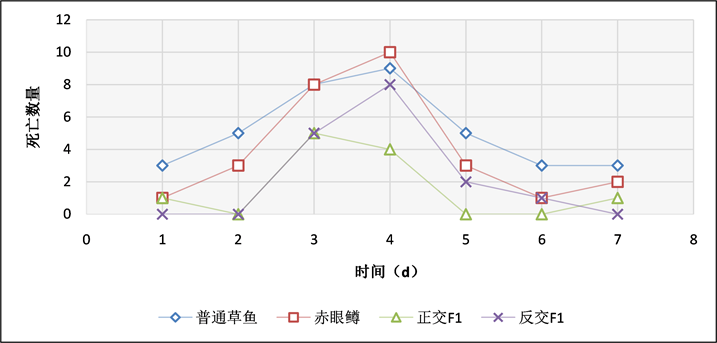
Figure 10. The results daily death statistics among four species by bath exposure of bacteria
图10. 浸泡感染GCRV每天死亡结果统计
3.2. 细菌感染结果
经腹腔注射和浸泡感染嗜水气单胞菌后,实时观察各组鱼从发病至生命活动区域稳定共7天内的情况。结果显示,在浸泡感染实验和腹腔注射感染实验中,杂交F1的累计死亡率均明显低于草鱼和赤眼鳟的累计死亡率,表明杂交F1对嗜水气单胞菌的抵抗力明显强于普通草鱼和赤眼鳟(表4、表5)。
在腹腔感染实验中,通过记录实验鱼每天的死亡数情况(表4、图11~13),当浓度为3 × 108 CFU/mL时,普通草鱼的死亡率为58%,赤眼鳟的死亡率为44%,正交F1代的死亡率为22%,反交F1代的死亡率为24%;当浓度为3 × 107 CFU/mL时,普通草鱼的死亡率为54%,赤眼鳟的死亡率为38%,正交F1代的死亡率为18%,反交F1代的死亡率为12%;当浓度为3 × 106 CFU/mL时,普通草鱼的死亡率为48%,赤眼鳟的死亡率为34%,正交F1代的死亡率为12%,反交F1代的死亡率为8%;各对照组中均无死亡。在腹腔感染实验中,整个攻毒实验共进行7天,共计死亡186条鱼,死亡高峰期均集中在第3天和第4天,共计死亡114条,占死亡总数的61.29%。
在浸泡感染实验中,通过记录实验鱼每天的死亡数情况(表5、图14~16),当浓度为3 × 108 CFU/mL时,普通草鱼的死亡率为54%,赤眼鳟的死亡率为38%,正交F1代的死亡率为20%,反交F1代的死亡率为32%;当浓度为3 × 107 CFU/mL时,普通草鱼的死亡率为50%,赤眼鳟的死亡率为36%,正交F1代的死亡率为8%,反交F1代的死亡率为30%;当浓度为3 × 106 CFU/mL时,普通草鱼的死亡率为42%,赤眼鳟的死亡率为28%,正交F1代的死亡率为10%,反交F1代的死亡率为25%,各对照组中均无死亡。在浸泡感染实验中,整个攻毒实验共进行7天,共计死亡184条鱼,死亡高峰期均集中在第3天和第4天,共计死亡126条,占死亡总数的68.48%。

Table 4. The results daily death statistics among four species by intraperitoneal inject Aeromonas hydrophila
表4. 腹腔注射嗜水气单胞菌每天死亡结果统计

Table 5. The results daily death statistics among four species by bath exposure of bacteria
表5. 浸泡水气单胞菌每天死亡数据统计
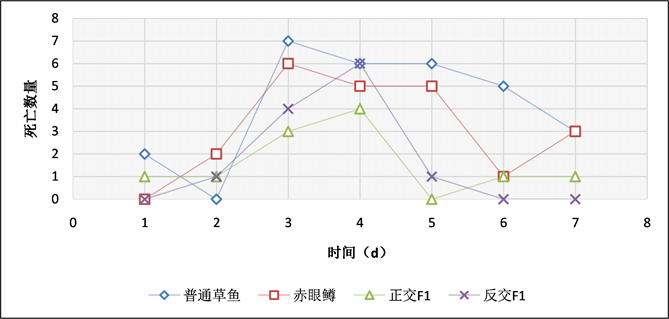
Figure 11. Intraperitoneal injection of bacteria at a concentration of 3 × 108 CFU/mL
图11. 3 × 108 CFU/mL浓度,腹腔注射细菌每天死亡结果统计
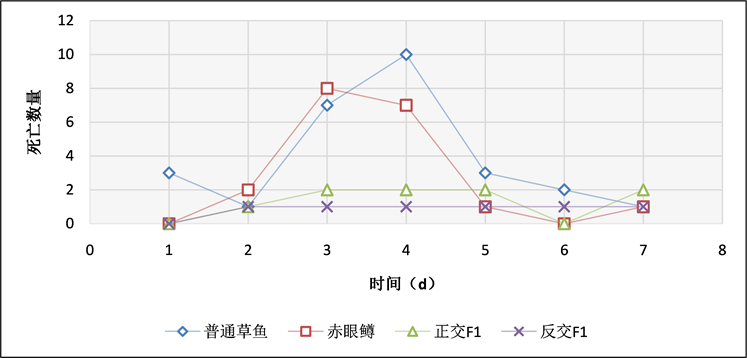
Figure 12. Intraperitoneal injection of bacteria at a concentration of 3 × 107 CFU/mL
图12. 3 × 107 CFU/mL浓度,腹腔注射细菌每天死亡结果统计
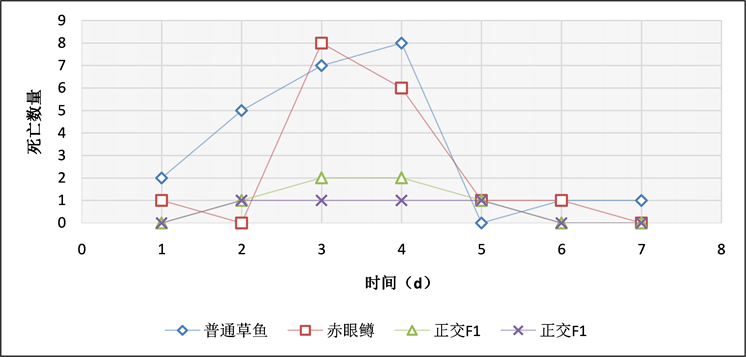
Figure 13. Intraperitoneal injection of bacteria at a concentration of 3 × 106 CFU/mL
图13. 3 × 106 CFU/mL浓度,腹腔注射细菌每天死亡结果统计
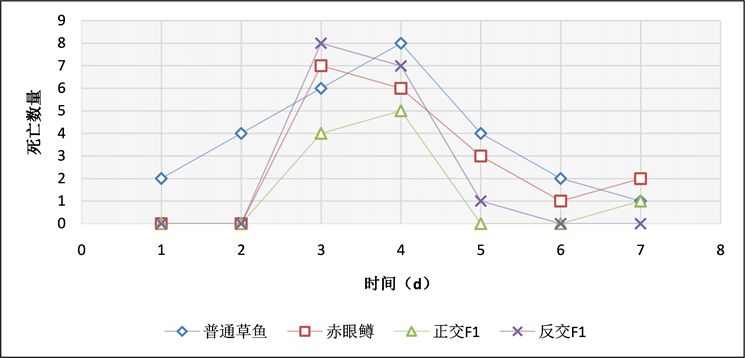
Figure 14. Bath exposure of bacteria at a concentration of 3 × 108 CFU/mL
图14. 3 × 108 CFU/mL浓度,浸泡感染细菌每天死亡结果统计
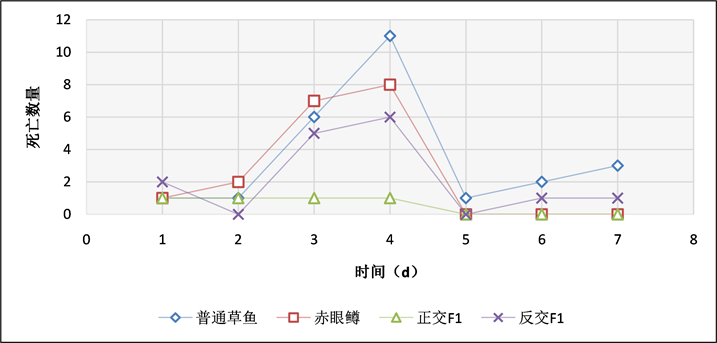
Figure 15. Bath exposure of bacteria at a concentration of 3 × 107 CFU/mL
图15. 3 × 107 CFU/mL浓度,浸泡感染细菌每天死亡结果统计
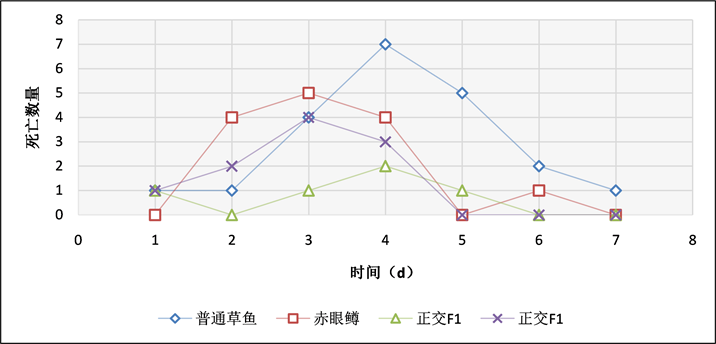
Figure 16. Bath exposure of bacteria at a concentration of 3 × 106 CFU/mL
图16. 3 × 106 CFU/mL浓度,浸泡感染细菌每天死亡结果统计
以上结果初步说明赤眼鳟的抗嗜水气单胞菌的能力优于草鱼,杂交F1代的抗嗜水气单胞菌的能力不但优于赤眼鳟,而且大大优于草鱼。
4. 讨论
草鱼是我国养殖密度最大的淡水养殖品种,草鱼种质资源衰退严重,疾病频发,其中草鱼出血病严重地制约着我国水产养殖业的发展,随着生物技术发展,利用杂交技术改良种质资源提高草鱼抗病力是从根本上解决草鱼出血病这一难题的治本途径 [9] [10] 。
通过杂交的方式提高鱼类的抗逆性是鱼类品种改良的有效方式。目前已经开展了大量的工作,青鱼(Mylopharyngodon piceus)与三角鲂(Megalobrama terminalis)的正、反交F1证实抗病力较强 [3] ,鲮鱼(Cirrhinus molitorella) (♀)与湘华鲮(Sinilabeo decorus tungting) (♂)杂交获得的F1和回交F2耐低温能力比父母本强 [19] 。
为了提高草鱼的抗病能力,同时也有相关研究开展了草鱼(♀)与团头鲂(♂)杂交 [20] [21] 、草鱼与赤眼鳟正、反交 [22] 、草鱼(♂)与兴国红鲤(Cyprinus Carpio singuonensis) (♀)杂交 [23] 等试验,金燮理 [24] [25] 等和金万昆 [26] [27] 研究发现以草鱼和赤眼鳟为母本远缘杂交获得的正交和反交F1在生长速度和抗病力等相对来说都有所提高。本研究通过对实验对象进行浸泡和腹腔注射感染嗜水气单胞菌和GCRV,统计7天内4种鱼死亡率表明,杂交F1代死亡率均显著低于父母本,这与金燮理等、金万昆等、胡尖廷等 [28] 、Liu [29] [30] 等的研究的结果相似,说明杂交F1对嗜水气单胞菌和GCRV具有较强的抵抗性,杂交F1继承了父本赤眼鳟抗病力强的优点。
5. 结论
本试验结果初步判断草鱼、赤眼鳟远缘杂交F1代新个体具有作为抗嗜水气单胞菌和GCRV病毒的新品种推广的潜力,同时为草鱼抗病育种提供了新思路。
基金项目
国家自然科学基金面上项目(31272652)。
NOTES
*通讯作者。