1. 引言
据流行病学的调查研究发现胃癌全球每年约有近百万胃癌新发病例,发病率在所有恶性肿瘤中居第4位,死亡率居第2位,每年死亡病例约70万 [1] [2] 。随着研究的深入近年来发现多个分子和信号通路与胃癌的病理生理变化密切相关,并研发了多种新型化疗药物和分子靶向药物,但晚期胃癌的5年生存率仍低于30% [3] 。上个世纪80年代,人们首先发现胃癌组织中有ER表达后,胃癌的发生与性激素之间的关系研究不断深入。近几年对卵泡刺激素及其受体在胃癌组织中的分布表达进行了研究观察 [4] ,但作为其上游激素促性腺激素释放激素受体(GnRHR)是否在胃癌组织中有分布以及分布情况如何目前未见报道。为此,我们对FSHR、ER-α在胃癌组织中的分布及其与GnRHR的共定位关系进行了试验分析研究。以探讨胃癌组织与性激素之间临床病理学的关系,为阐明胃癌发生发展的具体分子机制,寻找胃癌的早期诊断标志物和潜在的治疗靶点提供形态学依据。
2. 材料与方法
2.1. 材料
随机抽取2013年1月~2016年12月四年内我院胃肠外科经手术和病理证实的36例胃癌患者的病理组织石蜡包块标本,并报请医院伦理委员会审核批准,年龄46~76岁,平均43.5岁,男女不限。参考世界卫生组织(WHO)消化系统肿瘤(胃癌)分类,其中高分化14例,中分化9例,低分化13例。所有患者均为第1次手术,且术前未接受任何形式的放疗和化疗。另选36例肿块旁正常胃组织作对照,年龄在46~75岁。
2.2. 实验试剂及用品
1) 试剂:荧光试剂原料选用异硫氰酸荧光素(fluorescein isothiocyanate, FITC)与四甲基异硫氰酸罗丹明(tetramethyl rhodamine isothiocyanate, TRITC),FITC山羊抗小鼠及TRITC山羊抗兔均为北京鼎国公司提供。兔抗FSHR抗体为SANTA公司提供,羊抗GnRHR抗体为第四军医大学黄威权教授提供。BAS及APES购自博士德生物工程公司。
2) 器械:HD-E806电热恒温培养箱由海达仪器有限公司生产。HERRYTECH恒温水浴锅上海郝田公司生产,石蜡切片机SYD-S2010沈阳誉德电子仪器有限公司,奥林巴斯生物显微镜(BX53)、摄像装置(Moticam Pro 252)及成像软件系统(Motic Images PFSus 2.0)均为奥林巴斯斯公司产品。
2.3. 实验方法
(1) 切片制备
载玻片采用挂胶片,由有经验的技师进行完整切片,切片厚度均为5 um。
(2) 免疫荧光定位及双标步骤
所有实验标本均按以下程序处理:1) 烤片:70℃恒温培养箱烤片约3小时后原位放置2小时。2) 组织脱蜡和水化:二甲苯连续脱蜡(Ia, Ib, IIa, IIb)各10 min;无水乙醇、95%乙醇、75%乙醇梯度脱苯各6 min后分别用蒸馏水冲洗;3) 修复抗原:将配制好的乙二胺四乙酸(EDTA)修复液,在微波炉上加热至沸腾后将脱苯水化的组织切片放入高压锅中,上气开始记时2 min,关闭微波炉,冷却至室温;4) 血清封闭:取出切片蒸馏水冲洗后擦干,滴加3%过氧化氢,湿盒内常温下静置20 min,磷酸盐缓冲液(PBS)冲洗干净,封闭内源性过氧化物酶,;滴加正常羊血清,湿盒内37℃孵育20 min;5) 一抗孵育:等体积Survivin与Ki67工作液混合,甩去切片上清液,滴加混合一抗,湿盒内4℃孵育过夜;6) 二抗孵育:分别滴加TRITC标记二抗工作液(FSHR/ER-ɑ/GnRHR抗体):次晨8时将湿盒取出并恢复至室温,将TRITC标记山羊抗兔IgG以1:100比例稀释,滴加至切片上,湿盒内37℃孵育30 min;再滴加FITC标记二抗工作液(FSHR/ER-ɑ/GnRHR抗体):玻片由湿盒取出抛去水滴自然晾干20 min,将FITC标记山羊抗小鼠IgG分别以1:100/1:150/1:100比例稀释,分别滴加至标本上,再次湿盒内37℃孵育30 min后,PBS液连续冲洗3次,每次约3 min;7) 封片:自然晾干后用甘油配制的封片剂封片,4℃避光保存。
2.4. 激光共聚焦扫描显微摄像
利用激光扫描共聚焦显微镜分别观察免疫标记/双标记荧光染色结果并采集图片,具体选择参数参考如下:激光器电源:15 mW;扫描强度控制在:30%;阶段速度控制在2.0 mm/s;Iris:5.1;增益(Gain):1083;Blev:−1;Z step:0.2;FITC的激光激发波长范围在480~495 nm之间;TRITC的激光激发波长范围在543~575 nm之间;保持上述信号在最佳实验条件下使双标图像在同一平面上准确排列,每张切片选取3个有代表性的区域,分别采集到红色、绿色、红/绿色叠加(或黄色)荧光照片。癌旁组织切片均未发现荧光反应。
3. 结果
卵泡刺激素受体(FSHR)、雌激素受体α (ERα)及促性腺激素释放激素受体(GnRHR)在胃癌中的分布主要定位于胞浆中,细胞核均无荧光反应物质存在。FSHR免疫荧光阳性染色为绿色(见图1);一些癌组织同一细胞既呈FSHR阳性又呈GnRHR反应阳性呈黄色或红/绿色叠加(见图2);GnRHR免疫荧光阳性染色为红色(见图3);ER-α免疫荧光阳性染色为绿色(见图4);同一癌组织细胞既呈ER-α阳性又呈GnRHR反应阳性,呈黄色或红/绿色叠加(见图5);GnRHR免疫荧光阳性染色为红色(见图6)。
4. 讨论
大量实验研究业已证实,下丘脑的神经肽在哺乳类动物生殖功能调节中起关键性作用,通过活化其受体阳性细胞上的高亲和力受体,刺激垂体促性腺激素的释放。近年来的研究表明,GnRH及其受体(GnRHR)不仅存在于正常的垂体外组织,而且还存在于多种肿瘤组织中,迄今己在多种肿瘤组织和细胞中发现有GnRH及GnRHR的表达,从而说明GnRH在某些肿瘤细胞能够作为自分泌调节因子,调控肿瘤细胞的生长和分化。GnRH可调节多种细胞的功能,其机制可能是GnRHR数目的调节可使之与不同的
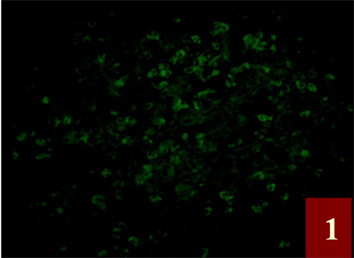
Figure 1. FSHR fluorescent markers for gastric Carcinoma, FSHR positive cells had a focal distribution, located in the cytoplasm and cell membrane of cancer cells, Positive material is green fluorescent (FITC) ×400
图1. 胃癌FSHR荧光标记,FSHR阳性细胞呈灶性分布,定位于癌组织细胞的胞质和胞膜,阳性物质呈绿色荧光(FITC) ×400

Figure 2. FSHR with GnRHR fluorescent markers for gastric Carcinoma, gastric carcinoma cells were both FSHR and GnRHR positive, are positioned on the part of the cytoplasm and cell membrane of cancer cells Positive material is yellow or red-green fluorescent (FITC) ×400
图2. 胃癌FSHR与GnRHR荧光标记,一些胃癌组织细胞既呈FSHR阳性又呈GnRHR阳性,均定位于部分癌组织细胞胞质和胞膜,阳性物质呈黄色或红/绿色叠加荧光(FITC) ×400

Figure 3. GnRHR fluorescent markers for gastric an Carcinoma, GnRHR cell had a focal distribution, located in the cytoplasm and cell membrane of cancer cells, Positive material is red fluorescent (FITC) ×400
图3. 胃癌GnRHR荧光标记,GnRHR阳性细胞呈灶性分布,定位于癌组织细胞的胞质和胞膜,阳性物质呈红色荧光(FITC) ×400
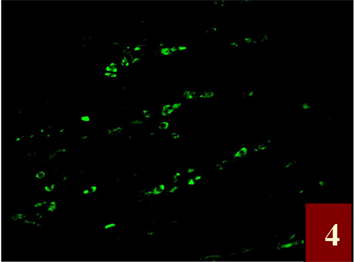
Figure 4. ERα fluorescent markers for gastric Carcinoma, ERα positive cells had a focal distribution, located in the cytoplasm and cell membrane of cancer cells, Positive material is green fluorescent (FITC) ×400
图4. 胃癌ERα荧光标记,ERα阳性细胞呈灶性分布,定位于癌组织细胞的胞质和胞膜,阳性物质呈绿色荧光(FITC) ×400

Figure 5. ERα with GnRHR fluorescent markers for gastric Carcinoma, gastric carcinoma cells were both ERα and GnRHR positive, are positioned on the part of the cytoplasm and cell membrane of cancer cells Positive material is yellow or red-green fluorescent (FITC) ×400
图5. 胃癌ERα与GnRHR荧光标记,一些胃癌组织细胞既呈ERα阳性又呈GnRHR阳性,均定位于部分癌组织细胞的胞质和胞膜,阳性物质呈黄色或红/绿色叠加荧光(FITC) ×400
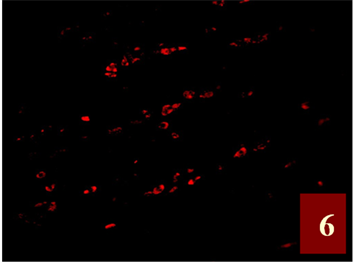
Figure 6. GnRHR fluorescent markers for gastric an Carcinoma, GnRHR cell had a focal distribution, located in the cytoplasm and cell membrane of cancer cells, Positive material is red fluorescent (FITC) ×400
图6. 胃癌GnRHR荧光标记,GnRHR阳性细胞呈灶性分布,定位于癌组织细胞的胞质和胞膜,阳性物质呈红色荧光(FITC) ×400
G蛋白耦联,从而诱发多种信号转导途径继而产生多种生理功能。GnRHR的转录水平和其数量的多寡受多种内源性因素,包括GnRH自身、类固醇性激素、激活素和抑制素的影响。雌激素受体(ER)属于核受体家族成员,通过与雌激素结合发挥效应。目前大量实验研究均已证明ER及雌激素受体基因多态性与前列腺癌 [5] 、肺癌 [6] 、乳腺癌 [7] 、原发性肝癌 [8] 等多种疾病相关。复习相关文献发现胃癌中雌激素受体的表达阳性尚无明确的判断标准,而细胞膜及细胞质染色在多数研究中判断为阳性。雌激素在胃癌组织中可直接降低细胞活性和诱导细胞凋亡 [9] [10] [11] ,在体外胃癌细胞培养中发现雌二醇可抑制上皮细胞的转移 [9] [11] ,我们实验过程中观察到的上述受体的分布和共存性亦为上述结论提供有力的形态学佐证。
近年的实验研究和临床观察均提示,胃癌的发生与性激素有一定的关系,胃癌可能是一种性激素依赖性靶器官。为此我们采用免疫荧光化学双标记技术,观察FSHR、ER-α在胃癌组织中的分布及其与GnRHR的共定位关系,以明确胃癌组织细胞是否存在上述受体以及GnRHR与前二者之间的关系。本实验采用免疫荧光化学双标记定位方法首次发现胃癌组织GnRHR免疫反应阳性的细胞同样呈FSHR/ER-α免疫反应阳性。但是有少量细胞GnRHR免疫荧光反应阳性的呈FSHR/ER-α免疫反应阴性。此我们可以推测,由胃癌组织细胞产生的GnRH也可能通过自分泌和旁分泌途径调节FSH和LH的分泌,进而调控癌组织细胞的生理功能。这个问题还有待进一步研究证实。在实验结果中出现的GnRHR免疫反应阳性的细胞中只有部分细胞呈FSHR/ER-α免疫荧光反应阳性,以上现象有以下2种可能,其一可能是由于第一抗体敏感性不同,其二可能胃癌组织本身存在FSHR/ER-α和GnRHR表达部位上的差异,以及癌组织病理类型有关。
本文研究结果提示胃癌组织中有FSHR、ER-α的分布并且二者与GnRHR有共存性。但促性腺激素释放激素及其与卵泡刺激素、雌激素在胃癌发生过程中的作用机制及内分泌治疗在临床的应用需进一步探讨。上述激素可能与年龄、性别等因素共同促进胃癌的发生发展。且对于胃癌组织中卵泡刺激素受体、雌激素受体α表达阳性的患者其内分泌个体化治疗可能是胃癌治疗的新途径。
基金项目
山东省卫生科技发展计划资助项目(资助号2017WSA14036)。