1. 引言
膀胱过度活动症(Overactive Bladder, OAB)是一种以尿急症状为特征的症候群,常伴有尿频和夜尿症状,可伴或不伴有急迫性尿失禁;尿动力学上可表现为逼尿肌过度活动(Detrusor instability, DI or Detrusor overactivity, DO),也可为其它形式的尿道–膀胱功能障碍。OAB无明确的病因,不包括由急性尿路感染或其它形式的膀胱、尿道局部病变所致的症状。目前该病是一个经验诊治尚缺乏相关实验室检查指标的疾病。最新的流行病调查显示全世界患有OAB的患者中女性占16.9% [1]。虽然关于OAB的基础与临床研究报道很多,但仍不能完满解释该病的发病机制。目前大多数学者认为该病的发生与神经递质的释放和炎性因子介入有直接关系。
NGF是具有神经元营养和促突起生长双重生物学功能的一种神经细胞生长调节因子,它对中枢及周围神经元的发育、分化、生长、再生和功能特性的表达均具有重要的调控作用。有研究表明 [2][3]OAB患者的尿频、尿急症状可能与NGF在膀胱组织中的高表达有关。也有报道 [4]指出PGE2在调节患者下尿路症状中发挥重要作用。前列腺素分布在膀胱组织的粘膜层和肌层,其释放是通过逼尿肌的拉伸、神经刺激、粘膜层的炎症反应等。前列腺素与能够降低膀胱收缩阈值并通过对辣椒辣素敏感的传入神经共同来控制膀胱的排尿反射。考虑到NGF与PGE2在OAB患者储尿期膀胱症状的相关性,我们通过检测女性OAB患者的尿液中NGF与PGE2的变化,有助于OAB的诊断及疗效评估。
2. 材料与方法
2.1. 研究对象
病例组选自2010年9月11日到2012年9月21日我院泌尿外科就诊的女性OAB患者共65例(年龄分布范围21~78岁,平均年龄55.5岁)。主诉为尿急、尿频伴有或不伴有尿失禁。所有患者均记录排尿日记,每日的排尿次数均在8次以上。上述患者均通过询问病史、体格检查及CT、静脉肾盂造影(Intravenous Urography, IVU)、膀胱镜检查、实验室检查(尿常规、中段尿培养)排除神经系统疾患、先天畸形和泌尿系感染等。另选20位健康女性志愿者(年龄分布范围28~65岁,平均年龄47.3岁)作为对照组。
2.2. 尿液样本的采集和准备
收集各组人员晨起中段尿100 ml。所有尿液样本被5000 × rpm离心10 min。分离出上清液,等分装入Ep管,每管1.5 ml,冷藏在−20℃冰箱中备用。
2.3. 酶联免疫吸附试验检测尿液中NGF和PGE2水平
2.3.1. 酶标NGF抗体
1) 过碘酸盐氧化法标记:将1 mg辣根过氧化物酶(HRP)溶解于0.1 ml双蒸水,加0.1 ml NaIO4 (0.06 mol/L)置4℃温箱氧化30 min,多次混匀,再加0.1 ml乙二醇(0.16 mol/L)放置室温30 min,终止氧化。然后加入纯化的兔抗人NGF多克隆抗体(DADE-BEHRING 公司) 1 mg,充分混匀,装透析袋,在 pH 9.7,0.05 mol/L碳酸缓冲液10,000 ml搅拌透析过夜,使酶与抗体结合;2) 纯化:每管加0.05~0.1 ml NaBH4 (5 mg/ml)置4℃温箱温育2 h,加等量(NH4)2SO4饱和调pH至7.8,逐滴加,置4℃温箱温育30 min,3500 × rpm离心30 min,弃上清液,沉淀物溶于少量0.02 mol/L磷酸盐缓冲液(pH7.4),4℃温箱透析过夜,离心去除不溶物即得到酶标NGF抗体。
2.3.2. 两组尿液标本中NGF 检测
在聚苯乙烯微量板内加入100 μL包被液(pH9.6 Na2CO3-NaHCO3缓冲液)稀释的酶标NGF抗体放4℃温箱过夜,洗板5次后拍干;加入100 μL封闭液(pH7.2,含1 % BSAB的PBS缓冲液)在4℃温箱过夜,洗板5次后拍干,可存放于4℃温箱保存备用。将封闭后的微量板内加入100 μL经稀释后(用Tris-HCL缓冲液稀释)的标准品(美国,Biological公司)及标本,37℃温育60 min,洗板5次后拍干;加入1:18,000 稀释(pH7.2,PBS缓冲液)的酶标抗体100 μL 37℃温育45 min,洗板5次后拍干;然后加入显色剂A液及B液(TMB底物显色剂)各50 μL在37℃温育10 min;最后加入终止液(0.2 mol/L, H2SO4) 50 μL。用Denley Dragon酶标仪(芬兰,Model MK-2)测定样本吸光度值(450 nm),以标准品浓度与吸光度值关系曲线换算标本中NGF水平。
2.3.3. 两组尿液标本中PGE2检测
应用高灵敏度PGE2试剂盒(美国,R & D公司)按说明书要求严格操作(标本用标本稀释液1:1稀释,取出反应板,加入稀释后的标准液50 μL标准品,加入待测样品50 μL于相应孔中,立即加入50 μL的生物素标记的抗体,盖上膜板,轻轻震荡混匀,37℃温育1 h。将浓缩洗涤液用蒸馏水50倍稀释后备用。甩去孔内液体,每孔加满洗涤液,震荡30 s,甩去洗涤液,用吸水纸拍干。重复此操作3次。每孔加入80 μL的亲和辣根过氧化物酶,轻轻震荡混匀,37℃温育30 min。甩去孔内液体,每孔加满洗涤液,震荡30 s,甩去洗涤液,用吸水纸拍干。重复此操作 3 次。每孔加入底物A液、B液各50 μL,轻轻震荡混匀,37℃温育10 min。避免光照。取出酶标板,迅速加入50 μL终止液,加入终止液后立即测定结果。在450 nm处测定各孔的吸光度值)。用Denley Dragon酶标仪(芬兰,Model MK-2)测定样本吸光度值,以标准品浓度与吸光度值关系曲线换算标本中PGE2水平。
2.4. 尿流动力学检测
所有病例组患者均给予连续记录3天排尿日记,并行尿流动力学检查(包括最大尿流率测定、残余尿测定、初始尿意膀胱容量、最大膀胱容量及充盈期膀胱压力-容积测定)。DO被诊断为在膀胱充盈期,非排尿意识下出现的逼尿肌收缩所致膀胱测压图上出现压力波动,其幅度超过15 cm H2O。
3. 统计学分析
所有数据采用SPSS 12.0软件进行统计学处理,所有数据用均数 ± 标准差( )表示。两组间比较采用t检验,p < 0.05认为差异有显著性意义。皮尔森积矩相关系数用来评价NGF和PGE2与尿流动力学参数的相关性,p < 0.05认为有统计学意义。
)表示。两组间比较采用t检验,p < 0.05认为差异有显著性意义。皮尔森积矩相关系数用来评价NGF和PGE2与尿流动力学参数的相关性,p < 0.05认为有统计学意义。
4. 结果
4.1. 尿流动力学检测结果
病例组中存在尿急伴有急迫性尿失禁的患者有21例(32%)。病例组患者在初始尿意膀胱容量和膀胱最大容积分别为129.2 ± 78.4和291.1 ± 114.3 ml。存在DO的患者有23例(35%)。
4.2. 尿液中NGF和PGE2的检测结果
病例组中NGF、PGE2的水平较对照组明显升高(p < 0.05) (如表1)。病例组中PGE2的水平与初始尿意膀胱容量和膀胱最大容积均呈正相关(p < 0.05) (如图1、图2),但与最大尿流率、残余尿量及逼尿肌过度活动无关。病例组中NGF的水平与尿流动力学参数无相关性。

Table 1. Urinary NGF and PGE2in controls and female patients with OAB
表1. 尿液中NGF与PGE2的水平
注:* p< 0.05。

Figure 1. Urinary PGE2 positively correlated with volume at first desire to void in women with OAB
图1. 初始尿意膀胱容量与尿液中PGE2的相关性
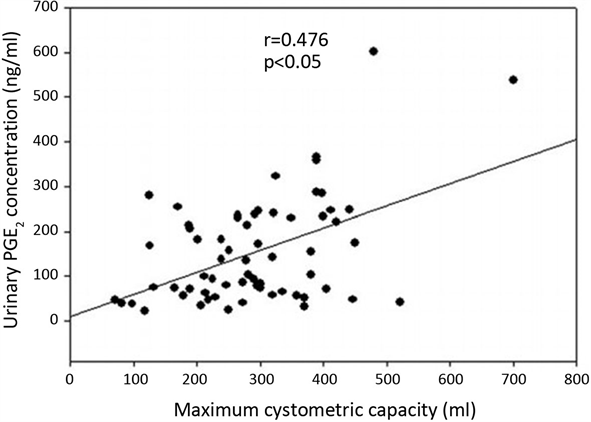
Figure 2. Urinary PGE2 positively correlated with maximum cysto-metric capacity in women with OAB
图2. 膀胱最大容积与尿液中PGE2的相关性
5. 讨论
实验结果显示尿中的NGF和PGE2的水平与OAB症状相关。虽然,OAB的发病机制还不是很清楚,但是可以肯定的是OAB症状与神经传导机制的改变、NGF和PGE2的表达有密切关系。
本实验提示女性OAB患者尿液中NGF的表达显著提高。NGF调节神经细胞的生长和增殖并且能使痛觉神经元敏感性增强 [5]。先前的研究结果提示NGF能够使膀胱收缩功能亢进,膀胱组织中NGF的表达升高能够使传入和传出神经元发生生理及形态学上的改变 [2][6][7][8]。另外,伴有尿急症状的腺性膀胱炎患者膀胱组织中NGF蛋白的表达升高,特别是那些伴有尿急症状患者的尿道上皮中NGF的表达升高。上述研究表明NGF在伴有OAB症状患者的膀胱中有表达。有关动物实验研究表明在膀胱出口部分梗阻的大鼠尿液中NGF发生改变 [9]。另外,在间质性膀胱炎和膀胱癌患者尿中NGF、纤维蛋白溶解酶、神经营养因子-3水平升高 [10]。因此,NGF可能诱发传入神经的兴奋导致储尿期膀胱症状。另外,尿液中NGF升高提示膀胱的功能异常,说明通过尿液中检测NGF可以用来诊断膀胱功能异常。
有研究提示OAB患者尿液中PGE2显著升高。PGE2可能引发膀胱活动通过逼尿肌收缩和/或神经传导 [11]。后者很可能是通过辣椒辣素敏感的传入神经元,因为可以通过应用辣椒辣素受体拮抗剂阻止这一过程的发生 [12]。因此,OAB患者尿液中PGE2的水平明显升高。另外,DO患者尿液中PGE2水平升高很可能是因为PGE2通过膀胱自身的分泌进入尿液中去的。有报道称在家兔的膀胱粘膜中PGE2的表达较PGI2明显增高,提示PGE2存在于粘膜层很容易进入尿液,而且尿液中的PGE2的水平较肌层明显增高。这与本实验中病例组患者尿液中PGE2的水平明显升高相符 [13]。另外,有研究显示PGE2能够诱发逼尿肌收缩超过其他前列腺素类物质 [14]。因此提示尿液中PGE2与OAB症状密切相关。
本研究提示尿液中PGE2水平与初始尿意膀胱容量和膀胱最大容积呈正相关,提示膀胱容积与PGE2改变有密切关系。提示PGE2的升高很可能是因为膀胱逼尿肌的拉伸所致,并且其在粘膜层的表达较肌层明显升高。所以尿液中PGE2的升高提示膀胱容积的改变。并且PGE2在下尿路功能中发挥重要作用。
本研究表明在女性OAB患者尿液中NGF、PGE2的水平明显升高,并且尿液中PGE2的水平与尿流动力学参数有相关性,提示NGF、PGE2在OAB的发生发展过程中发挥重要作用。通过检测尿液中NGF和PGE2水平对评估女性OAB有重要意义。