1. 引言
由于现代工业的发展,导致的大量含有重金属的污染物进入水环境中,不但造成重大的经济损失, 而且对生态系统和人类产生重大影响 [1] 。在重金属污染中,汞离子的水体污染比较突出,当今,水是一种重要而稀有的资源,所以如何解决受汞离子污染的地表水与地下水是我们的当务之急 [2] 。
地沟油是餐饮废渣废水中排出的废弃油脂保留下来,经多次反复加热将其回收提炼,我国每年产生至少300~500万吨,由于回收提炼地沟油时的卫生环境差,加工的工艺简单,导致重金属、黄曲霉素、硝酸盐、细菌总数、丙烯醛等指标严重超标 [3] 。不法商贩将地沟油勾兑对成食用油出售或用于制作油炸食品和酱料,一旦人体摄入会使细胞功能衰竭,诱发多种疾病,甚至致癌,对社会和食品安全造成危害,社会舆论反响极大 [4] 。因此实现地沟油的处理和利用,达到减少环境污染,是目前科研工作亟待解决的科研课题。
硫磺是硫化氢净化过程中形成的石油炼制工业的主要副产品之一。硫磺在化学品生产和橡胶硫化中的现有使用量少于其年产量的重量5%~10%。因此,近来,未使用的硫作为危险的不可压缩废物实体的堆积的担忧日益增加 [5] 。与常规硫化相反,反向硫化使用大量的硫,并与少量不饱和有机单体(如油胺,1,4-二苯基丁二炔,二异丙烯基苯或柠檬烯)反应 [6] [7],因此,硫可以用作合成功能材料的替代原料。最近的报道表明,硫共聚物对汞具有很高的亲和力,所以作为去除汞的材料具有很好的性能 [8] 。
膨润土是一种层状粘土矿物,主要成分是蒙脱石,由于具有较大的比表面积和较强的吸附重金属能力,被用作吸附剂用来处理各种污染,并在土壤的改良、污染废水等方面取得不错的效果 [9] [10] [11] 。
地沟油的主要化学成分是高级脂肪酸甘油脂,其中含有大量的不饱和脂肪酸 [12],本文通过反硫化法,在185℃下单质硫开环,生成线性多硫烷二自由基链 [13],然后双自由基与地沟油中不饱和脂肪酸发生聚合,掺杂膨润土,获得膨润土/硫化地沟油复合物,研究了吸附剂对汞离子的吸附,并取得较好的效果。同时,该吸附剂具有很好的再生能力,而且制备所需原料来源丰富,制备工艺简单,成本低廉,使用方便,适合处理工业废水的汞离子的吸附。
2. 实验部分
2.1. 实验原料
2.1.1. 实验药品及仪器
实验药品与仪器见表1与表2。

Table 1. Experimental chemicals and reagents
表1. 实验试剂及所需药品
2.2. 吸附剂的制备
取6 g硫磺,加入到100 mL圆底烧瓶,油浴加热到185℃,形成橙色溶液,然后,向圆底烧瓶滴加4 g地沟油,机械搅拌5 min,接着加入2 g膨润土,再继续加热搅拌2 h,冷却1 h,产物从烧瓶中取出,研磨粉碎,密封保存产品。
2.3. 吸附剂对Hg(II)吸附性能研究
通过使用膨润土/硫化地沟油聚合物(BSO)作为吸附剂进行分批吸附实验,进行了一系列初步实验,研究了最佳吸附剂用量,Hg(II)溶液的pH值,初始Hg(II)浓度和吸附时间对吸附效果的影响。
配制30~80 mg/L的Hg(NO3)2标准储备溶液,取50 ml倒入体积为100 mL的烧杯中,加入一定量的吸附剂,分别用0.8 mol/L硝酸溶液和0.8 mol/L的NaOH溶液将溶液的pH调节至1至6,在25℃下磁力搅拌,吸附时间为5~120 min。通过使用双硫腙分光光度法测定吸附后溶液中汞离子的浓度。吸光度最大为493 nm,根据下式计算BSO对Hg(II)的吸附量和吸附率。
(1)
(2)
其中C0 (mg/L)和Ce (mg/L)分别是Hg(II)的初始和平衡浓度,V (L)是Hg(II)溶液的体积,R (%)是去除率,而m (g)是所用BSO的重量。在本研究中进行的所有批次实验重复三次,以确保实验数据的准确性和可重复性。
2.4. 吸附剂再生性能研究
由于重金属的吸附通常是一种可逆过程,吸附剂可以在回收重复使用。通过重复吸附-解吸循环试验五次评估BSO的再生性。脱吸附实验如下所示:首先,取1.9 g硫脲与2.083 mL浓盐酸至50 mL烧杯,溶解后转移至250 mL容量瓶内,用去离子水稀释至刻度线并混匀,作为洗脱液备用。将吸附后的BSO加入到50 mL洗脱液中,然后将混合物在500 rpm下用磁力搅拌机搅拌3 h。通过双硫腙分光光度法测定解吸后的Hg(II)浓度,将再生的BSO重新引入50 mg/L硝酸汞溶液中,重复吸附和解吸5次,研究复合吸附剂的再生性。
3. 结果与讨论
3.1. 吸附剂的表征
3.1.1. 红外分析
通过地沟油(a)的FT-IR谱图(图1),在2932 cm−1和2850 cm−1处为高级脂肪酸甘油脂的-CH2-,由于不饱和脂肪酸通常以二分子缔合体的形式存在,其吸收峰出现在1728 cm−1 [14],通过BSO(b)的FT-IR谱图分析,在1041 cm−1附近的吸收带为Si-O-Si键的不对称伸缩振动,795 cm−1处为MgAl-OH振动吸收峰,符合膨润土的红外特征峰 [15] 。另外,在658 cm−1的特征峰属于C-S,证明已经形成了含硫共聚合物,综合分析表明,BSO材料的红外光谱与设计一致。
3.1.2. 扫描电镜分析
通过图2材料的SEM分析,白色的膨润土均匀分布在硫化地沟油聚合物里面,而且聚硫化物显示光滑的表面。
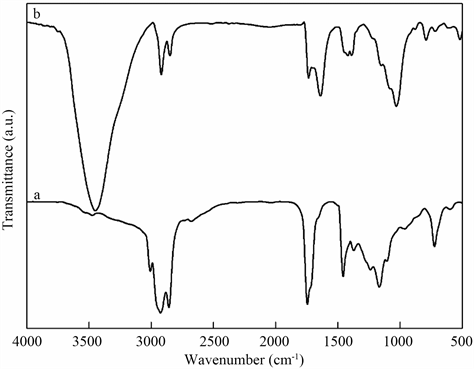
Figure 1. FT-IR spectrums of sulfurized waste oil (a) and BSO (b)
图1. 地沟油(a)和BSO(b)的红外谱图
3.1.3. 材料的X-射线光电子能谱分析
图3为制备的BSO的XPS谱图,S2p、Cls和Ols吸收峰位置分别为164.1、285.0和532.6 eV,该谱图结果与文献报道的硫聚合物基本吻合 [16] 。
3.2. 最佳吸附条件的探究分析
3.2.1. 吸附剂的用量对吸附效果的影响
当温度为25℃,分别取0.01 g、0.02 g、0.03 g、0.04 g、0.05 g吸附剂加入到5个浓度为50 mg/L的50 mL标准汞标准溶液,设置转速为600 rpm下磁力搅拌吸附210 min,通过使用双硫腙分光光度法测定吸附后溶液中汞离子的浓度。计算不同吸附剂的用量对Hg(II)的吸附量。

Figure 2. SEM surface topography images of BSO
图2. BSO的SEM表面形貌照片
如图4所示,当Hg(II)浓度一定时,随着吸附剂的量增加,吸附量不断增加,原因是用量的增加,材料提供了更多的吸附位点和活性基团,但是吸附剂量大于0.02 g时,随着投加量的进一步增大,可供吸附的离子数目不变,吸附量逐渐下降,因此本实验以下的0.02 g为最佳吸附剂的量。
3.2.2. 初始Hg(II)离子浓度对吸附效果的影响
当温度为25℃,称取0.02 g吸附剂分别加入到6个浓度分别为30、40、50、60、70、80 mg/L的50 mL标准汞标准溶液,设置转速为600 rpm下磁力搅拌吸附210 min,通过使用双硫腙分光光度法测定吸附后溶液中汞离子的浓度。计算不同浓度对Hg(II)的吸附量和去除率。
如图5所示,当Hg(II)离子浓度逐渐增加时,吸附量随着增加,但是整个过程去除率随着浓度增加而降低。吸附量增加是因为Hg(II)离子浓度增加,导致吸附活性位点碰撞的机会增加,但是当Hg(II)离子50 mg/L时,吸附剂对Hg(II)离子的吸附能力趋于饱和;去除率下降是因为当Hg(II)离子浓度很低时,吸附剂是过量的,去除率非常高。随着Hg(II)离子浓度增加,去除率逐渐减少,大量的不饱和离子在一定吸附时间内使吸附剂很快就达到饱和状态,所以吸附速度减慢。由图可知,50 mg/L是最佳初始Hg(II)离子浓度。

Figure 4. Effect of BSO dosage on the sorption of Hg (II)
图4. BSO的用量对吸附效果的影响
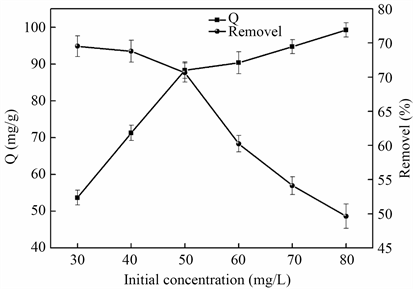
Figure 5. Effect of initial concentration of the Hg (II) solution on the sorption
图5. 溶液中Hg (II)初始浓度对吸附效果的影响
3.2.3. 汞离子溶液的pH对吸附效果的影响
当温度为20℃时,通过加入0.8 mol/L的NaOH溶液配置浓度为100 mg/L的pH分别为1、2、3、4、5、6的标准汞离子溶液50 mL,分别加入0.02 g吸附剂,设置转速为600 rpm下磁力搅拌吸附210 min。通过使用双硫腙分光光度法测定吸附后溶液中汞离子的浓度,计算不同吸附剂的用量对Hg(II)的吸附量。
如图6所示,当Hg(II)浓度一定时,随着pH值增加,吸附量不断增加,原因是pH的变化改变了材料的表面的ξ电位,ξ电位为负值时,对Hg(II)有较强的吸附能力,当溶液的pH升高时,溶液H+浓度较低,材料表面的ξ负电位值就越高,吸附Hg(II)能力就越大。当pH值大于4时,去除率和吸附量缓慢降低,当pH值大于6时,溶液中的OH-开始与Hg(II)结合生成沉淀絮状物附着吸附剂表面,阻碍Hg(II)进一步吸附。综上所述,在pH为4时,吸附量达到最佳。
3.2.4. 吸附时间对吸附效果的影响
取浓度为50 mg/L的汞标准溶液50 mL,加入到小烧杯中,加入0.02 g吸附剂,速率为600 rpm磁力搅拌下分别吸附15、30、60、90、120、150、180、210 min,然后,通过使用双硫腙分光光度法测定吸附后溶液中汞离子的浓度,计算不同时间对Hg(II)的吸附量。由图7可知,在0~60 min阶段,Hg(II)的吸附量迅速增加,60 min之后,材料的吸附位点逐渐趋于饱和,导致吸附量缓慢增加,在120 min以后吸附量几乎保持不变,平衡达到88.34 mg/g。

Figure 6. Effect of pH on the sorption of Hg(II)
图6. 溶液的pH对Hg(II)吸附效果的影响

Figure 7. Effect of contact time on the sorption of Hg(II)
图7. 吸附时间对Hg(II)吸附的影响
3.3. 吸附剂再生性能研究
脱吸附实验研究了吸附剂的再生性能,随着循环使用次数的增加,Hg(II)的吸附能力缓慢下降,经过吸附-脱吸附5次循环后,吸附量约为初始饱和吸附量的90%,仍然保持着较好的吸附性能。
4. 结论
本实验是以廉价的硫磺为原料,加入地沟油,在合适温度下单质硫开环,生成线性多硫烷二自由基链,然后双自由基与地沟油的不饱和脂肪烃发生聚合,接着添加膨润土,冷却,研磨粉碎,并且将该吸附剂对已知浓度的Hg(II)溶液进行吸附,采用双硫腙分光光度法对溶液中Hg(II)的含量进行了测定。通过条件优化,获得的最佳吸附条件为:pH值为4,温度设定在25℃,吸附剂用量为0.02 g,吸附时间为120 min时,Hg(II)溶液初始浓度为50 mg/L时吸附效果最好;此外,BSO具有很强的再生能力,5个循环后,材料的吸附量仍然保持初始饱和吸附量的90%。