摘要:
目的:观察不同类型的安神中药夜交藤、合欢皮、龙骨、牡蛎对失眠大鼠神经递质的影响,探讨它们治疗失眠的药理机制的差异。方法:利用对氯苯丙氨酸(PCPA)建立失眠大鼠模型,造模成功后分别给予夜交藤、合欢皮、龙骨、牡蛎治疗一周。治疗结束后通过酶联免疫吸附测定(Elisa)方法检测大鼠血浆中神经递质γ-氨基丁酸(GABA)、5-羟色胺(5-HT)、多巴胺(DA)和组胺(HIS)的含量。结果:同模型组相比较,夜交藤、合欢皮和龙骨、牡蛎这两类安神药均能够增加失眠大鼠血浆中GABA和5-HT含量(P < 0.01),同时又能够降低失眠大鼠血浆中DA和HIS的含量(P < 0.01)。结论:夜交藤、合欢皮和龙骨、牡蛎虽然都能使失眠大鼠兴奋性神经递质(DA、HIS)减少,抑制性神经递质(GABA、5-HT)增加,但是夜交藤和合欢皮增加抑制性神经递质作用更显著,而龙骨和牡蛎以降低兴奋性神经递质为主。
Abstract:
Objective: To observe the effects of different types of tranquilizers, such as Tuber fleece flower stem, Acacia, Keel, and Oysters on neurotransmitters in insomnia rats, and to explore the differ-ences in their pharmacological mechanisms for treating insomnia. Methods: A rat model of insomnia was established by using p-chlorophenylalanine (PCPA). After successful modeling, it was treated with Tuber fleece flower stem, Acacia, Keel, and Oysters for one week. After treatment, the neurotransmitters γ-aminobutyric acid (GABA), serotonin (5-HT), dopamine (DA) and histamine (HIS) were detected by enzyme-linked immunosorbent assay (ELISA). Results: Compared with the model group, the two kinds of tranquilizers, Tuber fleece flower stem, Acacia, Keel, and Oysters could increase the levels of GABA and 5-HT in the plasma of insomnia rats (P < 0.01), and at the same time they could also reduce the levels of DA and HIS in plasma of insomnia rats (P < 0.01). Conclusion: Evening Tuber fleece flower stem, Acacia, Keel, and Oysters can decrease the levels of excitatory neurotransmitters (DA, HIS) and increase the levels of inhibitory neurotransmitters (GABA, 5-HT) in insomnia rats. But, Tuber fleece flower stem and Acacia increased the inhibitory neurotransmitter effect more significantly, while Keel and Oyster mainly reduced excitatory neurotransmitters.
1. 引言
睡眠是维持人类健康不可缺少的部分,如果睡眠障碍,人的生活势必会受到影响。近几年,失眠患者人数呈逐年增长趋势。睡眠障碍正慢慢成为一场公共卫生危机 [1] 。目前人类对睡眠与觉醒的调控机制研究还不是很明确,睡眠障碍治疗仍然是以心理与西药疗法为主。西药起效快,得到大多数患者的认可 [2] ,但它还是有局限性。
目前,中医药对失眠治疗的有效性、特色和优势也已经得到认同,并且形成了独特的理法方药体系。但其理论基础尚缺乏客观实验依据,制约了其发展和推广。本研究正是从临床经验的基础上选取重镇安神(龙骨、牡蛎)和养心安神(夜交藤、合欢皮)中药结合失眠大鼠模型,对比研究两类安神药的疗效物质基础,揭示安神药的部分作用机理。为以后安神中药的开发和推广提供科学的实验依据。
2. 材料与方法
2.1. 实验动物
雄性SD大鼠48只,8周,体重(250 ± 10)g,购于上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2007-0005,质量合格证号:2007000525946,于福建省中医药研究院动物实验中心清洁级饲养室喂养。
2.2. 实验药物
中药饮片夜交藤、合欢皮、龙骨和牡蛎购于鹭燕(福建)药业股份有限公司。夜交藤和合欢皮,分别加入5倍量蒸馏水,浸泡1 h,煎煮2次,第一次30 min,第二次20 min,合并煎煮液,过滤后浓缩至2 g/mL, −20℃保存备用。龙骨和牡蛎:分别加入5倍量蒸馏水,浸泡1 h,煎煮2次,第一次60 min,第二次50 min,合并煎煮液,过滤后浓缩至3.5 g/mL,−20℃保存备用 [3] 。
2.3. 主要试剂
Rat 5-HT ELISA Kit (货号:ml9028308);Rat DA ELISA Kit (货号:ml9003201);Rat HIS ELISA Kit (货号:ml9002986);Rat GABA ELISA Kit (货号:ml9097322)购于mlbio公司。对氯苯丙氨酸购于Sigma公司。
2.4. 失眠大鼠模型的建立
采用PCPA按300 mg/kg溶于弱碱性生理盐水中,配置成混悬液,以10 mL/kg腹腔注射,连续腹腔注射PCPA 2天,大鼠昼夜节律消失,白天夜晚活动不停,睡眠减少直至消失,进食及饮水增多,表示造模成功 [4] 。实验在福建省中医药研究院动物实验室进行,室内温度22℃,湿度79%RH,正常对照组正常笼养,自然昼夜光照。
2.5. 实验大鼠的分组、给药及取材
造模成功后分成以下几组:正常组、失眠模型组、龙骨组、牡蛎组、夜交藤组和合欢皮组,每组8只。龙骨组、牡蛎组、夜交藤组和合欢皮组分别按35 g/kg、35 g/kg、20 g/kg、20 g/kg计量灌胃给药,正常组和模型组给予同等体积的生理盐水灌胃,1次/天,共7天。将实验大鼠用戊巴比妥钠腹腔注射麻醉(40 mg/kg),腹主动脉取血5 mL装到抗凝管中,离心取上清,分装EP管中冻存备用。取血后,断头,剪开头皮,用血管钳揭去颅骨和硬脑膜,剪断双侧视神经后用眼科镊子迅速取出大鼠的整个脑组织。用0.9%氯化钠溶液冲洗干净,置于液氮或 −80℃保存备用。
2.6. 神经递质的检测
神经递质的检测方法分别按照Rat 5-HT ELISA Kit (货号:ml9028308);Rat DA ELISA Kit (货号:ml9003201);Rat HIS ELISA Kit (货号:ml9002986);Rat GABA ELISA Kit检测试剂盒说明书进行。取不同处理组大鼠血浆样本各50 μL,不同浓度标准品各50 μL分别加入96孔酶标板中。标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,用封板膜封住反应孔,
37 ℃
水浴锅温育60 min。弃去液体,吸水纸上拍干,每孔加满洗涤液(350 μL),静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次。每孔加入底物A、B各50 μL,
37 ℃
避光孵育15 min。每孔加入终止液50 μL,15 min内,450 nm测OD值,计算样本的浓度。
2.7. 统计学方法
实验结果用数据和图表显示,实验数据以X ± S表示,用SPSS16.0统计分析软件进行数据处理,多组间比较用单因素方差分析,组间两两比较用t检验。以P < 0.05为差异存在统计学意义,P < 0.01为差异显著。
3. 结果
3.1. 不同药物处理后各组大鼠血浆中GABA含量变化情况
运用Rat GABA ELISA Kit检测各组大鼠的血浆GABA含量,检测结果如图1所示:正常组大鼠血浆中GABA的含量为2.85 μmol/L,模型组为2.12 μmol/L。模型组与正常组相比较,模型组的GABA含
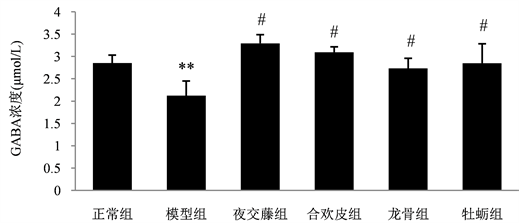
Figure 1. Comparison of plasma GABA content in experimental rats
图1. 各组实验大鼠血浆中GABA含量比较;注:与正常组比较,**P < 0.01;与模型组比较,#P < 0.01。
量降低(P < 0.01)。中药夜交藤组、合欢皮组、龙骨组和牡蛎组大鼠血浆中GABA的含量分别为3.29 μmol/L、3.09 μmol/L、2.74 μmol/L和2.85 μmol/L,四组中药处理组的GABA含量与模型组相比较,均上升,都具有显著统计学差异(P < 0.01)。与正常组比较无显著地统计学差异。
3.2. 不同药物处理后各组大鼠血浆中5-HT含量变化情况
Rat 5-HT ELISA Kit检测各组大鼠的血浆5-HT含量,结果如图2所示:与正常组大鼠血浆中5-HT的含量(3.84 ng/mL)相比较,模型组(3.24 ng/mL)显著降低,具有显著地统计学差异(P < 0.01)。与模型组相比较,夜交藤组(3.61 ng/mL)和合欢皮组(3.87 ng/mL)的血浆5-HT含量均升高,并且均具有显著性统计学差异(P < 0.01);龙骨组(3.57 ng/mL)与模型组相比,5-HT的含量也升高,具有统计学差异(P < 0.05);牡蛎组5-HT的含量为3.45 ng/mL,与模型组比较无统计学差异。
3.3. 不同药物处理后各组大鼠血浆中DA含量变化情况
运用Rat DA ELISA Kit检测各组大鼠的血浆DA含量,检测结果如图3所示:正常组大鼠血浆中DA的含量为328.77 pg/mL,模型组为379.52 pg/mL。模型组与正常组相比较,模型组的DA含量显著升高(P < 0.01)。中药夜交藤组、合欢皮组、龙骨组和牡蛎组大鼠血浆中DA的含量分别为332.24 pg/mL、350.80 pg/mL、310.91 pg/mL和307.36 pg/mL,四组中药组与模型组相比较,均能降低大鼠血浆中DA的含量,都具有显著统计学差异(P < 0.01)。与正常组比较无显著地统计学差异。
3.4. 不同药物处理后各组大鼠血浆中HIS含量变化情况
Rat HIS ELISA Kit检测各组大鼠血浆中HIS含量的结果如图4所示:模型组大鼠血浆中HIS的含量为4.03 ng/mL,与正常组大鼠血浆中HIS的含量(3.27 ng/mL)相比显著升高(P < 0.01)。而与模型组相比较,中药夜交藤组(3.22 ng/mL)、合欢皮组(2.94 ng/mL)、龙骨组(2.46 ng/mL)和牡蛎组(2.66 ng/mL)均能够显著降低失眠大鼠血浆中HIS的含量(P < 0.01)。
4. 讨论
失眠是本人对自己睡眠时间和(或)质量不满足并影响到白天功能的一种主观感受 [5] 。据统计,美国有1/3成年人存在睡眠障碍,芬兰有11%,加拿大17.8%,日本21%,法国19%的成人也存在睡眠障碍 [6] 。中国成年人失眠发生率约为38.2%,高于国外发达国家的失眠发生率。长期性的失眠容易使人产生焦虑、抑郁、记忆力下降等影响人的工作和生活 [7] 。因此,加强对失眠的机制和药物研究具有一定的社会意义。
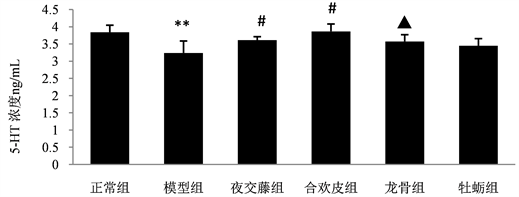
Figure 2. Comparison of plasma 5-HT content in experimental rats
图2. 各组实验大鼠血浆中5-HT含量比较;注:与正常组比较,**P < 0.01;与模型组比较,#P < 0.01,▲P < 0.05。
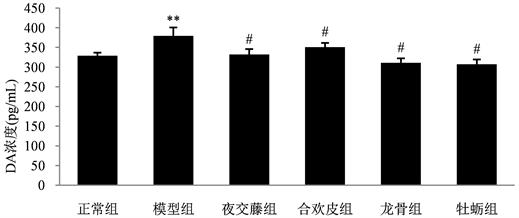
Figure 3. Comparison of plasma DA content in experimental rats
图3. 各组实验大鼠血浆中DA含量比较;注:与正常组比较,**P < 0.01;与模型组比较,#P < 0.01。

Figure 4. Comparison of plasma HIS content in experimental rats
图4. 各组实验大鼠血浆中HIS含量比较;注:与正常组比较,**P < 0.01;与模型组比较,#P < 0.01。
目前,临床上常用的镇静催眠药物中,作用于GABA通路的药物仍然占据主导地位 [8] 。GABA是哺乳动物中枢神经系统中重要的抑制性神经递质,当睡眠活性神经元被激活时,GABA对所投射的觉醒区的神经元产生抑制作用,从而促进觉醒向睡眠的转化,使深慢波睡眠增加 [9] 。5-HT又名血清素,也是一种重要的抑制性神经递质。多项研究证实高水平的5-HT在SWS的产生和维持中发挥重要作用 [10] [11] 。给大鼠中缝核微量注射对氯苯丙氨酸,减少5-HT合成,能够使动物出现失眠症状,这也是目前睡眠剥夺研究中常用的失眠模型 [12] 。本实验研究结果显示:同失眠模型组相比较,夜交藤、合欢皮和龙骨、牡蛎这两类安神药均能够增加失眠大鼠血浆中GABA和5-HT含量(P < 0.01)。
DA是脑内含量最多的单胺类神经递质之一,调控与觉醒相关的运动、认知等多种行为 [13] 。DA能神经元与睡眠、觉醒脑区间存在广泛的纤维联系,提示DA系统可能参与了睡眠–觉醒的调控 [14] 。HIS也是觉醒的重要调节物质,研究发现,正常大鼠觉醒期细胞外液中HIS释放量是睡眠期的4倍,与觉醒水平呈正相关,与睡眠期呈负相关 [15] 。该研究结果显示:同失眠模型组相比较,夜交藤、合欢皮和龙骨、牡蛎这两类安神药均能够降低失眠大鼠血浆中DA和HIS的含量(P < 0.01)。
5. 结论
综上所述,夜交藤、合欢皮和龙骨、牡蛎虽然都能使失眠大鼠兴奋性神经递质(DA、HIS)减少,抑制性神经递质(GABA、5-HT)增加,但是养心安神类中药夜交藤和合欢皮增加抑制性神经递质作用更显著,而重镇安神类中药龙骨和牡蛎以降低兴奋性神经递质为主。这可能是此两类中药安神作用的区别之一,其调节机制有待进一步研究。
基金项目
国家自然科学基金项目(81703843);福建省科技厅公益类科研院所基本科研专项(2015R1035-5,2017R1035-3);福建省卫计委医药卫生科技创新项目(2015-CX-35)。
NOTES
*通讯作者。