摘要:
BK病毒(BKV)是一种多瘤病毒,最早在1971年报道,并用该病人姓名命名。BK病毒在成人中隐形感染率达到80%。近年来由BK病毒引起的肾病、血性膀胱炎、急性肾功能衰竭等疾病越来越引起关注。目前还没有直接针对BK病毒的免疫预防策略,不存在抗BK病毒的疫苗。本文对来源于中国典型培养物保藏中心的一株BK病毒的VP1基因进行了测序及进化树分析,结果表明该毒株为I亚型Ib-1毒株。本鉴定结果为该病毒的进一步研究和应用奠定了基础。
Abstract:
The BK virus (BKV) is a polyomavirus first reported in 1971 and named after the patient. The BK virus has an invisible infection rate of 80% in adults. In recent years, diseases such as nephropathy, blood cystitis, and acute renal failure caused by BK virus have attracted increasing attention. There is currently no immune prevention strategy directed against BK virus, and there is no vaccine against BK virus. In this paper, the results of sequencing and phylogenetic analysis of the VP1 gene of a BK virus from the China Center for Type Culture Collection, showed that the strain was I subtype Ib-1 strain. The identification results laid the foundation for further research and application of the virus.
1. 引言
BK病毒是多瘤病毒属成员,于1971年从肾移植病人尿液中分离得到 [1]。全球的血清流行病学调查显示约80%成人血清呈阳性 [2]。BK病毒初次感染多发生在幼儿时期,随后潜伏在泌尿生殖系统,如肾小管上皮细胞和尿路上皮细胞中,还可以潜伏在淋组织及肝、肺、眼、脑等组织器官。当感染者处于免疫抑制时,BK病毒会被激活,并随尿液排出。BK病毒的尿排出在免疫低下或免疫缺陷的个体中,如器官转移接受者、肿瘤患者、孕妇及艾滋病患者中极易被检出 [3] [4] [5]。BKV的重新激活可引起的BK病毒相关肾病(BKVN)。Acott等 [6] 研究显示,在小儿肾移植术后受体发生BK病毒尿症的发生率为18%~50%,病毒血症的发生率为5%~16%,其中2%~8%的BK病毒血症可发展为BKVN,并因此造成高达50%的移植肾丢失率。除肾移植接受者外,BK多瘤病毒在骨髓移植接受者中也很常见,部分患者会出现出血性膀胱炎,甚至引发急性肾功能衰竭等疾病 [7] [8]。
BK病毒为环状双链DNA病毒,无外膜包裹。BK病毒基因组由三个区域组成:早期区域编码大、小T抗原;晚期区域编码病毒外壳蛋白VP1~VP3;非编码控制区调控大T抗原的表达,后者在激活BK病毒复制、细胞识别和致癌性等方面发挥重要作用 [9]。根据血清学或基因分型方法可将BK分离株分为四种亚型(I型~IV型)。I型是全球最常见的亚型(80%),其次是IV亚型(15%)、II亚型和III亚型都少有报道 [10]。Morel等基于VP1区域的100 bp序列(1977~2076)构建了一个算法,该算法能够快速确定99%的BKV子类型/子群,可将I亚型分为Ia、Ib-1、Ib-2、Ic毒株;IV亚型分为IVa-1、IVa-2、IVb-1、IVb-2、IVc-1、IVc-2毒株 [11]。
本文对来源于中国典型培养物保藏中心(CCTCC)的一株名为GDV229 (保藏中心编号)的BK病毒的VP1基因进行了测序,系统发育分析表明,该病毒属于I亚型中的Ib-1 (图1)。本鉴定结果为该病毒的进一步研究和应用奠定了基础。
2. 材料与方法
1) 样本和细胞
BK毒株和Vero E6细胞均来源于中国典型培养物保藏中心(CCTCC)。
2) 病毒扩增
从CCTCC获得1份标本,将其接种到状态良好、密度为50%的Vero E6细胞,置于37℃,含5% CO2的细胞培养箱中扩增。盲传三代后出现细胞病变效应(Cytopathic effect, CPE)。
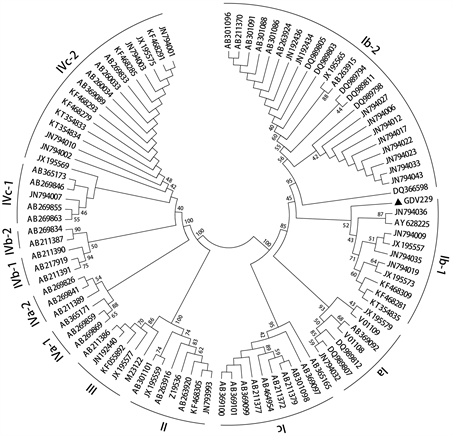
Figure 1. Phylogenetic analysis of the VP1 region of GDV229
图1. GDV229的VP1区域系统发育分析
3) RNA提取、RT-PCR、测序
待感染的细胞出现CPE现象,即收集细胞并从中提取DNA,根据BKV的保守序列设计引物进行PCR [12],扩增DNA片段。如表1所示,使用引物(BKV VP1-F和BKV VP1-R)扩增GDV229的VP1基因全序列。用E.Z.N.A Gel Extraction Kit胶回收试剂盒(购买于Omega公司)回收PCR产物。将回收的DNA产物送去测序公司测序。

Table 1. Primer sequences used to amplify the VP1 region of BKV
表1. 扩增BKV的VP1区所用引物序列
4) 序列收集和系统发育分析
为了进行系统发育分析,我们从GenBank下载了95个已经基因分型的BKV的VP1基因序列。结合本实验室分离的1个序列,共96条序列用于系统发育分析。
导出可于MEGA-X分析软件的meg.格式,用MEGA-X中的Clustal W程序对 BKV毒株进行VP1全序列比对。采用邻接法建立基于部分VP1基因的系统发育树。使用500次重复的bootstrap分析评估每个分支的统计支持。用P距离模型计算遗传距离。
3. 结果
3.1. BK病毒的VP1基因序列
从CCTCC获得GDV229,将其接种到状态良好、密度适中的Vero E6细胞上进行扩增。使用引物(BKV VP1-F和BKV VP1-R)扩增GDV229的VP1基因全序列,测序所得的1882~2632位点的基因序列信息为:
GGGTGGGATTTTTTTTTTTTTTTTTTTTTAAATTGGTGAGCTGTAACAGTACAAACAGAGGTCATTGGAATAACTAGCATGCTTAACCTTCATGCAGGGTCACAAAAAGTGCATGAGCATGGTGGAGGTAAACCTATTCAAGGCAGTAATTTCCACTTCTTTGCTGTTGGTGGAGACCCCTTGGAAATGCAGGGAGTGCTAATGAATTACAGGACCAAGTACCCAGATGGTACTATAACCCCAAAAAACCCAACAGCCCAGTCCCAGGTAATGAATACTGACCATAAGGCCTATTTGGACAAAAACAATGCTTATCCAGTTGAGTGCTGGGTTCCTGATCCTAGTAGAAATGAAAATACTAGGTATTTTGGGACTTTCACAGGAGGGGAAAATGTTCCCCCAGTACTTCATGTGACCAACACAGCTACCACAGTGTTGCTAGATGAACAGGGTGTGGGGCCTCTTTGTAAAGCTGATAGCCTGTATGTTTCAGCTGCTGATATTTGTGGCCTGTTTACTAACAGCTCTGGAACACAACAGTGGAGAGGCCTTGCAAGATATTTTAAGATTCCGCCTGAGAAAAAAGATCTGTAAAAAATCCTTACCCAATTTCCTTTTTTGCTAAGTGACCTTATAAACAGGAGAACCCCAGAAGAGTGGATGGGCAGCCTATGGTATGGTATGGAATCCCCAGGTAGAAGAGGGTTAAGGGGTGTTTGAATGGCACAGAAAAGACTTCCCAGGGGACCCCAGATATGATAAGATATATTGATAAACAAGGACATTGCAACTAAAAAAAGGGGGGGTAAAAAAAAAAAAAATTTTTTTTTTTTCC。
3.2. 根据VP1基因序列分析所得的BK病毒系统发育
为了确定我们所得BK病毒的分型,我们从GenBank下载了95个已经基因分型的BKV的VP1基因序列。结合本次分离的1个序列,共96条序列用于系统发育分析。用MEGA-X中的Clustal W程序对BKV毒株进行VP1全序列比对,采用邻接法建立基于部分VP1基因的系统发育树(图1)。
BKV-VP1基因区域的系统发育分析结果表明:GDV229属于BK病毒I亚型Ib-1毒株。这一结果也进一步印证了I亚型BK病毒在临床中最为常见。
4. 讨论
许多国家已经研究了BKV亚型和亚群在人种群中的分布。Takasaka等利用BK病毒的TCR区构建的系统发育分析发现:从日本分离出的BK病毒多为Ic毒株 [13]。Krumbholz和Ikegaya研究表明:Ia亚群在非洲高度流行,Ib-1亚群在东南亚高度流行,Ib-2亚群在欧洲高度流行 [14] [15]。这些提示BK病毒亚型的子群可能与人类种群相关。我们的研究结果鉴定了一株中国BK病毒的Ib-1毒株,这一结果也进一步印证了I亚型BK病毒在临床中最为常见。本鉴定结果为该病毒的进一步研究和应用奠定了基础。
基金项目
国家实验细胞资源共享服务平台项目(NSTI-CR18)。
NOTES
*通讯作者。