1. 引言
一氧化氮(NO)是在1980年提出的内源性血管舒张因子 [1] [2],于内皮细胞生成,由一氧化氮合酶(NOS)催化氧化L-精氨酸末端胍基中的氮产生。最近的研究证明信号分子NO对于诸如心血管系统稳态、骨代谢、免疫应答、癌症和神经传递等生理学过程起到关键作用 [3] [4] [5] [6] [7]。在过去的二十年中,开发可用于临床治疗可释放、产生和催化NO的材料,受到很大的关注 [7] [8] [9] [10]。值得关注的是,NO在抑制血小板激活和聚集、调节血管SMCs增生和血管舒张方面也起到重要的作用。NO的抗血小板聚集和调节止血的功能促使很多研究者去设计基于NO的抗凝表面。例如,Major等 [11] 报道了存在NO释放的聚合物涂层能显著减小血小板激活和血栓形成。Kushwaha等 [12] 发现被释放或催化产生的NO不仅能显著减少血小板活化聚集,而且还能抑制SMCs的增生。
然而,NO以可控、安全和稳定的速率释放或产生是确保其在体内成功应用的关键。目前,人们大多采用两种方案针对NO表面改性,一种是聚合物装载技术制备NO释放型材料,但这个方法制备的材料在体内的应用面临许多挑战。比如NO供体的半衰期较短、NO释放剂量的不稳定以及NO释放时间不够理想等 [13] [14] [15]。第二种方案是NO催化型材料,常用的制备方法是通过在材料表面固定有机硒化合物或者具有类谷胱甘肽过氧化物酶(GPx)催化活性的胱胺等分子,通过与内源性供体作用催化产生NO [16] [17]。然而,现有的方法通常涉及到复杂的基底预处理工艺,同时也受限于材料的种类和被固定目标分子与基底结合力 [18] [19] [20] [21]。
针对以上问题,我们着力研究开发一种简单且通用的策略制备可控催化NO速率的涂层材料。近来,Lee等人报道了聚多巴胺(PDAM),即基于贻贝仿生化学的粘附策略 [22]。其发现PDAM可以很好地粘附于各种基底,并且还能提供反应性官能团以固定其他生物分子。正如Lee等报道 [23],将基底材料浸没到目标分子和儿茶酚胺表面改性剂的混合溶液中,这样简单的一步法就可以调控待改性材料的界面性质。基于共价键合的方法,成功合成了含肝素和多巴胺的复合分子,该衍生物能容易地与聚氨酯基底结合并表现出良好的抗凝血性。Hong等人还证明PDAM能有效降低心血管材料引发的体内细胞毒性作用 [24]。这些报道表明PDAM涂层在心血管植入器械如:血管支架和人工血管表面改性上具有潜在的应用价值。
我们选用具有邻苯二酚结构的酚类化学物质(如图1(C),图1(D),图1(E),图1(F)),如没食子儿茶素没食子酸酯(EGCG)、没食子酸(GA)、多巴胺(Dopa)和邻苯二酚(Ca)和具有类GPx催化活性的化合物CySA (图1(A))为反应组分,利用“一步涂层浸涂”法(图1(B)),通过胱胺与不同儿茶酚的酚–胺化学反应在目标改性材料表面沉积具有NO催化活性的复合聚合粘附涂层。研究目的主要包括以下几个方面:1) 对NO催化粘附聚合涂层的形成机理进行探索性研究;2) 研究NO催化聚合粘附涂层的NO催化活性和持久力;3) 系统研究NO催化聚合粘附涂层与血液、内皮细胞(ECs)和SMCs作用机制。
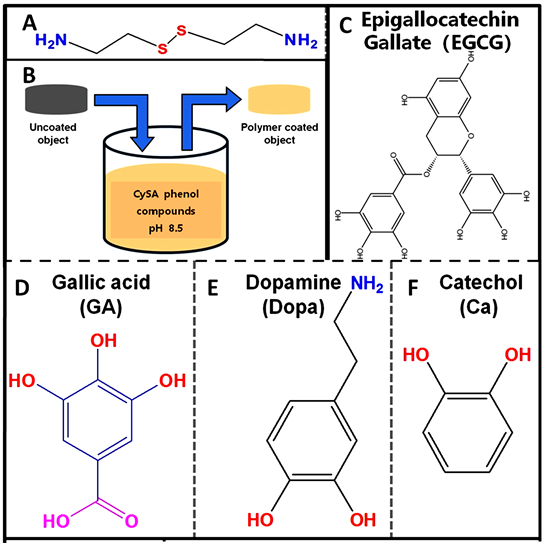
Figure 1. Chemical structure of (A) cysteamine CySA (A), (C) epigallocatechin gallate EGCG, (D) gallate GA, (E) dopamine and catechol Ca (F). Schematic diagram of “one-step dip-coating method” surface modification (B)
图1. (A) 胱胺CySA (A),(C) 表没食子儿茶素没食子酸酯EGCG,(D) 没食子酸GA,(E) 多巴胺(Dopa)和邻苯二酚Ca (F) 化学结构。“一步浸涂法”表面改性示意图(B)
2. 实验部分
2.1. 实验材料
Dopa (纯度 ≥ 98.0%)、GA (纯度 ≥ 99.0%)、Ca (纯度 ≥ 99.0%),EGCG (纯度 ≥ 95.0%,均购于Sigma公司),CySA (纯度98.0%,购于Aldrich公司),CD62p抗体(GMP-140, Serotec Co.);HRP抗体(KPL Co.);乙二胺四乙酸(EDTA);Griess (Sigma-Aldrich);
JY-82接触角仪购自河北承德仪器厂;傅里叶红外光谱仪购自美国Thermo Fisher Scientific公司;NO分析仪购自美国GE analytical instruments公司;X-射线光电子能谱仪购自美国Thermo Electron公司;电子显微镜购自日本Jeol公司。
2.2. NO催化涂层的制备
由不同多酚化合物Dopa/GA/Ca/EGCG和CySA投料摩尔比为1:1加入到Tris缓冲溶液(1.2 mg/mL)中,尔后将清洗干净并干燥的316L SS浸没于上述反应溶液中,每个样品加入1 mL上述反应溶液,在室温下沉积12小时,然后用蒸馏水超声清洗NO催化聚合粘附涂层改性样品,清洗过程重复三次后对样品进行干燥。制备所得的共聚薄膜分别对应标记为Ca/CySA、Dopa/CySA、EGCG/CySA、GA/CySA。
2.3. 材料学表征
2.3.1. X射线光电子能谱
采用XPS进行涂层化学成分检测。其中,XPS检测设备型号为Kratos, Axis Ultra DLD。激发源为X-ray单色Al K-α (hν = 1486.6 eV),运行参数为15 kV和150 W,荷电位移校正取C(1s) = 284.8 eV (饱和羟碳原子),光电子起飞角为30˚。检测前,待检对照样品316L SS采用氩等离子进行表面清洗。
2.3.2. 基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)分析
MALDI-TOF MS检测采用MALDI微型MX时间飞行质谱仪(Waters, Milford, MA)的反射模式。MALDI源配置为337 nm N2激光,运行条件为4 ns持续脉冲。使用N,N-二甲基苯胺(DHB)作为基质,激光脉冲能量为200单位(AU)。质谱的检测范围设置50~4000 m/z。每组质谱结果取于十次激光束的平均值。每个样品的质谱数据综合十次质谱检测结果。DHB溶解于TFA/乙腈(体积比1:4)以获得的20 mg/mL的基质溶液。聚合薄膜直接修饰的MALDI靶(不锈钢)用于MALDI检测。在检测之前,滴加1 μL基质溶液到经聚合薄膜修饰后的MALDI靶表面。
2.3.3. 表面亲水性和形貌分析
采用原子力显微镜(AFM, SPI 3800, NSK Inc., Japan)考察样品的表面形貌和粗糙度。
采用扫描电子显微镜(SEM, Quanta 200, FEI, Holland)对形貌进行观察。
薄膜表面静态接触角采用Krüss GmbH DSA 100 Mk 2接触角测定仪进行检测。本文选用极性溶剂双蒸水和非极性溶液二碘甲烷(CH2I2, Sigma-Aldrich, Purity ≥ 99.0%)进行接触角检测,在常温下,将5 μL的待测液体滴于样品表面,待液滴稳定时,拍取液滴图片,采用DSA 1.8软件进行接触角分析。
2.3.4. NO催化释放
采用Griess方法检测不同多酚化合物与胱胺聚合涂层在60分钟内的NO催化释放速率。将样品浸没于由0.5 mL的Griess(4 mM)与等体积供体(20 μM SNAP/GSH, 1 mM EDTA)组成的混合溶液中。在预期设定的反应时间内取出样品以终止催化反应。取每个时间点NO催化反应的反应液200 μL加入96孔板中,静止15分钟后用酶标仪于496 nm波长下读取吸光度值。同时,选取合适浓度梯度的供体来绘制标准曲线,其中选用HgCl2作为催化剂。具体实验步骤如下:将梯度稀释的97.5 μL供体与等体积Griess混合加入96孔板中,然后加入5 μL的HgCl2进行催化反应(HgCl2的催化供体产生NO速度极快,故此用做标准曲线的制定),反应结束后静止15分钟,然后置于酶标仪中于496 nm波长下读取吸光度值。标准曲线所拟合的方程用于NO催化速率的计算。
2.4. 生物相容性评价
2.4.1. NO催化涂层对血小板和HUASMCs的影响
新鲜血液由成都血液中心提供。志愿者在献血前两周未服用阿司匹林药物。将采集的血液与柠檬酸钠抗凝剂以体积比9:1混合,12小时内开展血液实验评价。全血以1500转离心15分钟获得富血小板血浆(PRP)。血小板粘附具体实验步骤如下:每1 mL PRP中加入10 μL由S-亚硝基乙酰青霉胺(SNAP,10 μM)和谷胱甘肽(GSH、10 μM)组成的供体。此外,每1 mL的PRP中加入10 μL胶原溶液(50 μg/mL)用于诱导血小板激活以模仿支架在体内撑开时损伤血管的环境。每个样品中加入500 μL的PRP并于37℃条件下孵化30 min。随后样品用磷酸缓冲盐溶液(PBS)清洗以去除未牢固粘附的血小板,随后样品浸泡在4%戊二醛中过夜固定。固定后,样品逐级脱水/脱醇和临界点干燥。最后,样品喷金于SEM下观察拍照。
HUASMCs生长行为评价选用额外添加供体(10 μM SNAP/GSH)和无供体的培养基进行细胞培养。细胞培养时间分别为2小时和24小时。罗丹明荧光染色法用于细胞形态表征,细胞增殖检测试剂盒CCK-8用于细胞增殖评价。荧光染色法用于细胞形态分析,选取密度为5 × 104 cells/cm2的HUASMCs用于材料表面接种。使用鼠抗人α-SMA抗体对材料表面粘附的HUASMCs进行免疫荧光染色。具体步骤如下:将置于含HUASMCs的培养基中的样品在分别培养1天和3天后取出,用PBS充分清洗,并于4%多聚甲醛溶液中固定细胞1小时。染色前,吸去多聚甲醛固定液,将样品用PBS清洗3次。随后,加入牛血清白蛋白(BSA, 1%)封闭30分钟,随即用PBS充分漂洗。尔后,再加入鼠抗人α-SMA抗体(1:100),并于37℃下孵育30分钟。样品孵育后用PBS清洗,随即再加入FITC标记的羊抗鼠免疫球蛋白,于37℃下孵育30分钟。最终,经PBS充分清洗后用荧光显微镜进行拍照观察。
使用CCK-8试剂盒检测样品表面HUASMCs的增殖行为,材料表面HUASMCs的接种密度为5 × 104 cells/cm2。细胞培养1天和3天后取出样品,用PBS清洗两次,随后每个样品中分别加入350 μL含有10% CCK-8试剂的DMEM-F12培养基(含5% FBS,无酚红)。标准培养条件37℃下孵育3小时后,从每个样品中吸取200 µL培养基至96孔板,置于酶标仪中于450 nm处读取吸光度值。细胞在样品表面培养时间设定为2小时和24小时
采用环磷酸鸟苷cGMP ELISA试剂盒(上海沪峰生物科技有限公司,中国)定量检测血小板合成的cGMP浓度。首先,将样品浸泡于PRP中孵化,其实验步骤与血小板粘附类似。孵化30分钟后,加入100 μL 10% triton-X超声破碎。接着将破碎后的PRP混合液在2500转下离心,分离细胞碎片,吸取上清液用于cGMP检测,其中cGMP检测过程参考试剂盒说明。采用cGMP ELISA试剂盒定量检测HUASMCs合成的cGMP浓度。其中,HUASMCs培养时间为2小时。实验方法与血小板合成的cGMP浓度检测类似。
2.4.2. NO催化涂层对HUVECs的影响
为了评价HUVECs的生长行为,同样使用添加供体(10 μM SNAP/GSH)和无供体的培养基作为对照。实验方法与HUASMCs类似。
2.4.3. NO催化涂层对SMCs与ECs共培养的影响
HUVECs与HUASMCs共培养用于评价细胞间竞争粘附行为。HUVECs和HUASMCs分别在含有5 mM Cell Tracker Green CMFDA和5 mM Orange CMTMRECs的DMEM/F12培养基(含15%胎牛血清FBS)中孵育20分钟;经PBS清洗过后,用无染料的DMEM/F12培养基继续孵育30分钟。随后,采用0.25%的胰酶分别对荧光标记的HUVECs与HUASMCs进行消化,收集细胞悬液并于1200 rpm离心5分钟;DMEM/F12完全培养基重悬细胞,并分别调整细胞密度至5 × 104 cells/mL。最后HUVECs与HUASMCs以1:1的种植密度接种到样品表面,于5% CO2,37℃条件下分别培养2小时和24小时后采用荧光显微镜观察材料表面粘附的细胞并对粘附的细胞进行数量统计分析。
3. 结果分析
3.1. 材料学结果分析
3.1.1. X射线光电子能谱
XPS全谱显示,四种不同多酚所制备的涂层均出现了儿茶酚和CySA的特征元素C、N、O和S峰,而基底材料316L SS的Fe,Ni,Cr特征元素消失(图2),说明Ca/CySA、Dopa/CySA、EGCG/CySA和GA/CySA涂层已成功覆盖于基底材料表面。XPS结果显示,不同儿茶酚所制备的聚合涂层的S含量显示出明显的差异(表1)。这就表明使用不同种类儿茶酚可调控聚合涂层的S含量,继而调控NO催化释放速率。
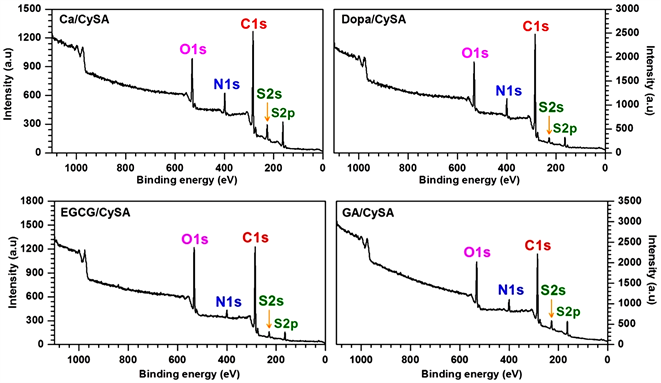
Figure 2. XPS of Ca/CySA, DOPA/CySA, EGCG/CySA and GA/CySA coatings deposited on 316L SS surface
图2. 316L SS表面沉积的Ca/CySA,Dopa/CySA,EGCG/CySA和GA/CySA涂层的XPS

Table 1. Elemental composition of Ca/CySA, DOPA/CySA, EGCG/ CySA and Ga/CySA coatings deposited on 316L SS surface
表1. 316L SS表面沉积Ca/CySA,Dopa/CySA,EGCG/CySA和GA/CySA涂层元素组成
3.1.2. 基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)分析
MALDI-TOF MS对不同儿茶酚制备的NO催化涂层的聚合机理进行分析研究。首先,对N1s高分辨进行拟合分析。结果表明,四种不同儿茶酚制备的NO催化聚合涂层的N1s拟合峰在400.5 eV处出现了儿茶酚和CySA分子中均不存在的芳香C-N和芳香C=N (图3(A))。芳香C-N的产生证实了儿茶酚与CySA或Tris之间发生了迈克尔加成反应,而芳香C=N的出现证明了儿茶酚与CySA或Tris存在西佛碱反应。结合MALDI-TOF MS质谱(图3(E),图3(G),图3(I))分析,推导出Ca/CySA、Dopa/CySA和EGCG/CySA涂层形成的可能反应途径(图3(F),图3(H),图3(J))。与GA/CySA形成的聚合机理类似,Ca/CySA和EGCG/CySA的聚合形成也主要涉及两类反应类型,其中一类是以Tris和CySA静电作用为主的物理自组装,另外一类是以儿茶酚Ca和EGCG与CySA进行希夫碱和迈克尔加成共价反应(图3(F),图3(J))。由于PDAM的形成涉及到较为复杂的氧化聚合方式,因此,在解析Dopa/CySA聚合机理之前先对PDAM的聚合涂层进行MALDI-TOF MS分析。MALDI-TOF MS质谱分析发现419、409、271和253 m/z峰位的出现证实了Tris参与多巴胺聚合。在多巴胺中加入CySA制备共聚涂层Dopa/CySA时,我们发现CySA的加入削弱了多巴胺的自聚合行为。在与多巴胺的聚合反应过程中,CySA与多巴胺主要以迈克尔加成的方式进行反应(图3(H))。此外,Dopa/CySA涂层N1s高分辨图谱中401.7 eV处出现的
强吸收峰以及MALDI-TOF MS质谱中的274 m/z峰证实了CySA与Tris以物理自组装的形式参与了聚合(图3(B))。
3.1.3. 表面亲水性和形貌分析
我们采用AFM对涂层的表面形貌和粗糙度进行分析。每个样品表面随机选择6个不同20 × 20 µm2区域进行检测,所得形貌图谱用于粗糙度的计算。从图4(A)中的AFM图片可以看出,经过抛光后的316L SS表面相对光滑,其表面均方根粗糙度(RMS)为3.4 ± 0.2 nm。涂层的沉积导致了316L SS表面粗糙度的增加,其涂层的RMS范围为5.8~10.4 nm,均远小于血液相容性的限制要求粗糙度的最小值50 nm。
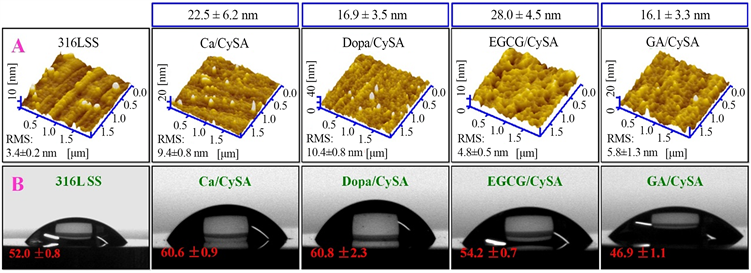
Figure 4. Thickness of Ca/CySA, DOPA/CySA, EGCG/CySA and Ga/CySA coatings deposited on 316L SS surface (top), AFM morphology (A) and water contact angle (B)
图4. 316L SS表面沉积的Ca/CySA,Dopa/CySA,EGCG/CySA和GA/CySA涂层的厚度(图上方)、AFM形貌图(A)和水接触角(B)
3.1.4. NO催化释放
我们制备具有不同S-S含量涂层的目的是为了实现NO释放速率的调控,以满足不同临床应用的需求。图5的NO催化速率评价结果显示,4种具有不同S-S含量的涂层在NO催化释放速率上表现出显著性的差异。NO催化涂层的催化释放速率均表现出两种NO催化释放模式即快模式和慢模式。快模式的发生是由S-S直接通过裂解供体产生NO。而慢模式主要涉及到S-S与还原性谷胱甘肽和供体之间的多级反应。在反应进行的前三分钟内,NO催化速率表现出一级释放模式。3分钟之后,NO催化释放速率开始显著下降表现为慢速模式,其催化速率由3分钟的1.5 × 10−10 mol × cm−2 × min−1下降到60分钟的0.1 × 10−10 mol × cm−2 × min−1,且数值均落在正常药理学范围内(4~0.5× 10−10 mol × cm−2 × min−1)。而NO催化释放速率的逐渐下降是由于反应过程中供体SNAP和GSH的不断消耗而导致。
3.2. 生物相容性结果分析
3.2.1. NO催化涂层对血小板和HUASMCs的影响
在心血管系统中,NO的其中一个重大生理作用是通过促进cGMP的合成,在NO-cGMP信号通路的介导下发挥着许多重要生理作用如:抑制血小板激活和聚集和HUASMCs增殖等。因此,我们首先对与NO催化涂层作用的血小板以及HUASMCs的cGMP合成进行评价。如图6(A)、图6(B)所示,四种不同儿茶酚聚合所得的NO催化涂层在添加供体条件下与血小板和SMCs作用后,均大幅上调了血小板和HUASMCs的cGMP合成,有效地证实了NO对cGMP的生理效应,同时间接地证明了涂层的NO催化作用。然而,我们发现四种不同儿茶酚聚合所得的NO催化涂层的血小板和HUASMCs合成cGMP浓度与NO释放速率并未显示严格的线性相关性。NO催化释放速率最大的Ca/CySA涂层,其血小板和HUASMCs合成的cGMP浓度最低。这可能是由于涂层在PRP和培养基环境下与PBS环境下催化供体产生NO能力不同导致的。在PRP和含SMCs的培养基中,涂层表面的血小板和SMCs快速粘附导致其NO催化位点的掩盖,而不同的涂层表面性质相差较大,其表面快速粘附的血小板和SMCs也会有所差异,从而导致涂层表面NO催化位点掩盖程度不一,进而导致不同程度的NO催化能力的下降。为了研究血小板在NO催化涂层表面的粘附行为,我们选择了无供体SNAP/GSH添加的PRP和额外添加供体SNAP/GSH的PRP进行血小板培养实验。如图7所示,在未添加SNAP/GSH的对照组中,NO催化涂层表面均有大量血小板粘附,且粘附的血小板处于高度激活、聚集状态,大部分血小板伴随内容物在材料表面完全铺展。在添加SNAP/GSH组中,316L SS上的血小板粘附数量和激活程度与未添加SNAP/GSH组相比并无显著性改变。然而,添加供体SNAP/GSH后,四种NO催化涂层均表现出极大的血小板抑制作用,其表面只有少量血小板粘附,且粘附的血小板为典型的静息圆球形态。血小板的粘附实验有力地证实了血小板的cGMP合成结果。进一步的,开展了对SMCs生长行为的评价。图8显示,SMCs的生长行为表现出与血小板粘附相类似的现象。HUASMCs在样品表面培养2小时后,我们发现,培养基中无论添加供体SNAP/GSH与否,316L SS表面粘附的HUASMCs都充分铺展(图8(A))。与此形成鲜明对比的是,培养基中未添加SNAP/GSH时,与316L SS表面一样,四种NO催化涂层表面粘附了大量铺展的HUASMCs,而当培养基里添加供体SNAP/GSH后,NO的产生促进了HUASMCs的cGMP合成(图6),进而抑制了HUASMCs粘附、铺展(图8(A))、骨架伸展(图8(B))和增殖(图8(C))。
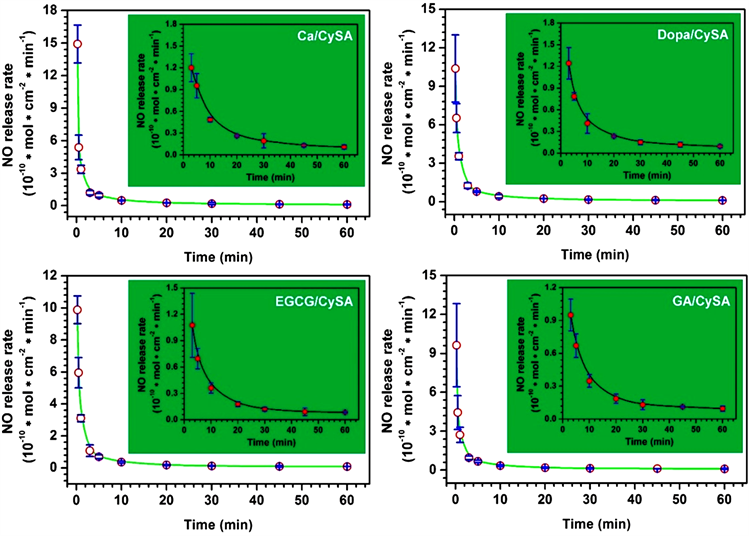
Figure 5. NO catalytic release rates of Ca/CySA, DOPA/CySA, EGCG/ CySA and Ga/CySA (mean ± standard deviation, n = 4; the donor was composed of 10 μM SNAP/GSH and 500 μM EDTA. The inner illustration is a vertical magnification of a 3~60 minute partial release curve)
图5. Ca/CySA,Dopa/CySA,EGCG/CySA和GA/CySA的NO催化释放速率(平均值 ± 标准差,n = 4;供体由10 μM SNAP/GSH和500 μM EDTA组成;内插图为纵坐标放大的3~60分钟的部分释放曲线)
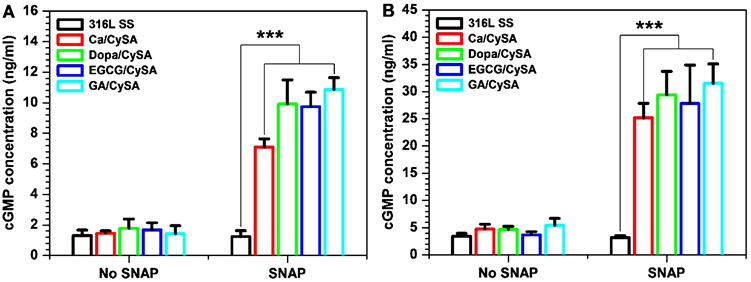
Figure 6. (A) The cGMP concentration of platelets cultured on 316L SS, Ca/CySA, DOPA/CySA, EGCG/ CySA and GA/CySA for 30 min. HuASMCs were cultured on the surface of 316L SS, Ca/CySA, DOPA/CySA, EGCG/CySA and GA/CySA for 2 h at cGMP concentration (Donor composition: 10 μm SNAP/GSH; Mean ± standard deviation, n = 4; One-way ANOVA, *p < 0.05, **p < 0.01, ***p < 0.001)
图6. (A) 血小板在316L SS,Ca/CySA,Dopa/CySA,EGCG/CySA和GA/CySA表面培养30分钟的cGMP合成浓度。HUASMCs在316L SS,Ca/CySA,Dopa/CySA,EGCG/CySA和GA/CySA表面培养2小时的cGMP合成浓度(供体组成:10 μM SNAP/GSH;平均值 ± 标准差,n = 4;单因素方差分析,*p < 0.05,**p < 0.01,***p < 0.001)

Figure 7. SEM morphology of platelet adhesion on different samples
图7. 不同样品表面粘附血小板的SEM形貌图
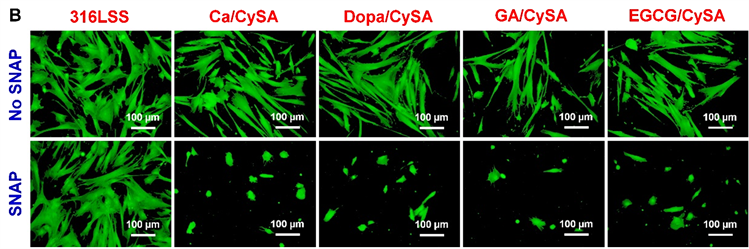
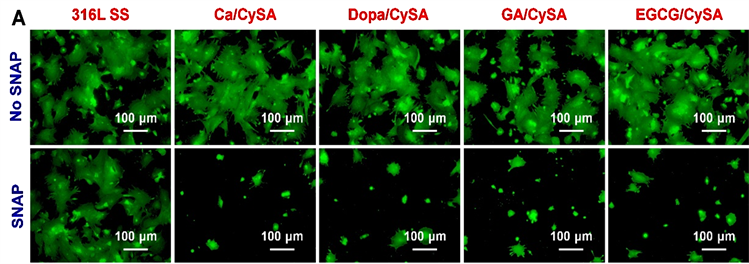
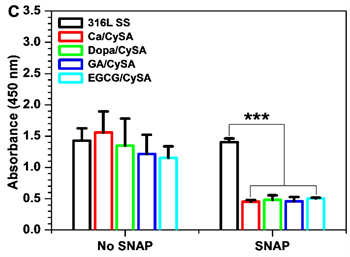
Figure 8. Fluorescence staining of HuASMCs cultured on different samples for 2 h (A) and 1 day (B) and proliferation results for 1 day (C) (Donor composition: 10 μm SNAP/GSH; Mean ± standard deviation, n = 4; One-way ANOVA, *p < 0.05, **p < 0.01, ***p < 0.001)
图8. HUASMCs在不同样品表面培养2小时(A)、1天(B)的荧光染色图以及培养1天的增殖结果(C) (供体组成:10 μM SNAP/GSH;平均值 ± 标准差,n = 4;单因素方差分析,*p < 0.05,**p < 0.01,***p < 0.001)
3.2.2. NO催化涂层对HUVECs的影响
尽管NO在心血管疾病治疗中具有许多独特的优势,但是过量的外源性NO引入会导致与超氧化物发生反应,反应形成的过氧硝酸盐会引起许多副反应,典型的如细胞毒性。因此,我们进一步开展了NO催化涂层对EC生长行为的评价。图9为HUVECs在NO催化涂层表面培养不同时间的粘附和增殖结果。HUVECs培养2小时后的典型荧光染色结果显示(图9(A)),培养基在没有添加SNAP/GSH条件下,316L SS表面粘附的细胞大多呈现圆球形,而四种涂层表面粘附的细胞大部分呈铺展状态,这说明NO催化涂层表面具有适宜的HUVECs粘附和生长微环境。细胞粘附统计结果显示,四种涂层均显著的促进了细胞的初期粘附(图9(C))。图9(D)和图9(E)中的细胞形态统计结果表明,四种催化涂层上的单个细胞铺展面积较316L SS表面粘附的细胞面积增大了80%~150%,细胞短/长轴比值却无显著性差异。当细胞培养基中添加供体SNAP/GSH后,316L SS表面粘附的细胞生长行为并未发生明显变化。与此不同的是,培养基中SNAP/GSH的添加对NO催化涂层上的细胞生长行为造成了显著性的影响。添加SNAP/GSH后,NO催化涂层表面细胞粘附数量显著增加,细胞铺展面积显著增大。其中Ca/CySA和Dopa/CySA涂层表面粘附的细胞短/长轴比明显下降,这意味着其表面具有更强的细胞迁移能力。这些数据表明,NO催化涂层催化产生的NO可有效促进HUVECs粘附、铺展和骨架发展,且有利于细长型HUVECs的形成,进而增强细胞的迁移和增殖能力。为了证实这个推论,我们进行了长时间的细胞培养实验。如图9(B)和图9(F)所示,在没有添加SNAP/GSH的条件下,与316L SS相比,四种儿茶酚制备的NO催化涂层提供了更有利于细胞生长的微环境,其表面具有更好的细胞粘附和增殖。在添加SNAP/GSH后,四种儿茶酚制备的NO催化涂层因NO的催化释放进一步促进了细胞的增殖。
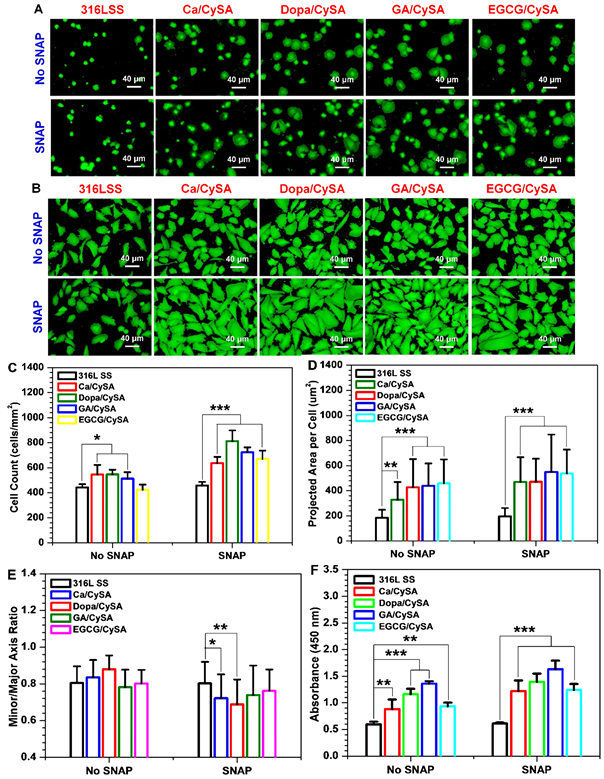
Figure 9. Fluorescence staining images of HUVECs after 2 h (A) and 1 day (B) culture on the surface of 316L SS and 4 different NO catalytic coatings; (C) Statistical results of the number of adherent cells cultured for 2 hours (no less than 12 pictures were used for the number of adherent cells); (D) Single cell spreading area (E) and short/long axis ratio (no less than 12 pictures were used for cell morphological statistical analysis, and the number of cells was greater than 100); (F) HUVEC proliferation results (Donor composition: 10 μm SNAP/GSH; Mean ± standard deviation, n = 4; One-way ANOVA, *p < 0.05, **p < 0.01, ***p < 0.001)
图9. HUVECs于316L SS和4种不同NO催化涂层表面培养2小时(A)和1天(B)后的荧光染色图片;(C) 细胞培养2小时的粘附数量统计结果(用于细胞粘附数量统计的图片不少于12张);(D) 单个细胞铺展面积(E)和短/长轴比值(用于细胞形态统计学分析的图片不少于12张,且细胞个数大于100);(F) HUVEC增殖结果(供体组成:10 μM SNAP/GSH;供体组成:10 μM SNAP/GSH;平均值 ± 标准差,n = 4;单因素方差分析,*p < 0.05,**p < 0.01,***p < 0.001)
3.2.3. NO催化涂层对HUASMCs和HUVECs共培养的影响
为了评价HUVECs与HUASMCs之间的竞争行为,进一步开展了细胞共培养实验,用于细胞共培养的HUVECs和HUASMCs的接种比值为1。如图10所示,细胞在无SNAP/GSH添加的培养基中培养2小时后,316L SS表面的HUVECs/HUASMCs比值为0.96,非常接近接种比值1。而NO催化涂层HUVECs/HUASMCs比值增加至1.9~2.1,这说明NO催化涂层表面具有选择性促HUVECs粘附和生长能力。当培养基添加SNAP/GSH后,316L SS表面的HUVECs与HUASMCs比值为0.94,无显著性变化。然而,NO催化涂层因供体SNAP/GSH的添加连续催化释放NO,而NO的出现进一步增强了对HUVECs的选择性,其表面粘附的HUVECs与HUASMCs比值提高至2.4~3.1。其中GA/CySA表面粘附的HUVECs/HUASMCs比值最高,为3.1,是316L SS表面粘附的HUVECs/HUASMCs比值的3.3倍。这说明NO具有选择性调控HUVECs和HUASMCs生长的生物学功能。
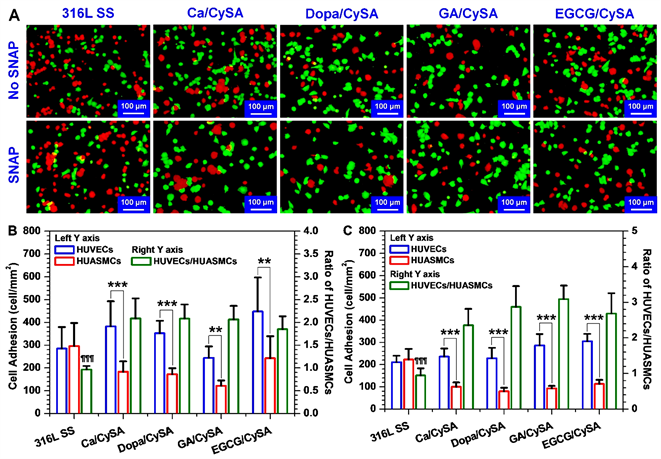
Figure 10. (A) 2 h fluorescence images of HUVECs and HUASMCs co-cultured on 316L SS, Ca/CySA, DOPA/CySA, GA/CySA and EGCG/CySA surfaces (CMFDA-labeled HUVECs in green and CMTMR labeled HUASMCs in red); (B) Statistical results of the amount of cell adhesion on the surface of non-donor group samples; (C) Statistical results of the amount of cell adhesion on the surface of the donor group samples. (Mean ± standard deviation, n = 4; One-way ANOVA, *p < 0.05, **p < 0.01, ***p < 0.001)
图10. (A) 316L SS,Ca/CySA,Dopa/CySA,GA/CySA和EGCG/CySA表面HUVECs与HUASMCs共培养2小时的荧光图(CMFDA标记HUVECs为绿色,CMTMR标记HUASMCs为红色);(B) 非供体组样品表面的细胞粘附数量统计结果;(C) 供体组样品表面的细胞粘附数量统计结果。(供体组成:10 μM SNAP/GSH;平均值 ± 标准差,n = 4;单因素方差分析,*p < 0.05,**p < 0.01,***p < 0.001)
4. 总结
我们发展了一种简单的制备含CySA的NO催化复合聚合粘附涂层方法。通过胱胺与不同儿茶酚的酚–胺化学反应,利用“一步涂层浸涂”法成功地在材料表面构建具有一氧化氮(NO)催化活性的复合聚合粘附涂层,得到可控催化NO速率的涂层材料。NO催化涂层催化产生的NO不仅可以显著地抑制胶原诱导的血小板激活与聚集,HUASMCs粘附、增殖和迁移,而且还能有效促进HUVECs粘附、增殖和迁移。涂层因具有制备过程简单、高效等特点,在血液接触类材料表面改性上具有广阔的应用前景。
致谢
这项工作由四川省青年科技基金——杰出青年资助计划(2016JQ0027)支持。
NOTES
*通讯作者。