1. 引言
在2019年12月底,由新型冠状病毒(COVID-19)引起的非典型肺炎得到人们的广泛关注 [1]。新型冠状病毒是冠状病毒的一种,是一类严重影响人类身体健康的疾病,能够感染人体的多个器官,比如肝脏、肠胃、神经系统,严重影响人体的呼吸系统 [2]。自发现第一例新型冠状病毒携带者至2020年3月28日,中国累计确诊人数高达81439例,累计死亡人数高达3300例。其中武汉市作为国内首个发现确诊病例的地方,疫情最为严重,截至2020年3月28日,武汉累计确诊病例人数达67801例,累计死亡人数高达3182例。在 [3] 中,作者提到新型冠状病毒在早期的传播能力与严重急性呼吸系统综合征(SARS)相似,但是从目前情况来看新冠肺炎的发病率已经远远超过2002年到2003年报告SARS的发病率,对人体的伤害却非常大,病情严重的患者甚至会有生命危险。为了阻止病毒传播,防止更多人被感染,中国政府迅速展开抗击疫情行动,自2020年2月23日至24日以来,对武汉以及周边主要城市积极采取措施。在疫情初期,相关领导人果断做出一系列决策,比如关闭所有娱乐性场所、火车站以及在机场设立体温检测处以便筛查体温异常、对于确诊病例集中收治、对于疑似病例进行隔离、对于密切接触过确诊病例的人员进行为期14天的观察等。由于国内疫情初期大多数确诊病例来自武汉,政府在2020年1月23日上午10时,做出重要决定——对武汉市采取封城管理,禁止任何人进出,同时停止一切活动,包括娱乐性场所、机场、火车、公交地铁等 [4]。由于确诊患者在初期迅速增加,导致医院床位出现供不应求的情况,政府迅速采取一系列措施,在十天左右时间建立起两家医院包括火神山医院和雷神山医院,分别可容纳1600张床位和1000张床位 [5],及时减轻了武汉市医疗负担。但是由于COVID-19的潜伏期时间可以长达14天,仍有被感染的人群尚未发现,导致确诊人数不断增加,因此及时有效地分析病情增长趋势,以及预测未来几天的确诊病例数量以及累计死亡人数,对有针对性地采取措施以及制定必要的保护措施对控制疫情的发展是至关重要的 [6]。
Domenico Benvenuto [7] 等人使用差分整合移动平均自回归模型来拟合2020年1月20日至2020年2月10日COVID-2019日流行数据,目的是预测未来两天COVID-19的发病率与流行率,其结论表明未来两天的流行率趋于平缓,发病率出现下降趋势;Zixin Hu [8] 等人利用2020年1月11日至2月27日中国确诊病例建立模型,选择改进的堆叠自动编码器来预测累计确诊的趋势线,由此得出结论COVID-19的流行将在4月中旬结束;Albertine Weber [9] 等人使用SIR模型预测中国COVID-19的流行趋势,结果表明中国COVID-19成亚指数型增长;在 [10] 中,作者建立了一种COVID-19的死亡风险评估模型,他们的出的结论是在两种不同情况下死亡率分别是5.1%和8.4%,且两种不同情况下的传染率分别是2.1%和3.2%,结果表明COVID-19可能导致大规模传播;赵 [11] 等人通过建立一个数学模型来估计2020年1月上半月未报告的实际COVID-19病例数量,作者的出的结论是2020年1月1日至15日,未报告的实际确诊病例数469起,同时作者根据模型预测在2020年1月17日之后,确诊病例数将会增加两倍。
短期预测可以评估可能的流行趋势,以便于及时修改现有的防护措施 [12]。时间序列分是一种科学的定量预测方法,可以根据已有的时间序列数据预测未来的变化,被广泛应用在各个领域,包括预测医疗费用 [13]、预测住院人数 [14]、预测石油价格 [15] 等。此外,在以往的传染病研究中常用季节性自回归综合移动平均模型(SARIMA)来实时监测数据如肺结核 [16]、腮腺炎 [17]、和梅毒 [18] 等。Arul Earnest等人使用ARIMA模型预测新加坡某三级医院在SARS爆发期间的床位的占用情况,得出结论ARIMA(1,0,3)可以用来很好地描述和预测SARS爆发期间的床位占用情况,可以为医院相关领导指定决策提供可靠依据 [19]。相关分析指出指数平滑作为经典的时间序列分析模型,也被广泛应用于传染病研究中 [20]。
本文的以下章节内容安排如下:第二章详细介绍了本文预测所选用的方法包括整合移动平均自回归模型(ARIMA)、支持向量回归(SVR)、广义自回归条件异方差模型(GARCH)、指数平滑(ES)等。另外,在本文中用来评价模型性能的三个评价指标也在第二章中有详细介绍。在第三章,我们对所选数据进行实证分析,并对比实验结果。在文章结束的部分,对本文的研究结果进行总结,并提出ES-GARCH模型可以有更广泛的应用。
2. 方法
2.1. 整合移动平均自回归模型(ARIMA)
时间序列是指某一指标按照事件发生的先后顺序记录的一组数据。时间序列预测是一种科学的定量预测方法,是一种根据历史数据预测未来数据的分析方法。
整合移动平均自回归模型(ARIMA)是一种经典的分析时间序列数据的方法,也是一种常见的对时间序列进行预测的模型。常见的时间序列模型还有自回归模型(AP)、移动平均模型(MA)、自回归–滑动平均混合模型(ARMA)。
ARIMA模型具有如下结构:
(2.1)
2.2. 支持向量回归(SVR)
支持向量回归(SVR)是支持向量机的一个重要分支,所寻求的是所有样本点到平面的总距离最小。其核心思想是通过非线性变换
将输入向量映射到一个高维空间H中,然后在高维空间中进行线性回归,公式如下:
(2.2)
其中
为特征向量空键,
为权重系数,b为截距。SVR拟合回归问题可以表示为目标函数优化问题,遵循结够风险最小化原则,其目标函数公式(2.3)所示:
(2.3)
SVR的实际上是求解凸二次规划问题,因此可以转化为公式(2.4):
(2.4)
其中
和
是松弛变量,C是惩罚系数,
是不敏感损失函数。引入拉格朗日乘子,最终得到SVR模型,如公式(2.5)所示:
(2.5)
其中,
为核函数,
与
均为拉格朗日乘子。
2.3. 广义自回归条件异方差模型(GARCH)
广义自回归条件异方差模型(GARCH)是由Bollersle (1986)在ARCH上发展起来的,是一个非常经典的时间序列拟合模型。ARCH模型的实质是使用残差平方序列的q阶移动平移拟合当期异方差函数值,由于移动平均模型具有自相关系数q阶截尾性,所以ARCH模型实际上只适用于异方差函数短期自相关系数。但是有些残差序列的异方差函数是具有长期自关性,使用ARCH模型来做拟合,将会产生很高的移动平均阶数,增加参数估计的难度并影响拟合精度。为了解决这个问题,提出了广义自回归条件异方差模型,即GARCH(p, q)模型:
(2.6)
当
时,GARCH(p, q)模型就是ARCH模型。
2.4. 指数平滑
指数平滑由布朗(Robert G. Brown)提出的一种在移动平均法的基础上发展而来的时间序列分析方法,配合以时间序列预测模型对未来的现象做出预测,通过加权平均法,对当前时段的观测值和预测值赋予不同的权重,从而得到下一时段的预测值,公式如下:
(2.7)
a表示平滑系数;
:
期的预测值,即本期(t期)的平滑值;
是t期的实际值;
:t期的预测值,即上期的平滑值。
指数平滑模型又根据时间序列是否存在长期趋势和季节效应分为简单指数平滑、Holt两参数指数平滑、Holt-Winters三参数数指数平滑,综合应用整体均值、整体趋势以及季节性进行预测,通过不同参数值的组合进行拟合。
3. 实证分析
3.1. 数据描述
本节使用的数据集是关于湖北省COVID-19的累计死亡人数和累计确诊人数的数据集。我们在中华人民共和国国家卫生健康委员会上获取2020年1月23日至2020年3月28日的相关数据。其中2020年1月23日到2020年3月21日的数据用来训练模型,其余数据用来验证模型精度,如图1所示。由图1中我们可以看出在疫情初期累计确诊病例和累计死亡人数增长迅速,经过一段时间增长缓慢趋于平稳。
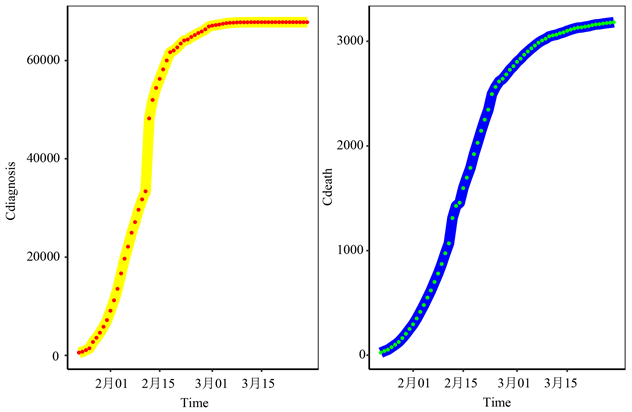
Figure 1. Time series of cumulative number of confirmed cases and cumulative number of deaths of COVID-19 in Hubei Province
图1. 湖北省累计确诊病例数和累计死亡病例数的时间序列
为了证明所提出的方法的可行性和适用性,我们选取意大利的累计确诊病例和累计死亡人数据用来评估模型的性能。关于意大利COVID-19的数据集从WHO网址上获得。数据包含2020年2月23日到2020年3月28日的每日数据,其中2020年2月23日到2020年3月21日的日数据用来拟合模型,其余数据为验证数据,如图2所示。
3.2. ES-GARCH模型预测湖北省疫情趋势
本部分以湖北省2020年1月23日至2020年3月21日的数据为训练集,建立数学模型模型。模型以2020年3月22日至2020年3月28日的日数据为验证集,验证了模型的准确性模型,目的是确定最优模型,预测湖北省累计死亡人数和累计确诊病例数省。本文的研究思路如图3所示。从表1和表2可以看出,ES-GARCH模型的模型性能与其他六个模型进行了比较。结果表明,ES-GARCH模型的性能优于其他模型。
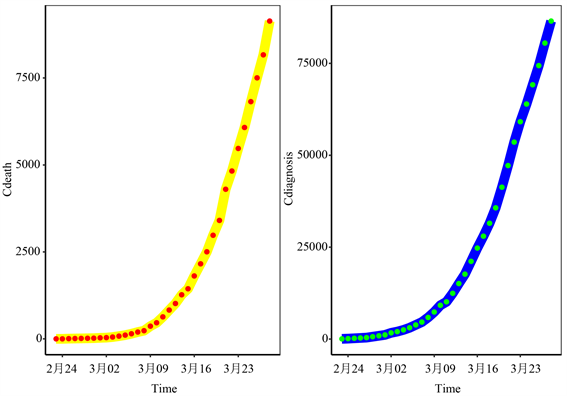
Figure 2. Time series of cumulative number of confirmed cases and cumulative number of deaths of COVID-19 in Italy
图2. 意大利COVID-19累计确诊病例数和累计死亡人数的时间序列
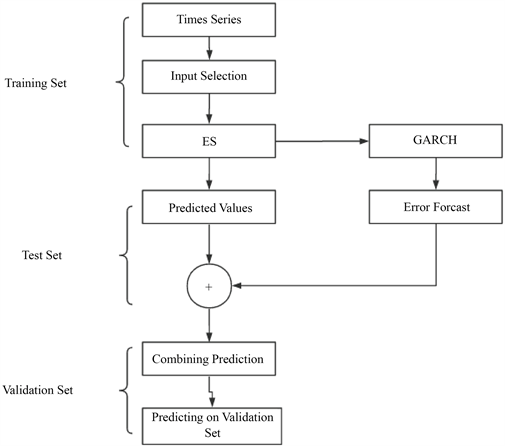
Figure 3. The process of predicting confirmed cases and death toll using the ES-GARCH hybrid model
图3. 使用ES-GARCH混合模型预测确诊病例和死亡人数的过程

Table 1. Performance evaluation of the model using the cumulative number of confirmed cases data set in Hubei province
表1. 利用湖北省累计确诊病例数据集对模型进行性能评价

Table 2. Performance evaluation of the model using the cumulative number of confirmed deaths data set in Hubei province
表2. 利用湖北省累计确认死亡数据对模型进行性能评价
使用ES-GARCH模型可用于预测未来7天湖北省确诊病例和死亡病例。图4、图5直观地显示了模型拟合数据的结果,以及未来几天疫情的变化趋势。我们可以直观地看到,未来几天湖北疫情趋于平稳,累计确诊病例数和累计死亡人数达到高峰。
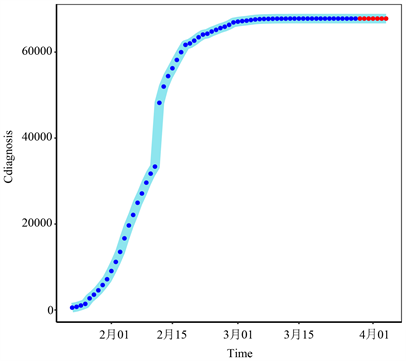 注:蓝点表示2020年1月23日至2020年3月28日的真实值,红点表示2020年3月29日至2020年4月4日的预测值。
注:蓝点表示2020年1月23日至2020年3月28日的真实值,红点表示2020年3月29日至2020年4月4日的预测值。
Figure 4. The cumulative number of confirmed cases in Hubei
图4. 湖北省累计确诊病例总数
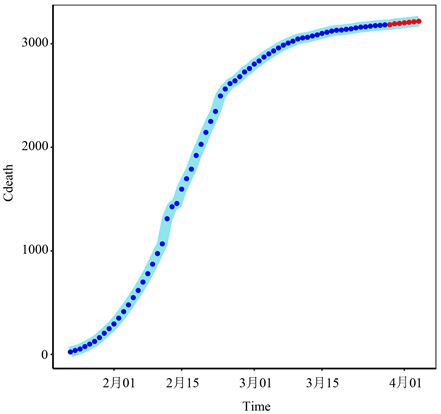 注:蓝点表示2020年1月23日至2020年3月28日的真实值,红点表示2020年3月29日至2020年4月4日的预测值。
注:蓝点表示2020年1月23日至2020年3月28日的真实值,红点表示2020年3月29日至2020年4月4日的预测值。
Figure 5. Total death toll in Hubei Province
图5. 湖北省累计死亡总人数
表3显示了使用ES-GARCH模型预测的2020年3月29日至2020年4月4日湖北省累计确诊病例数和累计死亡数。湖北省疫情已达高峰,此后确诊病例数和累计死亡数趋于平稳。由此可见,湖北省采取的防疫措施对控制疫情发展起到了积极作用,感染者得到了有效救治。

Table 3. The ES-GARCH model was used to predict confirmed cases and cumulative deaths of COVID-19
表3. 使用ES-GARCH模型预测新冠肺炎确诊病例和累计死亡病例
3.3. ES-GARCH模型预测意大利疫情趋势
在本节中,我们将使用来自意大利的COVID-19数据来验证我们使用的7个模型的性能。表4和表5显示了意大利用于评估每个模型预测累积确诊病例和累积死亡人数的准确性的三个评估指标。我们可以直观地看到,在所有的模型中,只有ES-GARCH模型使三个评价指标最低,即ES-GARCH模型的性能最好。这一结论与上一节的结论是一致的。ES-GARCH模型的预测精度最高。

Table 4. Performance evaluation of the model using the cumulative number of confirmed cases data set in Italy.
表4. 利用意大利累计确诊病例数据集对模型进行绩效评价

Table 5. Performance evaluation of the model using the cumulative number of confirmed deaths data set in Italy
表5. 利用意大利的累计确认死亡数据对模型进行性能评价
图6和图7分别为2020年3月29日至4月4日意大利累计确诊病例和累计死亡病例的趋势,采用ES-GARCH模型。由图6可知,意大利确诊病例数在未来7天内将快速增加。死亡人数证实,这种疾病的迅速蔓延给意大利的卫生系统带来了新的挑战。
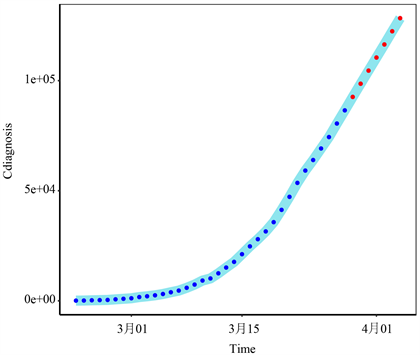 注:蓝点表示2020年2月23日至2020年3月28日的真实值,红点表示2020年3月29日至2020年4月4日的预测值。
注:蓝点表示2020年2月23日至2020年3月28日的真实值,红点表示2020年3月29日至2020年4月4日的预测值。
Figure 6. The total number of confirmed cases in Italy
图6. 意大利累计确诊病例总数
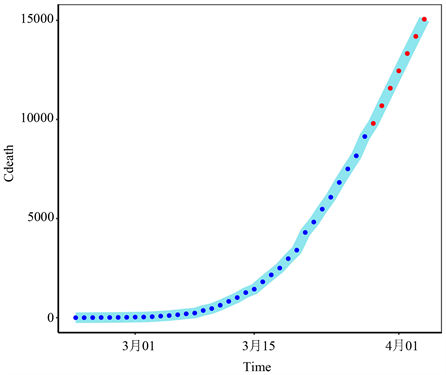 注:蓝点表示2020年2月23日至2020年3月28日的真实值,红点表示2020年3月29日至2020年4月4日的预测值。
注:蓝点表示2020年2月23日至2020年3月28日的真实值,红点表示2020年3月29日至2020年4月4日的预测值。
Figure 7. The cumulative number of confirmed deaths in Italy
图7. 意大利确认的累计死亡总数
4. 结论
新型冠状病毒的爆发严重影响了人们的正常生活,对人民的身体健康造成了极大的伤害。因此,针对疫情发展趋势,采取有效的防护措施是至关重要的。利用本文所提出ES-GARCH模型可以作为一种预测COVID-19的预测方法,为制定决策提供可靠依据。ES-GARCH模型对未来七天内确诊病例数和累计死亡数具有较高的预测能力。同时RMSE、MAE、MAPE等评价指标也为我们确定最优模型提供有力的依据。利用意大利确诊病例和累计死亡数据对该模型进行了验证,评价结果表明该方法具有良好的效果。
从本文研究中可以得到结论,使用ES-GARCH模型预测结果较为准确。结合预测结果我们发现,湖北省的确诊病例和死亡人数达到了一个相对平稳的趋势。综合此模型的各项评价指标,可以得出结论,该模型可以很好拟合短期数据,并可以实现相对精准的短期预测。ES-GARCH模型可以为决策者供了一个有力的预测工具,根据历史数据以及未来疫情的发展趋势,可以做到及时防护和采取相应措施。
NOTES
*通讯作者。