1. 引言
蔷薇科蔷薇属的蔷薇(Rosa sp.)、玫瑰(Rosa rugasa)、月季(Rosa chinensis)及其杂交种,因具有较高的食用、药用、日化价值统称为食用玫瑰(edible roses),在世界各地广泛种植,市场潜力巨大 [1] [2] [3] [4]。墨红是月季中的食用品种,在云南、贵州等地大量种植,花深红色、大、丝绒质感、浓香,花期4~12月,产量高,多花、勤花、耐开,是玫瑰鲜花饼、玫瑰花茶、玫瑰花酱和玫瑰精油等产品的原料 [2]。食用玫瑰均属多年生植物,伴随产业及种植规模的扩大,种植年限的增加,病害的发生渐趋加重,发病率逐年上升 [5] [6] [7] [8]。目前在食用玫瑰上报道的病害中,由蔷薇盘二孢(Marssinina rosae)引起的黑斑病是最为严重的叶部病害,可在叶片上形成不规则黑斑,引起叶片枯黄脱落,严重时造成枝干光杆状并全株死亡,发病率高,破坏性强,该病害在栽培当年即可发病,严重影响花的产量和质量,是制约食用玫瑰产业发展的主要病害 [3] [4]。此外,还有报道食用玫瑰的白粉病、锈病、灰霉病、枝枯病等病害 [4] [8] [9] [10] [11] [12]。国内外关于食用玫瑰的研究主要集中于种质资源、栽培管理、化学营养成分、产品研发等内容,对病害的研究也主要集中于化学防治方面,对引起病害的病原菌研究及其生物防治等内容报道极少 [2] [4] [8] [10] [11] [13] [14] [15]。鉴于墨红月季的食用要求,采用对食用安全和环境友好的生物防治手段防治病害更为有益 [16]。芽胞杆菌在自然环境中广泛存在,不仅存在于土壤、植物的根际和体表,同时也是植物体内常见的内生细菌 [17] [18]。芽胞杆菌能够产生抗逆的芽胞,并且生防机制多样化,如抗生作用、诱导抗病性、空间营养竞争等 [17] [18]。使用芽胞杆菌进行植物病害的防治是目前生物防治研究的热点领域之一 [16] [17] [18]。
本研究在贵州省植物园(26˚37'N, 106˚43'E)和黔南州惠水县(26˚11'N, 106˚40'E)的墨红月季上发现疑似黑斑病和炭疽病的2种叶斑病病害叶片,疑似黑斑病病害发生非常严重(发病率40%~100%),疑似炭疽病病害发生较轻(发病率3%~5%)。但迄今为止,有关墨红月季黑斑病的病原学和生物防治情况报道极少,炭疽病的内容更未见报道。因此本研究对收集到的墨红月季2种叶斑病病原进行分离和致病性测定,依据病原菌形态学,结合ITS、GADPH、ACT、CHS-1等多基因序列构建系统发育树对比分析,确定病原菌种类;收集发病严重地块的健康叶片,筛选叶际有益芽胞杆菌,依据形态学、生理生化特征及16S rRNA、gyrA等多基因序列构建系统发育树,确定有益菌种类;通过室内和田间测定有益菌株、生物药剂及化学杀菌剂对病害的防治情况,以期为食用月季叶部病害的识别和生物、化学防治提供科学依据。
2. 材料与方法
2.1. 材料
1) 供试病样2019年9月在贵阳市植物园(26˚37'N, 106˚43'E)和贵州省黔南布依族苗族自治州惠水县好花红镇月季基地(26˚11'N, 106˚40'E),采集具有黑斑病和炭疽病典型症状的墨红月季叶片,带回实验室。
2) 供试药剂64%杀毒矾(8%噁霜灵 + 56%代森锰锌) WP (先正达(苏州)作物保护有限公司);12%腈菌·三唑酮(2%腈菌唑 + 10%三唑酮) EC (山东玥鸣生物科技有限公司);65%代森锌(成都科利隆生化有限公司) WP;200亿/g内生芽孢杆菌(绿康威,中农绿康(北京)生物技术有限公司)。
3) 培养基PDA和LB培养基分别用于真菌和芽胞杆菌的培养 [19]。
2.2. 方法
1) 病原菌分离:采用单孢分离法 [20] [21],在病叶病健交界处切取5 mm × 5 mm 的病斑,经表面消毒(70%酒精30 s,3% NaOCl 2 min)和无菌水冲洗后,置于消毒的钵体中,加入1 mL无菌水,轻轻研磨病叶使其释放分生孢子,得到含有分生孢子悬浮液,并将其稀释后涂布至1%的水琼脂平板培养,待在光学显微镜下观察萌发的单个孢子,将含有该孢子的琼脂块切下转移到PDA平板上,于25℃纯化培养7~45 d后观察菌落、繁殖体等情况。从具有黑斑病典型症状的墨红月季叶片共获得4株分别标记为YJHB1100,YJHB1103,YJHB1106和YJHB1109,从具有炭疽病的墨红月季叶片共获得3个菌株分别标记为GZUMH01、GZUMH02和GZUMH03,选取代表性菌株YJHB1109和GZUMH01用于后续试验,所有菌株均保存于贵州大学农学院植物病理学实验室。
2) 病原菌形态学观察:将分离到的菌株接种于PDA [19] 平板上,25℃恒温培养7~45 d后,观察记录菌落形态、分生孢子形态及产孢结构,每个菌株随机选取50个分生孢子进行测量。再取孢子悬浮液滴于疏水玻片上,28℃保湿培养,24 h后观察并记录附着孢的形态。
3) 致病性测定:采用刺伤接种法 [19] 进行致病性测定。将纯化的菌株接种于PDA平板上,于25℃培养7~10 d,采用无菌水悬浮分生孢子并用血球计数板定量至1 × 106孢子/mL备用。取1年生健康墨红月季植株,用无菌接种针在叶片表面进行刺伤,向叶片喷洒孢子悬浮液,每株喷施50 mL,以喷洒无菌水的叶片作为空白对照,每个处理取5株苗,每个处理重复3次,保湿、观察并记录发病情况。待接种叶片发病后,再进行分离纯化培养病原菌,完成科赫氏法则验证。
4) 病原菌分子鉴定:采用Biomiga真菌DNA提取试剂盒提取供试菌株DNA,选择ITS、GADPH、ACT、CHS-1基因引物(表1)进行PCR扩增 [22] [23] [24] [25]。扩增产物用1.2%的琼脂糖凝胶进行电泳检验,后将PCR产物送生工生物工程(上海)股份有限公司进行测序。测序结果于NCBI数据库进行BLAST比对分析,并利用CLUSTAL X软件进行多序列比对和系统进化分析软件MEGA6中的最大似然法构建系统发育树(表2,表3) [22] [24]。

Table 1. Primers required in this experiment
表1. 实验所需要的引物

Table 2. The gene sequences used in phylogenetic tree of the rose black spot
表2. 月季黑斑病构建系统发育树的基因序列

Table 3. The gene sequences used in phylogenetic tree of anthracnose of the rose
表3. 月季炭疽病构建系统发育树的基因序列
5) 叶际芽胞杆菌的分离 采用稀释平板法 [19]。取每份健康叶片1 g放入含9 mL无菌水的灭菌研钵中研磨,然后均匀稀释至10−3的浓度,并将10−2和10−3的稀释液进行水浴(85℃, 30 min)以杀死绝大部分非芽胞细菌。取100 μL的稀释液涂在LB板,每浓度涂平板4个重复,于37℃恒温培养箱过夜培养。挑取不同的单菌落,纯化菌株并保存于−80℃冰箱。
6) 生防芽胞杆菌的筛选 在室内通过平板对峙法 [19] 筛选拮抗炭疽病菌效果明显的生防芽胞杆菌,通过初筛和复筛观察是否产生抑菌圈,利用十字交叉法 [19] 测量其抑菌直径,计算抑菌率。使用Excel和DPS软件进行数据统计分析,选择其中1株效果最好的菌株用于后续生测试验。
抑菌率(%) = [(对照组菌落直径 − 处理组菌落直径)/处理组菌落直径] × 100%。
7) 生防芽胞杆菌形态观察和生理生化特性检测:将分离到的菌株于37℃、200 rpm过夜摇培,离心收集菌体,用无菌水清洗3次,再用无菌水重悬并稀释至浓度108 CFU/mL,在LB平板上滴加5 μL菌液,37℃恒温培养12 h后,观察记录菌落特征。根据《常见细菌系统鉴定手册》 [26],对菌株的生理生化特性进行测定。
8) 生防芽胞杆菌分子鉴定:采用Biomiga细菌基因组DNA提取试剂盒提取生防芽胞杆菌的基因组DNA,再用16S rRNA和gyrA引物 [27] [28] 对菌株的基因组进行扩增。PCR产物验证正确后送上海生工进行PCR产物测序。测序结果分析及构建系统发育树方法同上(表4)。

Table 4. The gene sequences used in phylogenetic tree of Bacillus sp.
表4. 芽胞杆菌病构建系统发育树的基因序列
9) 室内杀菌剂敏感性测定:单剂毒力测定:采用菌丝生长速率法 [19],取直径5 mm的病原菌菌饼置于含不同药剂浓度(见表5)的PDA平板中央,以不添加药剂的PDA平板作对照。每个处理3次重复,25℃培养7 d,采用十字交叉法 [19] 量取菌落直径,计算抑菌率。混剂毒力测定:选择两种抑菌效果好的药剂,以不同的体积比进行复配,计算各组配比的毒效比和共毒系数 [7]。

Table 5. Nine fungicides used in the experiment
表5. 实验中使用的9种杀菌剂
10) 田间小区试验:于2020年7~10月贵州省黔南布依族苗族自治州惠水县好花红镇月季基地(26˚11'N, 106˚40'E),选用一年生墨红月季进行田间小区试验。试验共设4个处理(其中药剂处理采用当地田间常用药剂),1个清水对照。处理1:64%杀毒矾(8%噁霜灵 + 56%代森锰锌) WP (先正达(苏州)作物保护有限公司) 600倍液;处理2:12%腈菌·三唑酮(2%腈菌唑 + 10%三唑酮) EC (山东玥鸣生物科技有限公司) 5000倍液 + 65%代森锌(成都科利隆生化有限公司) WP 2000倍液;处理3:商品化生防制剂(绿康威,中农绿康(北京)生物技术有限公司) 200亿/g 50倍液;处理4:芽胞杆菌(B. amyloliquefaciens GUHS97) 108 CFU/mL。每处理3次重复,共12个小区,每小区60株。第1次在修剪后喷施,确保叶片正面和背面都喷施到,之后每隔7~10天再处理1次,共施用3次。田间观察到空白对照发病后进行调查,以株为单位分级,在晴天中午以后调查。计算病害的发病率和病情指数,使用Excel和DPS软件进行数据统计分析。
月季叶斑病病害严重度分级:0级:全株未感病;1级:病斑面积占整片叶面积1/10以下;2级:病斑面积占整片叶面积的1/10~1/4;3级:病斑面积占整片叶面积的1/4~1/2;4级:病斑面积占整片叶面积的1/2~3/4;5级:病斑面积占整片叶面积的3/4以上,病叶脱落严重,植株死亡。
;
;
。
3. 结果与分析
3.1. 病害症状
黑斑病主要危害墨红月季的叶片,发病部位初期为褐色小斑点,外圈有黄晕,外缘交界明显;后期病斑扩展为黑褐色、近圆形或不规则形,病斑上散生黑色小点,边缘呈放射状,严重时病斑连接成片,导致叶片大量脱落,植株死亡(图1(A)~(C))。
炭疽病主要危害墨红月季的叶片,发病部位褐色斑点,外缘交界明显,病斑中心灰白色,有深褐色小点,随后病斑扩展为近圆形或不规则形(图2(A))。
3.2. 病原菌形态学鉴定
黑斑病病原菌YJHB1109形态如图1(D)~(J)所示,在PDA培养基上28℃光照培养25 d,菌落直径约1.0 cm,生长非常慢,气生菌丝白色薄绒状,菌落生长后期呈深灰色;分生孢子盘呈分枝状,上着生大量分生孢子;分生孢子纺锤型,双胞,隔膜缢缩不明显,大小为13.9~29.0 μm × 4.9~13.8 μm。根据以上形态学特征,初步鉴定黑斑病的病原菌为蔷薇盘二孢(Marssonina rosae) [1] [23]。
炭疽病病原菌GZUMH01形态如图2(C)~(F)所示,菌落呈灰色薄绒状,后期菌落中产生深棕色近圆形的产孢结构;分生孢子数量丰富,近椭圆形,无分隔,大小约13.7~18.8 μm × 4.3~6.8 µm;分生孢子萌发可形成附着孢。根据以上形态学特征,结合初步鉴定炭疽病的病原菌为炭疽菌(Colletotrichum sp.) [22] [24]。

Figure 1. Symptoms of black spots on Rosa chinensis and morphological characteristics of the pathogen YJHB1109. (A)~(C): Naturally occurring leaf spots on Rosa chinensis; (D): Conidiophores and conidia; (E): Conidia; (F): Conidiomata; (G), (H): Colonies on PDA above and below after 25 days; (I), (J): Colonies on PDA above and below after 45 days. Scale bars: (D) − (E) = 10 µm
图1. 月季黑斑症状及病原菌YJHB1109形态特征。(A)~(C):月季黑斑症状;(D):分生孢子梗和分生孢子;(F):分生孢子;(G),(H):菌落在25天后PDA正反面;(I),(J):菌落在45天后PDA正反面。比例尺:(D) − (E) = 10 µm
3.3. 病原菌分子生物学鉴定
鉴定:基于供试菌株的ITS基因序列构建系统发育树。菌株YJHB1109 ITS基因序列已提交GenBank数据库,序列号见表2。如图3所示,供试菌株YJHB1109与菌株M. rosae RM071209004和CFCC 6814聚集于一支,且支持率达100%,能与其它种明显区分开。因此,结合菌株形态学特征,将病原菌鉴定为蔷薇盘二孢M. rosae。

Figure 2. Symptoms of anthracnose of the rose, morphological characteristics of the pathogen GZUMH01 and experiment on pathogenicity. (A): Leaf spots on Rosa chinensis; (B): Conidiomata; (C), (D): Colonies on PDA above and below; (E): Conidia; (F): Appressoria and conidia; (G), (H): Pathogenicity test. Scale bars: (D) − (E) = 10 µm
图2. 月季炭疽病症状、病原菌GZUMH01形态特征及致病性实验。(A):月季炭疽病症状;(B):分生孢子体;(C),(D):菌落在PDA上的正反面;(E):分生孢子;(F):附着孢和分生孢子;(G),(H):致病性试验。比例尺:(D) − (E) = 10 µm
炭疽病病原菌鉴定:基于供试菌株的ITS、GADPH、CHS-1和ACT基因序列构建多基因联合系统发育树。菌株GZUMH01 ITS、GADPH、CHS-1和ACT基因序列已提交GenBank数据库,序列号见表3。如图4所示,供试菌株GZUMH01与菌株C. boninense CBS 112115聚集于一支,且支持率达100%,能与其它种明显区分开。因此,结合菌株形态学特征,将病原菌鉴定为博宁炭疽菌C. boninense。
3.4. 生防芽胞杆菌的筛选
从贵州省贵阳市墨红月季种植地块采集健康植株叶片,分离得到137株芽胞杆菌,用于进一步筛选对黑斑病菌和炭疽病菌拮抗效果优秀的菌株,因黑斑病菌生长速度极慢,本研究在室内只进行炭疽病菌的拮抗筛选。通过平板对峙法筛选拮抗炭疽病菌效果明显的生防芽胞杆菌,得到5株抑菌能力最强的菌株,如图5和表6所示,对炭疽病菌的抑制率均为70.27%以上,其中菌株GUHS97对C. boninense的拮抗效果最好,将其作为后续实验研究菌株。
菌株GUHS97的生理生化特性见表7,菌株GUHS97为G+,杆状,能够利用鼠李糖和甘露醇,产生过氧化氢酶、硝酸还原酶和亚硝酸还原酶,V-P反应阳性,甲基红染色阳性等。通过对16S rRNA和gyrA基因序列BLAST分析后,选取模式菌株作为参比菌株,构建了菌株GUHS97的系统发育树。菌株GUHS97 16S rRNA与gyrA基因序列已提交GenBank数据库,序列号见表4。如图6所示,菌株GUHS97同解淀粉芽胞杆菌(B. amyloliquefaciens) WF02聚到一支,且支持率达100%,能与其它种明显区分开。综合形态学、生理生化特征和分子生物学分析,将菌株GUHS97鉴定为解淀粉芽胞杆菌(B. amyloliquefaciens)。
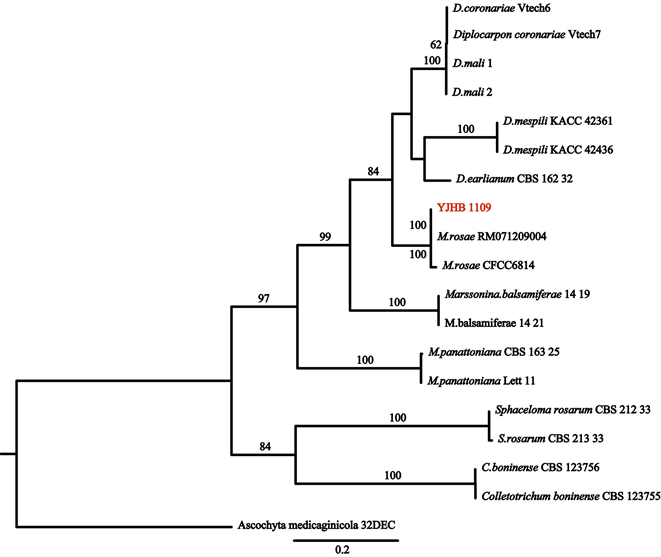
Figure 3. Phylogenetic tree constructed from ITS gene sequences of strain YHJB1109
图3. 菌株YHJB1109基于ITS基因的系统发育树
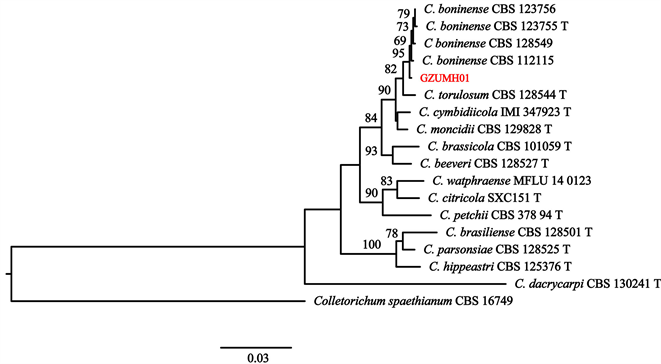
Figure 4. Phylogenetic tree constructed from ITS、GADPH、CHS-1 and ACT gene sequences of strain GZUMH01
图4. 菌株GZUMH01基于ITS,GADPH,CHS-1和ACT基因的系统发育树
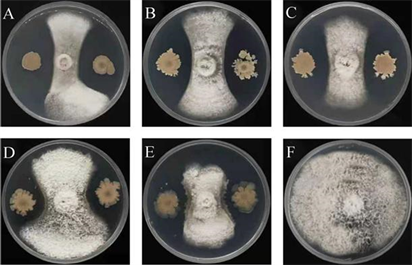
Figure 5. Antagonistic effect of Bacillus strains against C. boninense in experiment. Note: (A)~(E): strain GUHS97, GUHS113, GUHS120, GUHS117 and GUHS5; (F): CK (C. boninense)
表5. 芽孢杆菌对月季炭疽病的拮抗效果。注:((A)~(E):菌株 GUHS97、 GUHS113、GUHS120、GUHS117 和 GUHS5;(F):CK (月季炭疽病原菌)

Table 6. Antagonistic activity of Bacillus strains against C. boninense in experiment
表6. 芽孢杆菌对月季炭疽病的拮抗活性实验
Note: The data are means ± SDs. The different lowercase letters in the same column indicate significant differences at the P < 0.05, respectively, using Duncan’s new multiple range test.

Table 7. Physiological and biochemical characteristics experiment of strain GUHS97
表7. 菌株GUHS97的生理生化特性实验
Note: “+” is positive, “−” is negative.
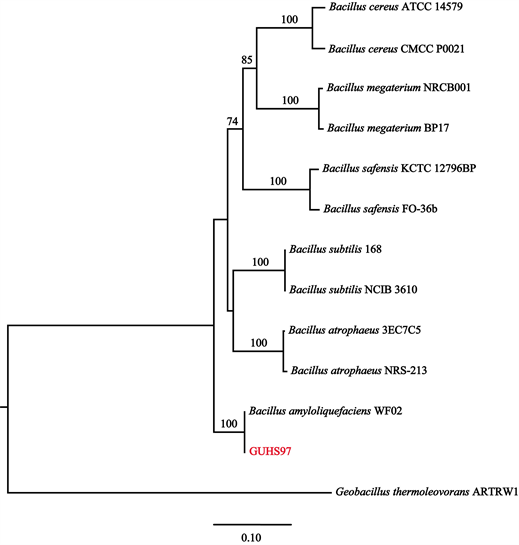
Figure 6. Phylogenetic tree constructed from 16S rRNA and gyrA gene sequences of strain GUHS97
图6. 菌株YHJB1109基于16S rRNA和gyrA基因的系统发育树
3.5. 室内杀菌剂敏感性测定
因黑斑病菌生长速度极慢,本研究在室内只进行炭疽病菌的杀菌剂敏感性测定。试验结果表明,供试的9种杀菌剂对月季炭疽病菌(C. boninense)均有不同程度的抑制作用,其中,3%中生菌素WP、10%苯醚甲环唑WDG、25%吡唑醚菌酯SC和10%精甲·咯菌腈SC抑制效果最好,EC50值分别为0.8440 mg∙L−1、1.3854 mg∙L−1、1.8667 mg∙L−1和3.5945 mg∙L−1;其次为8%宁南霉素AS和25%溴菌腈EC,EC50值分别为18.9624 mg∙L−1和25.4813 mg∙L−1 (见图7、表8)。由于25%吡唑醚菌酯SC和25%溴菌腈EC对炭疽菌抑制效果较好,且两种药剂作用机制不同,由表9可见,将这两种药剂以不同比例进行复配,其毒效比大于1,说明两种药剂混配有一定的增效或者相加作用。当25%吡唑醚菌酯SC和25%溴菌腈EC配比组合为1:7、1:8、和1:10时,由表10可见,EC50均比较小,且明显小于单剂的EC50,说明以这3种配比组合进行混配对月季炭疽病菌具有更强的抑制作用,3种配比组合的共毒系数分别为218.0606、217.9975和248.7639,表现出明显的增效作用,其中1:7效果最佳(见图8、表9、表10)。
3.6. 田间小区试验
对月季叶斑病的田间小区试验表明,GUHS97处理后相对防效为59.12%,和商品化微生物制剂绿康威的63.89%效果相当,明显高于实际生产中常用的12%腈菌·三唑酮EC + 65%代森锌WP的30.09%和64%杀毒矾WP的19.88%,防治效果良好(见表11)。

Figure 7. Indoor toxicity test of pyraclostrobin and bromothalonil to Colletotrichum boninense
图7. 吡唑醚菌酯和溴菌腈对月季炭疽病菌的室内毒性试验

Figure 8. Co-toxicity of the mixed pyraclostrobin and bromothalonil to Colletotrichum boninense
图8. 吡唑醚菌酯和溴菌腈对月季疽炭疽病菌的共毒性比图

Table 8. Indoor toxicity test of nine fungicides to Colletotrichum boninense
表8. 9种杀菌剂对月季炭疽病菌的室内毒性试验

Table 9. Toxicity ratio of pyraclostrobin and bromothalonil atdifferent mixture ratio to Colletotrichum boninense
表9. 吡唑醚菌酯和溴菌晴对月季疽炭疽病菌的毒性比
Note: VA:VB represents the volume ratio of pyraclostrobin and bromothalonil.

Table 10. Co-toxicity of the mixed pyraclostrobin and bromothalonil to Colletotrichum boninense
表10. 吡唑醚菌酯和溴菌晴对月季疽炭疽病菌的共毒性比
Note: VA:VB represents the volume ratio of pyraclostrobin and bromothalonil.

Table 11. Control efficacy against edible roses leaf spot in the field
表11. 田间对食用玫瑰叶斑病的防治效果
Note: The data are means ± SDs. The different lowercase and uppercase letters in the same column indicate significant differences at the P < 0.05 and P < 0.1 levels, respectively, using Duncan’s new multiple range test.
4. 讨论
叶斑病是食用玫瑰叶部主要真菌病害之一,其病原种类较为少。研究表明Sphaerotheca pannosa、Pestalotiopsis clavispora、Phytophthora nagaii、Botrytis cinerea [29] [30] [31] [32] 等真菌可引起食用玫瑰的叶斑病。炭疽菌属由几种重要的植物病原真菌组成,具有致病性,可感染多种木本和草本植物,主要发生在热带和亚热带地区,有广泛的寄主植物 [33] [34]。而M. rosae生长极为缓慢,分离纯化比较困难,因此研究报道较少。本研究在贵州省植物园和黔南州惠水县的墨红月季上发现黑斑病和炭疽病的2种叶斑病病害,通过对病原菌进行分离和致病性测定,依据形态学结合ITS、GADPH、ACT、CHS-1等多基因序列分析,确定黑斑病病原菌为蔷薇盘二孢(M. rosae),首次报道了炭疽病病原菌博宁炭疽菌(C. boninense)。月季炭疽病我国发生极少,在贵州为首次报道,云南也有少量发生,但发生程度均不高,目前对田间生产危害不大,本研究首次报道了引起贵州月季炭疽病的病原菌为C. boninense GZUMH01,为今后墨红月季的栽培防治提供理论依据。
目前,人们对有机和无机蔬菜的要求越来越高,以及对可持续杀菌剂的使用控制,旨在降低环境和人类健康风险,因此需要生态友好的替代品。在过去的几十年里,科学家们做出了许多努力来寻找替代工具,特别关注拮抗微生物,如芽孢杆菌属 [35] [36] [37],作为潜在的生物防治剂。苑宝洁等研究发现解淀粉芽胞杆菌ZF57微粉剂对黄瓜棒孢叶斑病的田间治效可达97% [38]。张荣胜等通过田间试验研究表明,解淀粉芽胞杆菌Jt84对水稻稻曲病防治效果高达78%以上 [39]。因M. rosae生长速度极慢,无法用于在室内筛选有益芽胞杆菌,因此本研究采用月季炭疽病C. boninense进行生防芽胞杆菌的筛选。本研究筛选到1株叶际有益芽胞杆菌GUHS97,依据形态学、生理生化特征及16S rRNA、gyrA等多基因序列分析,鉴定该菌为解淀粉芽胞杆菌(B. amyloliquefaciens)。通过田间小区试验表明,GUHS97对叶斑病的相对防效为59.12%,绿康威为63.89%,GUHS97和绿康威的相对防效无显著性差异,防效相当;腈菌·三唑酮与代森锌和杀毒矾对叶斑病的相对防效为30.09%和19.88%,GUHS97防病效果良好且明显优于化学药剂。采用芽胞杆菌用于防治病害已有大量研究,其发酵及生产工艺已有很多成熟的经验,GUHS97具备良好的应用开发潜力 [23],以上结果为食用月季病害的生物防治提供效果良好的田间防治措施。
目前,对月季叶斑病的防治以化学药剂防治为主,但防治效果并不理想。因此,本研究收集生产上常用的化学和生物药剂,通过室内药剂筛选发现,3%中生菌素WP、10%苯醚甲环唑WDG、25%吡唑醚菌酯SC和10%精甲·咯菌腈SC抑制效果最好,EC50值分别为0.8440 mg∙L−1、1.3854 mg∙L−1、1.8667 mg∙L−1和3.5945 mg∙L−1,其次为8%宁南霉素AS和25%溴菌腈EC,EC50值分别为18.9624 mg∙L−1和25.4813 mg∙L−1;将25%吡唑醚菌酯SC和25%溴菌腈EC以1:7、1:8、和1:10比例复配,对月季炭疽病菌具有更强的抑制作用,表现出明显的增效作用。生产中常用吡唑醚菌酯防治炭疽病病害,吡唑醚菌酯属于呼吸抑制剂,作用靶标单一,极易产生抗药性,吡唑醚菌酯可通过复配有效降低病菌对其产生抗药性。而溴菌腈为一种低毒、广谱的新颖化合物类杀菌剂,能够与病原微生物细胞中的亲核基团紧密结合,导致细胞代谢紊乱 [40]。因此,本研究选用吡唑醚菌酯与溴菌腈进行复配,降低吡唑醚菌酯的使用浓度,有利于避免病原菌对该药产生抗药性。
以上研究结果为食用月季叶部病害的识别和生物、化学防治提供科学依据。
5. 结论
本研究通过分离纯化、致病性测定、形态学鉴定及多基因序列联合构建系统发育树等技术手段,将贵州省植物园和黔南州惠水县的墨红月季上叶斑病的病原菌分别鉴定为黑斑病病原菌为蔷薇盘二孢(M. rosae)和炭疽病病原菌博宁炭疽菌(C. boninense),并筛选到1株叶际有益解淀粉芽胞杆菌(Bacillus amyloliquefaciens) GUHS97,室内试验表明GUHS97对月季炭疽病菌的抑菌效果可达77.85%,田间小区实验表明,GUHS97对叶斑病的相对防效为59.12%,防病效果良好且明显优于化学药剂;同时可选用3%中生菌素WP、10%苯醚甲环唑WDG、25%吡唑醚菌酯SC、10%精甲·咯菌腈SC,或25%吡唑醚菌酯SC和25%溴菌腈EC复配,进一步开展田间防治试验。
基金项目
中国博士后科学基金面上项目(2020M683658XB);贵州省教育厅青年科技人才成长项目(黔教合KY字[2018]101);贵州省科技计划项目(黔科合服企[2019] 4016);国家重点研发计划项目(2017YFD0201605)。
NOTES
*通讯作者。