1. 引言
植物组织内的许多物质由于含有荧光基团,因此受激发以后会有各种自发荧光的现象。冯倩倩等人利用激光扫描共聚焦显微镜研究烟草叶片叶绿体自发荧光,为叶绿体的研究提供实验参考 [1],姜淑媛以茶树正常叶片与荧光性绿斑病叶为材料,应用荧光显微技术、显微荧光光谱成像等技术研究了茶树荧光性绿斑病叶组织中的黄、绿色自发荧光变化,为病叶内部游离钙离子的分布以及胞内pH等研究提供了便利 [2],乔飞等人以西瓜的花粉为材料,研究西瓜花粉也具有自发荧光现象 [3],周建涛等人采用激光共聚焦显微镜研究了外源钙调素(CaM)及其抗血清对“丰水”梨自交(不亲和)和异花(亲和)授粉后花柱自发荧光变化,证实了外源CaM及其抗血清对自花、异花授粉的生理代谢过程的影响 [4]。由于木质素、阿魏酸等细胞壁物质易发生蓝绿色荧光,通过观察木材木质部的自发荧光特性能够判断木材质量 [5]。从植物荧光探测入手,对植物生长信息与光电检测信号的关联性进行研究,能够快速精确检测植物生长信息的系统,为精细化农业生产提供更准确的植物信息数据 [6],叶绿素荧光成像是一种可以快速、无损评估植物光合作用的技术,已逐渐在植物环境胁迫研究中得到应用 [7],通过叶绿素荧光参数对水盐胁迫的响应机制有利于深入了解植物的抗旱耐盐机理 [8],梁艳丽等人发现水稻抗性越强,其荧光增强点的密度越大,荧光增强频率越高,侵染点荧光增强细胞数目越多,荧光点越大 [9],以上均是自发荧光的合理应用。
在进行科学研究时,常常利用红色或绿色荧光蛋白进行植物功能基因的组织细胞定位、表达水平等研究,如王春雷等人应用荧光标记探索植物花粉管构造及生长特性 [10],李思经探究用于活体植物细胞转化的荧光标记基因 [11],杨晓梅构建三种荧光蛋白质粒标记根瘤菌可有效的促进植株的生长和生物量的积累,并不影响根瘤菌的结瘤竞争能力和促进生长效应 [12]。荧光标记的研究与自发荧光特性是一对矛盾,克服了自发荧光干扰才能更好地观察到标记荧光。转基因研究中常以卡那霉素作为筛选试剂,其处理常导致组织白化 [13] [14],白化意味着叶绿素破坏,减少或消除红色自发荧光。卡那霉素处理能否导致油菜幼苗的白化值得探索。因此,本研究详细观察了油菜幼苗的自发荧光特点,并探索如何能够降低或克服这些自发荧光现象,为标记荧光的应用探索便利途径。
2. 材料与方法
2.1. 实验材料
本实验选择油菜品种早熟100作为实验材料,培养条件分别为正常光照(25℃ 12 h光照/20℃ 12 h黑暗)和黑暗(25℃ 12 h黑暗/20℃ 12 h黑暗)处理,常见基因定位材料为洋葱表皮,观察洋葱表皮作为的无荧光参考,便于确定无荧光现象的观察标准。
2.2. 油菜幼苗的正常培养和黑暗处理
实验以2层滤纸为发芽床,灭菌的玻璃培养皿为发芽容器,在培养皿内加入5 ml的无菌双蒸水,将种子均匀的铺在发芽床上,之后按照25℃ 12 h光照/20℃ 12 h黑暗和25℃ 12 h黑暗/20℃ 12 h黑暗的发芽条件进行幼苗培养,黑暗处理采用锡箔纸与黑色塑料布包裹遮光。当培养皿湿度不足时补充水分,每次补充5 ml。
2.3. 油菜幼苗的白化处理
按照上述培养条件,在不同培养皿内分别加入5 ml浓度梯度为0、100 μg/ml、150 μg/ml、200 μg/ml的卡那霉素溶液代替水,补水时补充与之相同浓度的卡那霉素溶液代替水,培养过程中观察,若油菜苗幼苗有白化现象则选取白化幼苗制备临时装片,观察蓝色、绿色、红色三种颜色的荧光。
2.4. 正常绿色幼苗的酶解去荧光处理
将在光照培养条件下生长良好的油菜幼苗,浸泡在含有果胶酶(5%)、纤维素酶(5%)的0.1 mol/L的PBS溶液中浸泡组织,24 h后观察三种颜色的荧光现象。
2.5. 油菜自发荧光图像观察与获取
本研究选择采用奥林巴斯(olympus) BX53荧光显微镜,4× 物镜观察,其中蓝色荧光用330 nm的荧光光源激发、绿色荧光用490 nm的荧光光源激发、红色荧光用560 nm的荧光光源激发,拍照时选择相应的滤光片,临时组织装片直接采用选取的组织,滴加一滴PBS缓冲液,盖上盖玻片,放到荧光显微镜上观察,显微镜条件下调节的无荧光的对照装片为洋葱表皮组织,有荧光的对照装片为光下培养的油菜叶和根组织。使用CCD摄像机将所观察的荧光现象拍照。
3. 结果与分析
3.1. 洋葱表皮细胞自发荧光的观察
洋葱表皮是细胞观察常用的实验材料之一,本实验分别观察了黄皮洋葱(图1小写标号)紫皮洋葱(图1大写标号)内、外表皮的蓝色、绿色、红色自发荧光现象,研究发现,无论黄皮或紫皮洋葱均未发现蓝色、绿色、红色自发荧光。经反复实验后发现在撕取洋葱外表皮时应尽可能不带有洋葱鳞片叶肉细胞,叶肉细胞在被紫外光激发时会出现残留的蓝色荧光,这是应用蓝色荧光进行细胞观察时需要注意的操作。

Figure 1. Images of onion epidermis observed under three kinds of excitation light. (Note: Capital letters stand for purple Onions and lowercase letters stand for yellow. (A), (B) and (C) are the results of blue, green and red fluorescence observation of the outer epidermis, respectively; (D), (E) and (F) are the results of blue, green and red fluorescence observation of the inner epidermis, respectively)
图1. 洋葱表皮在三种激发光下观察到的图像。(注:大写字母表示紫皮洋葱,小写字母表示黄皮洋葱。(A)、(B)、(C)分别为外表皮蓝色、绿色、红色荧光观察的结果,(D)、(E)、(F)分别为内表皮蓝色、绿色、红色荧光观察的结果)
3.2. 黑暗和正常光照处理下油菜幼苗根、茎、叶组织的自发荧光
3.2.1. 根、茎、叶组织黑暗和正常光照处理下的紫色自发荧光
油菜种子采用水培法发芽6 d后可以观察到明显的根、茎和叶组织,因此以6 d为初始观察时间,每隔一天观察一次,共观察6次。结果见蓝色荧光图(图2、图3、图4),从根组织的图2可以看出正常光

Figure 2. Blue fluorescence of root tissue under normal light and dark culture conditions. (Note: Figure (A)~(F) shows the blue fluorescence of root tissue of Brassica campestris seedlings observed on day 6, 8, 10, 12, 14 and 16 respectively. The upper case number represents the change of normal light tissue, and the lower case number represents the tissue number under dark treatment)
图2. 根组织正常光照和黑暗培养条件下的蓝色荧光。(注:图(A)~(F)分别为观察的第6、8、10、12、14、16 d的油菜幼苗根组织的蓝色荧光;大写编号代表正常光照组织的编号,小写编号代表黑暗处理下组织的编号)
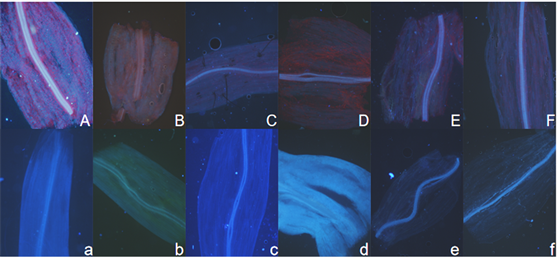
Figure 3. Blue fluorescence of Brassica campestris stem tissue under normal light and dark culture conditions. (Note: Figure (A)~(F) shows the blue fluorescence of stem tissue of Brassica campestris seedlings observed on day 6, 8, 10, 12, 14 and 16 respectively. The upper case number represents the normal light tissue number, and the lower case number represents the dark tissue number)
图3. 油菜茎组织正常光照和黑暗培养条件下的蓝色荧光。(注:图(A)~(F)分别为观察的第6、8、10、12、14、16 d的油菜幼苗茎组织的蓝色荧光;大写编号代表正常光照组织的编号,小写编号代表黑暗处理下组织的编号)

Figure 4. Blue fluorescence of Brassica campestris leaf tissue under normal light and dark culture conditions. (Note: Figure (A)~(F) shows the blue fluorescence of leaf tissues of Brassica campestris seedlings observed on day 6, 8, 10, 12, 14 and 16 respectively. The upper case number represents the normal light tissue number, and the lower case number represents the dark tissue number)
图4. 油菜叶组织正常光照和黑暗培养条件下的蓝色荧光。(注:图(A)~(F)分别为观察的第6、8、10、12、14、16 d的油菜幼苗叶组织的蓝色荧光;大写编号代表正常光照组织的编号,小写编号代表黑暗处理下组织的编号)
照组观察初期蓝色荧光明显,之后逐渐减弱,到15 d后又开始变清晰。黑暗处理观察初期也比较明显,然后慢慢减弱,到17 d也没有增强。从茎组织的图3可以看出无论黑暗还是光照条件下蓝色荧光都较强,其中6 d的幼苗荧光最强。但光照条件下的组织红色背景明显,黑暗培养下的组织背景较为干净,没有叶绿素荧光的干扰。从叶组织的图4可以看出,黑暗培养下的蓝色荧光颜色明显,没有其他背景颜色干扰。而光照培养下由于叶绿素的红色荧光很强,不同天数的叶片叶绿素分布也不一致,导致蓝色荧光常被红色荧光掩盖,未受干扰的部位蓝色明显,说明叶片也有蓝色荧光。所有组织的主脉都是蓝色荧光强度最高的部位。
3.2.2. 根、茎、叶组织黑暗和正常光照处理下的绿色自发荧光
绿色荧光的幼苗培育条件与蓝色荧光幼苗相同。细胞壁内的物质在植物体内的条件下不仅可以发出蓝色荧光,有的还可以发出绿色荧光,经蓝光激发后,油菜幼苗的根(图5)茎(图6)组织均呈现很微弱的绿色荧光,不同天数的根组织绿色荧光均较弱,从图5可知,根组织几乎都没有强烈荧光出现。12 d黑暗条件下的组织绿色较亮。茎组织(图6)绿色荧光较弱,由于茎有绿色,因此叶绿素强烈的红色荧光能把绿色荧光掩盖住,只有黑暗处理后,才能看出绿色荧光,第6 d到第16 d趋势基本一致。叶(图7)组织同茎组织一样,红色荧光依然掩盖绿色荧光,黑暗处理后才可见明显的绿色荧光,与茎组织不同的是叶组织的绿色荧光较强而且相对均匀。
锡箔纸遮光的活体材料在水分管理过程中会短暂的接触光,从而导致后期的叶片略显红色荧光,在黑暗生长初期的幼苗叶片为黄白色。

Figure 5. Green fluorescence of Brassica campestris root tissue under normal light and dark culture conditions (Note: Figure (A)~(F) shows the green fluorescence of root tissue of Brassica campestris seedlings observed on day 6, 8, 10, 12, 14 and 16 respectively. The upper case number represents the normal light tissue number, and the lower case number represents the dark tissue number)
图5. 油菜根组织正常光照和黑暗培养条件下的绿色荧光。(注:图(A)~(F)分别为观察的第6、8、10、12、14、16 d的油菜幼苗根组织的绿色荧光;大写编号代表正常光照组织的编号,小写编号代表黑暗处理下组织的编号)

Figure 6. Green fluorescence of Brassica campestris stem tissue under normal light and dark culture conditions. (Note: Figure (A)~(F) shows the green fluorescence of stem tissue of Brassica campestris seedlings observed on day 6, 8, 10, 12, 14 and 16 respectively. The upper case number represents the normal light tissue number, and the lower case number represents the dark tissue number)
图6. 油菜茎组织正常光照和黑暗培养条件下的绿色荧光。(注:图(A)~(F)分别为观察的第6、8、10、12、14、16 d的油菜幼苗茎组织的绿色荧光;大写编号代表正常光照组织的编号,小写编号代表黑暗处理下组织的编号)

Figure 7. Green fluorescence of Brassica campestris leaf tissue under normal light and dark culture conditions. (Note: Figure (A)~(F) shows the green fluorescence of stem tissue of Brassica campestris seedlings observed on day 6, 8, 10, 12, 14 and 16 respectively. The upper case number represents the normal light tissue number, and the lower case number represents the dark tissue number)
图7. 油菜叶组织正常光照和黑暗培养条件下的绿色荧光(注:图(A)~(F)分别为观察的第6、8、10、12、14、16 d的油菜幼苗茎组织的绿色荧光;大写编号代表正常光照组织的编号,小写编号代表黑暗处理下组织的编号)
3.2.3. 根、茎、叶组织黑暗和正常光照处理下的红色自发荧光
在绿色激发光源照射下观察油菜幼苗根、茎、叶组织的红色荧光,观察发现在光照条件下根组织(图8)也有红色荧光,但强度较弱,光照和黑暗处理情况基本一致。光照培养的油菜幼苗茎组织一直显现出强烈的红色荧光,而在黑暗条件下培养的油菜幼苗茎组织的红色荧光较微弱(图9),随着黑暗条件下时间的延长,茎组织红色荧光强度逐渐增强。叶组织(图10)则无论黑暗和光照条件下都有红色荧光,光照下的红色荧光非常强。不同培养天数荧光强度趋势是一致的。
3.3. 不同浓度卡那霉素处理下油菜幼苗茎、叶的自发荧光颜色变化
3.3.1. 不同浓度卡那霉素处理下油菜幼苗的蓝色荧光
自萌发起就采用不同浓度的卡那霉素溶液作为水源培育幼苗,研究不同天数不同浓度的油菜幼苗自
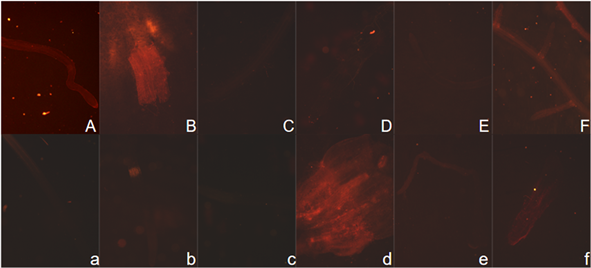
Figure 8. Red fluorescence of Brassica campestris root tissue under normal light and dark culture conditions. (Note: Figure (A)~(F) shows the red fluorescence of root tissue of Brassica campestris seedlings observed on day 6, 8, 10, 12, 14 and 16 respectively. The upper case number represents the normal light tissue number, and the lower case number represents the dark tissue number)
图8. 油菜根组织正常光照和黑暗培养条件下的红色荧光。(注:图(A)~(F)分别为观察的第6、8、10、12、14、16 d的油菜幼苗根组织的红色荧光;大写编号代表正常光照组织的编号,小写编号代表黑暗处理下的组织编号)
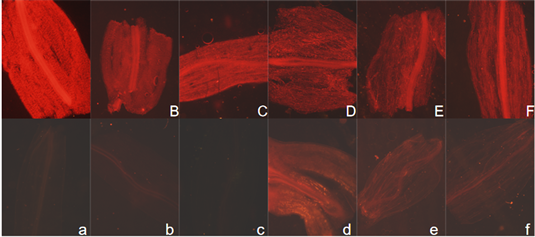
Figure 9. Red fluorescence of Brassica campestris stem tissue under normal light and dark culture conditions. (Note: Figure (A)~(F) shows the red fluorescence of stem tissue of Brassica campestris seedlings observed on day 6, 8, 10, 12, 14 and 16 respectively. The upper case number represents the normal light tissue number, and the lower case number represents the dark tissue number)
图9. 油菜茎组织正常光照和黑暗培养条件下的红色荧光。(注:图(A)~(F)分别为观察的第6、8、10、12、14、16 d的油菜幼苗茎组织的红色荧光;大写编号代表正常光照组织的编号,小写编号代表黑暗处理下的组织编号)
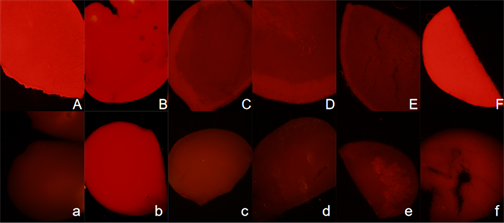
Figure 10. Red fluorescence of Brassica campestris leaf tissue under normal light and dark culture conditions. (Note: Figure (A)~(F) shows the red fluorescence of stem tissue of Brassica campestris seedlings observed on day 6, 8, 10, 12, 14 and 16 respectively. The upper case number represents the normal illumination tissue number, and the lower case number represents the dark treatment tissue number)
图10. 油菜叶组织正常光照和黑暗培养条件下的红色荧光。(注:图(A)~(F)分别为观察的第6、8、10、12、14、16 d的油菜幼苗茎组织的红色荧光;大写编号代表正常光照组织的编号,小写编号代表黑暗处理组织的编号)
发荧光现象,在紫外激发光源照射下观察各处理下的蓝色荧光,从图11可以看出嫩茎(胚轴)组织在0~200 μg/ml浓度卡那霉素处理下均可以观察到蓝色荧光以及不同程度的红色背景,无论是6 d、8 d还是12 d均可见红色背景,说明卡那霉素不能完全克服茎组织叶绿素的荧光干扰;当观察叶组织时却有了变化,卡那霉素150~200 μg/ml处理6 d时可以消除红色背景,随着时间的延长,逐渐开始有红色背景,说明较高浓度的卡那霉素可抑制叶绿素形成,从而降低红色荧光的强度。
3.3.2. 不同卡那霉素浓度处理下的油菜幼苗茎、叶组织的绿色荧光
从图12可以看出,油菜幼苗的茎(胚轴)组织处理6 d时在较高浓度的卡那霉素处理下可以观察到部分较弱的绿色荧光,规律性并不强,200 μg/ml浓度的卡那霉素溶液处理并未降低红色荧光的干扰;对于叶组织则比较明显,150~200 μg/ml卡那霉素溶液处理6 d时可以消除红色背景,观察到较弱的绿色荧光,说明较高浓度的卡那霉素处理可以克服叶绿素的红色荧光对绿色荧光观察的干扰,只是时期非常有限,选择幼苗时目视下黄白的幼苗比较容易获得抗干扰的效果。到了8 d时只有局部组织有此效果,随着培养时间的延长红色背景也逐渐增强。
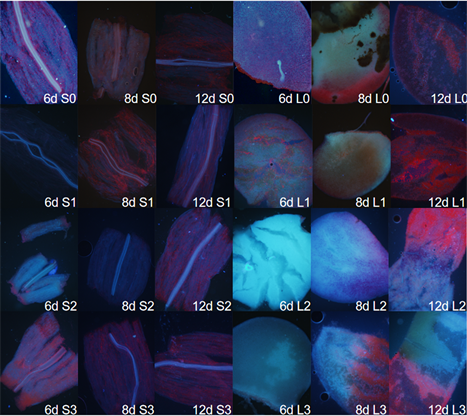
Figure 11. Blue fluorescence of stem and leaf tissues of Brassica campestris seedlings treated with different concentrations of kanamycin. (Note: 6 d, 8 d and 12 d in the subscripts represent the number of days from seed treatment to observation. S stands for stem and L for leaf; The numbers 0, 1, 2 and 3 after the letters represent the concentration of kanamycin at 0, 100, 150 and 200 μg/ml, respectively)
图11. 不同浓度卡那霉素处理下的油菜幼苗茎、叶组织的蓝色荧光。(注:下标中6 d、8 d、12 d代表种子经处理后到观察时的天数;S代表茎、L代表叶;字母后的0、1、2、3数字分别代表卡那霉素浓度为0、100、150、200 μg/ml)

Figure 12. Green fluorescence of stem and leaf tissues of Brassica campestris seedlings treated with different concentrations of kanamycin. (Note: 6 d, 8 d and 12 d in the subscripts represent the days to observation after seed treatment; S and L stand for stem and leaf; 0123 stands for kanamycin concentration of 0, 100, 150, 200 μg/ml)
图12. 不同浓度卡那霉素处理下的油菜幼苗茎、叶组织的绿色荧光。(注:下标中6 d、8 d、12 d代表种子经处理后到观察的天数;S、L代表茎、叶;0123代表卡那霉素浓度为0、100、150、200 μg/ml)
3.3.3. 不同浓度卡那霉素处理下的油菜幼苗茎、叶组织的红色荧光
在绿色光源激发光照射下观察油菜幼苗茎(胚轴)、叶组织的红色荧光,观察(图13)发现,无论卡那霉素为何种浓度,各处理下的油菜幼苗茎组织几乎都显示了红色荧光,说明卡那霉素处理茎(胚轴)并没有完全消除红色荧光。观察叶组织可知,未经处理的组织红色荧光强度非常强,而卡那霉素处理可以减弱红色荧光的强度,但不能消除红色自发荧光现象。不同浓度和不同天数效果有差异,减弱效果最好的依然是生长6 d的处理。

Figure 13. Red fluorescence of stem and leaf tissues of Brassica campestris seedlings treated with different concentrations of kanamycin. (Note: 6 d, 8 d and 12 d in the subscripts represent the days to observation after seed treatment; S and L stand for stem and leaf; 0123 stands for kanamycin concentration of 0, 100, 150, 200 μg/ml)
图13. 不同浓度卡那霉素处理下的油菜幼苗茎、叶组织的红色荧光。(注:下标中6 d、8 d、12 d代表种子经处理后到观察的天数;S、L代表茎、叶;0123代表卡那霉素浓度为0、100、150、200 μg/ml)
3.4. 不同处理下油菜幼苗叶片去叶绿素程度的比较
以光照培养的正常叶片为对照,选取处理有效的黑暗、卡那霉素处理下叶片来比较二者对叶绿素的减弱效果。由图14可知,在光照条件下培养生长态势良好的油菜幼苗叶片在紫外激发光照射下,蓝色荧光变浅,红色荧光可覆盖蓝色荧光,在黑暗条件下培养的油菜幼苗叶片可观察到明显的蓝色荧光,经浓度为200 μg/ml卡那霉素溶液处理过的白化幼苗叶片也可观察到弱蓝色荧光,强度低于黑暗处理。由图15可知,绿色荧光黑暗处理的效果好于卡那霉素处理的,几乎没有红色荧光干扰,而卡那霉素处理过的叶片红色荧光依然可以覆盖绿色荧光,但其强度低于对照。由图16可知,黑暗和卡那霉素处理均可减弱红色荧光,使其远低于对照的水平。但都无法消除红色荧光,两种处理效果几乎没有差异。
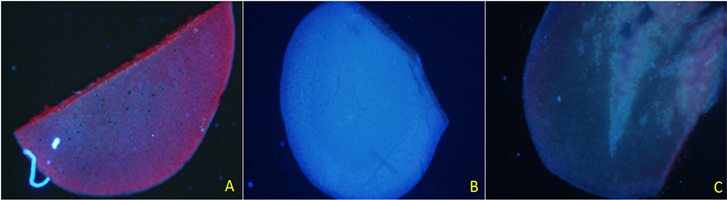
Figure 14. Blue fluorescence of leaf tissue of rape seedlings grown under three conditions.(Note: (A) shows the leaves of seedlings grown in light; (B) shows the leaves of seedlings cultured in dark, and (C) shows the leaves of albino seedlings.)
图14. 三种条件下生长的油菜幼苗叶片组织的蓝色荧光。(注:图(A)为光照条件下生长的幼苗叶片,图(B)为黑暗条件下培养的幼苗叶片,图(C)为白化幼苗叶片)
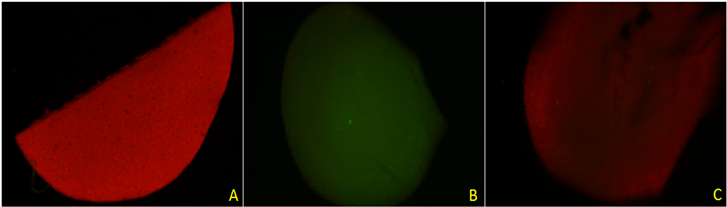
Figure 15. Green fluorescence of leaf tissue of rape seedlings grown under three conditions.(Note: (A) shows the leaves of seedlings grown in light; (B) shows the leaves of seedlings cultured in dark, and (C) shows the leaves of albino seedlings.)
图15. 三种条件下生长的油菜幼苗叶片组织的绿色荧光。(注:图(A)为光照条件下生长的幼苗叶片,图(B)为黑暗条件下培养的幼苗叶片,图(C)为白化幼苗叶片)
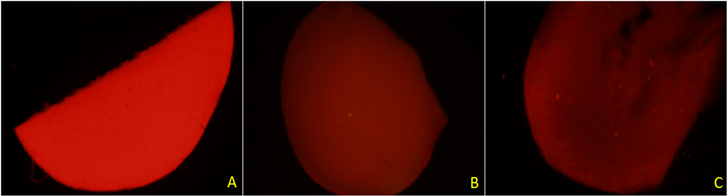
Figure 16. Red fluorescence of leaf tissue of rape seedlings grown under three conditions.(Note: (A) shows the leaves of seedlings grown in light; (B) shows the leaves of seedlings cultured in dark, and (C) shows the leaves of albino seedlings.)
图16. 三种条件下生长的油菜幼苗叶片组织的红色荧光。(注:图(A)为光照条件下生长的幼苗叶片,图(B)为黑暗条件下培养的幼苗叶片,图(C)为白化幼苗叶片)
3.5. 果胶酶和纤维素酶处理对油菜幼苗自发荧光的影响
选取在光照条件下生长良好的油菜幼苗浸泡在含有果胶酶(5%)、纤维素酶(5%)的0.1 mol/L的PBS溶液中浸泡组织,24 h后观察三种颜色的荧光现象,浸泡过程中油菜苗逐渐变为黄色;在激发光照射下,观察油菜幼苗经果胶酶和纤维素酶处理后根、茎、叶细胞的自发荧光现象,由图17观察到,处理24 h后,幼苗根、茎、叶细胞的绿色荧光消除,红色、蓝色荧光强度降低。

Figure 17. Fluorescence of leaf tissues of Brassica campestris seedlings treated with transparent solution. (Note: 1, 2, 3 and 4 are the results of white light, blue, green and red fluorescence observation of leaf tissues respectively. R, S and L stand for root, stem and leaf)
图17. 果胶酶和纤维素酶处理后的油菜幼苗组织的荧光(注:1、2、3、4分别为叶片组织白光、蓝色、绿色、红色荧光观察的结果,R、S、L代表根、茎、叶)
3.6. 结论小节
本研究观察到黄皮、紫皮洋葱的内、外表皮均不显现三种荧光;白菜型油菜三种处理方式的根、茎、叶组织均可观察到蓝色荧光,但光照条件下生长的叶与茎组织会出现红色荧光覆盖蓝色或绿色荧光的现象;三种处理方式的根均可发出微弱的绿色荧光,黑暗中水培法处理的油菜幼苗茎和叶片组织的绿色荧光强于根组织,因荧光较弱,叶绿素的红色荧光常掩盖叶和茎组织的蓝色或绿色荧光;三种处理方式的油菜幼苗根、茎、叶组织均可观察到红色荧光,其中在光照条件下水培法处理的油菜幼苗根、茎、叶片组织的红色荧光强度最强,卡那霉素溶液处理的白化幼苗仅在150~200 μg/ml浓度下处理6 d时表现出能克服红色荧光对其他颜色荧光的干扰,黑暗处理的油菜幼苗根、茎、叶组织荧光最弱,酶解法处理的光照培养条件下生长良好的油菜幼苗,幼苗根、茎、叶细胞的绿色荧光消除,蓝色、红色荧光强度降低。
4. 讨论
Lloyd Donaldson (2020)认为细胞壁物质中木质素、阿魏酸、木栓素等在厚壁组织或木质化组织含量较高,荧光范围在400 nm~500 nm区,即蓝绿色的分布区 [6]。本研究发现蓝色荧光在幼嫩的组织里一直较强,无论根、茎、叶蓝色荧光都较亮,说明只要细胞壁存在的部位,就会存在蓝色荧光。在观察蓝、绿色荧光时,光照下的组织只可以看到红色和蓝色荧光,看不到绿色,说明从总体强度上自发绿色荧光较弱。细胞壁物质的荧光特性不仅受内环境pH值的影响,还受组成分类型等的影响 [6],在幼苗培育过程中,观察到的绿色荧光程度的变化可能与内部成分有关,根中普遍绿色较弱,叶中6 d~12 d光照下绿色荧光强度大,而茎中则是12 d~16 d绿色比较清晰。总体上,油菜幼苗地上部是存在较弱的绿色荧光的,这种荧光会被红色的叶绿素荧光掩盖。
叶绿素是进行光合作用的,受光的影响较大,但实验发现,黑暗处理并不能完全克服叶绿素荧光,暗培养的幼苗还是会形成少量叶绿素,这些色素足以形成荧光显微镜下鲜明的红色荧光。因此单纯通过黑暗处理不能完全克服油菜叶绿素荧光,但观察其它颜色的荧光时不再干扰了。红色荧光蛋白标记还是会受到干扰。卡那霉素可以使小麦叶片完全白化 [13],但对油菜却不能,本研究用了多个浓度的卡那霉素处理,无论哪个浓度都难以完成形成白化苗,仅部分叶片会有短暂的白化现象。这与傅淑等对再生芽的研究不一致,可能是因为品种差异或组织类型的差异 [15],从本研究看,油菜耐受卡那霉素的能力较强。对报告基因GFP融合表达是也有应用价值,应用时需要严格把握时期和部位,仅子叶有短暂白化期。
油菜幼苗根、茎、叶组织均能发出红色荧光,这和传统的认知是有差异的,一般认为绿色组织才有红色自发荧光,因此在进行荧光标记蛋白的选择前,有必要对植物组织的自发荧光全面认识,才不会在荧光蛋白标记试验中受意外的荧光干扰。
细胞壁水解酶类对植物组织有水解作用,可以将组织水解成无细胞壁的原生质体,也可以在不完全水解的条件下获得部分水解的组织。本实验采用部分水解的组织进行观察,发现纤维素酶和果胶酶的充分处理可以消除组织的绿色荧光,对蓝色荧光有减弱效果,对红色荧光也有减弱作用。这种减弱可能是因为水解导致装片细胞层数少,总荧光强度减弱。酶解是荧光报告基因进行组织定位观察的常用手段 [16],赵静也证明可以利用油菜原生质体进行组织定位观察 [17]。
基金项目
山东省大学生创新计划项目(S202111067055)。
NOTES
*通讯作者。