1. 引言
辣根过氧化物酶(Horseradish Peroxidase, HRP)是一种糖蛋白,它以铁卟啉为辅基,在过氧化氢存在时能催化苯酚、苯胺及其取代聚合物。由于其活性高且稳定性好,提取制备简单,常被制备成免疫类(ELISA)试剂盒,广泛用于工、农、医和环境等各领域 [1]。设计出一种更为简便、有效的HRP酶活性检测方法具有实际意义 [2] [3] [4]。目前检测酶活用得最多的是分光光度法和荧光法。荧光法除可应用于检测荧光物质,还可分析原本无荧光的生物大分子。酶蛋白本身的荧光强度一般很弱,若将荧光探针与其结合使用,则有利于酶蛋白的检出,大为提高灵敏度。在体系成分复杂时,荧光探针作为一种非放射性的标记技术,安全性和灵敏度较高,因此是值得尝试的一个研究方向。
开发有效的小分子荧光探针以实时跟踪和可视化多种生物酶检测是近年来的研究热点。三联吡啶配合物与含NS的生物大分子如蛋白质、DNA等有很好的亲和性,由于发光性质可发生变化可应用于生物探针。三联吡啶衍生物日益受到重视,主要是以打破三联吡啶单一的配位模式为主要目标,同时又逐步向多功能方向发展 [5] [6] [7] [8]。若在三4’位置引入羧基可以与各种金属Mn+构成丰富的配位,而且羧基配体能溶于弱碱性水溶液,易于在水相中与生物大分子发生相互作用 [9] [10] [11]。本文利用荧光光谱在水相中采用2,6-二-(2-吡啶基)-4-吡啶甲酸(配体PPA,见图1)测定HRP酶浓度。该方法的原理是以HRP酶催化H2O2氧化配体PPA形成水溶性产物,通过测定体系荧光强度变化以确定HRP酶浓度。配体PPA易于合成,与HRP的最适pH作用范围十分匹配,在接近中性的条件下能溶于水和HRP作用。

Figure 1. The Structure of 2,6-di-(2-pyridyl)-4-Picolinic acid
图1. 2,6-二-(2-吡啶基)-4-吡啶甲酸结构
目前未见2,6-二-(2-吡啶基)-4-吡啶甲酸用于荧光光度法检测HRP酶浓度的研究。本方法可用于游离HRP的检测,响应快、灵敏度高、操作简便,可为HRP酶检测的发展和完善提供有效选择,具有实际的应用前景。
2. 实验部分
2.1. 实验试剂与仪器
2,6-二-(2-吡啶基)-4-吡啶甲酸,辣根过氧化物酶(HRP),阿拉丁;30% H2O2,NaOH,KOH,NaHSO3,无水乙醇,分析纯,西陇化工股份有限公司。荧光光谱仪(F-7000,日立分析仪器有限公司)。
2,6-二-(2-吡啶基)-4-吡啶甲酸溶液:准确称取一定量配体PPA,加蒸馏水溶解,并加入几滴配制好的NaOH溶液,后移入250 mL容量瓶中,定容成浓度为5 × 10−4 mol/L的溶液,常温保存,稀释为不同浓度为后续使用。
辣根过氧化物酶溶液:准确称取一定量HRP溶于水,后移入250 mL容量瓶中,配制成1 × 10−6 mol/L的溶液,放入4℃冰箱中保存,稀释为不同浓度供后续使用。
2.2. 实验方法
在一定发射波长下,测定配体PPA和酶HRP的荧光发射光谱。固定配体和HRP酶浓度,寻找合适的H2O2浓度。采用单因素法,分别考察时间、温度、pH对该作用体系的影响。在一定配体和H2O2浓度下,绘制HRP酶的荧光光谱工作曲线。
3. 实验结果
3.1. 配体荧光光谱
由图2可知,当激发波长为286 nm时,配体PPA的荧光光谱在366 nm处有一较强的发射峰,550~600 nm处的小峰为倍频峰。该水溶性三联吡啶配合物具有很高的荧光量子产率,可以在低浓度下使用。加入酶和双氧水,体系荧光发射峰增强。
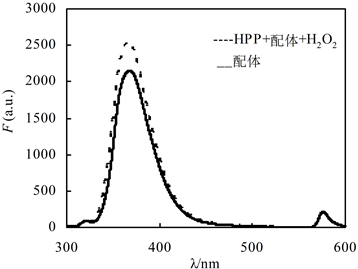 C(配体PPA) = 1 × 10−5 mol/L, C(HRP) = 1 × 10−7 mol/L, C(H2O2) = 1 × 10−4 mol/L;室温,pH = 7.2,反应时间0.5 h。
C(配体PPA) = 1 × 10−5 mol/L, C(HRP) = 1 × 10−7 mol/L, C(H2O2) = 1 × 10−4 mol/L;室温,pH = 7.2,反应时间0.5 h。
Figure 2. Effect of HRP on fluorescence intensity of ligand PPA
图2. HRP对配体PPA荧光强度的影响
3.2. H2O2浓度的影响
H2O2浓度对体系发光强度有影响,浓度过高会相应增加背景,太低又会由于其本身不稳定会影响HRP检测的灵敏度和准确性,有必要考察合适的H2O2浓度。图3是在一定浓度的配体PPA与HRP中加入不同浓度的H2O2所测得的荧光图谱。366 nm的发射波长处出现最高峰,峰值随H2O2浓度增大而略有增加,但H2O2过量后峰值不再变化。后续实验中使H2O2过量,以消除H2O2的干扰。
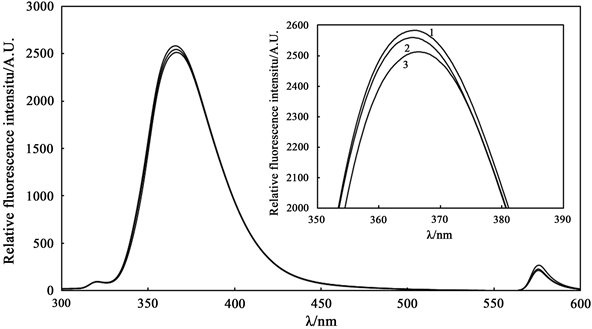 C(配体PPA) = 1 × 10−5 mol/L, C(HRP) = 1 × 10−7 mol/L, C(H2O2): 1—1 × 10−4 mol/L, 2—1 × 10−6 mol/L, 3—1 × 10−7 mol/L;室温,pH = 7.2,反应时间0.5 h。
C(配体PPA) = 1 × 10−5 mol/L, C(HRP) = 1 × 10−7 mol/L, C(H2O2): 1—1 × 10−4 mol/L, 2—1 × 10−6 mol/L, 3—1 × 10−7 mol/L;室温,pH = 7.2,反应时间0.5 h。
Figure 3. Effect of H2O2 concentration on fluorescence intensity of the system
图3. H2O2浓度对体系荧光强度的影响
3.3. 时间因素
影响体系吸光度的因素很多,如时间、pH、温度等。反应随催化时间的增加,体系的吸光度亦增加,前10 min几乎呈线性。20 min 之后,速度增加缓慢,渐趋于平衡,见图4。达到平衡后的体系非常稳定,48 h内吸光度基本保持恒定。
 C(配体PPA) = 0.4 × 10−4 mol/L, C(HRP) = 1.056 × 10−7 mol/L, C(H2O2) = 1 × 10−4 mol/L,室温,pH = 7.2。
C(配体PPA) = 0.4 × 10−4 mol/L, C(HRP) = 1.056 × 10−7 mol/L, C(H2O2) = 1 × 10−4 mol/L,室温,pH = 7.2。
Figure 4. Reaction process of ligand PPA-HRP-H2O2 system
图4. PPA-HRP-H2O2体系的作用进程
3.4. 温度因素
温度不仅影响酶反应速率,而且影响酶的稳定性。如图5所示,HRP酶反应在40℃左右为比较适宜,较高温度时反应速率有所提升,但不利于酶的稳定。本体系在室温下即可得到满意的反应速率,且室温操作较为节能方便,故本实验在室温下进行。
 C(配体PPA) = 0.4 × 10−4 mol/L, C(HRP) = 1.056 × 10−7 mol/L, C(H2O2) = 1 × 10−4 mol/L,反应时间0.5 h,pH = 7.2。
C(配体PPA) = 0.4 × 10−4 mol/L, C(HRP) = 1.056 × 10−7 mol/L, C(H2O2) = 1 × 10−4 mol/L,反应时间0.5 h,pH = 7.2。
Figure 5. Effect of temperature on the fluorescence intensity of the system
图5. 温度对体系荧光强度的影响
3.5. pH因素
HRP催化作用的最佳pH是中性或弱酸性。配体PPA在中性条件下溶解性较差,在酸性时易溶于有机溶剂。如图6所示,实验测试配体PPA在pH = 7.2的弱碱性体系中溶解良好,该pH也在HRP催化反应的最适pH范围,因此该体系的pH定为7.2。
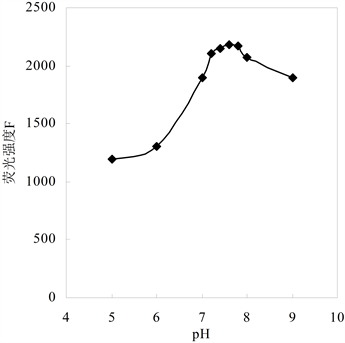 C(配体PPA) = 0.4 × 10−4 mol/L, C(HRP) = 1.056 × 10−7 mol/L, C(H2O2) = 1 × 10−4 mol/L,室温,反应时间0.5 h。
C(配体PPA) = 0.4 × 10−4 mol/L, C(HRP) = 1.056 × 10−7 mol/L, C(H2O2) = 1 × 10−4 mol/L,室温,反应时间0.5 h。
Figure 6. Effect of pH on fluorescence intensity of the system
图6. pH对体系荧光强度的影响
3.6. 工作曲线
图7是在6 × 10−6 mol/L的配体PPA溶液中加入梯度浓度的HRP溶液所测得荧光图谱。随着HRP浓度的增大,荧光强度逐渐升高,于366 nm峰值处绘制荧光强度的工作曲线。可见体系荧光强度对HRP浓度之间有良好的线性关系。HRP对配体PPA的氧化能力与酶浓度成正相关。把该体系在常温下放置48 h后再测试其荧光发射光谱,其荧光强度保持稳定,有比较强的抗干扰能力。荧光光谱对配体PPA-HRP-H2O2 体系的识别性能好,可简单快速识别,灵敏度高,具有一定的应用潜力。
 1—C(HRP) = 3.168 × 10−7 mol/L;2—C(HRP) = 2.464 × 10−7 mol/L;3—C(HRP) = 2.112 × 10−7 mol/L;4—C(HRP) = 1.760 × 10−7 mol/L;5—C(HRP) = 7.040 × 10−8 mol/L;C(配体) = 6 × 10−6 mol/L;C(H2O2) = 1 × 10−4 mol/L;室温,pH = 7.2,反应时间0.5 h。
1—C(HRP) = 3.168 × 10−7 mol/L;2—C(HRP) = 2.464 × 10−7 mol/L;3—C(HRP) = 2.112 × 10−7 mol/L;4—C(HRP) = 1.760 × 10−7 mol/L;5—C(HRP) = 7.040 × 10−8 mol/L;C(配体) = 6 × 10−6 mol/L;C(H2O2) = 1 × 10−4 mol/L;室温,pH = 7.2,反应时间0.5 h。
Figure 7. Fluorescence working curve of ligand PPA-HRP-H2O2 system
图7. 配体PPA-HRP-H2O2体系荧光工作曲线
4. 结论
本文利用荧光光谱在水相中采用2,6-二-(2-吡啶基)-4-吡啶甲酸测定辣根过氧化物酶酶浓度。HRP对过氧化氢氧化配体PPA的反应具备显著的催化作用,得到的化合物对366 nm发射波长的光具有较强的荧光。在HRP浓度为10−7~10−8 mol/L时,配体PPA-HRP-H2O2体系的荧光强度与HRP的浓度有较好的线性关系,检测限可达10−8 mol/L。该2,6-二-(2-吡啶基)-4-吡啶甲酸-H2O2-HRP体系的灵敏度较高,操作简便,抗干扰能力强,成本相对较低,可用作检测游离的HRP和HRP标记物的新方法,具有实际的应用前景。
基金项目
国家青年自然科学基金(21801139)资助。
参考文献
NOTES
*通讯作者。