1. 引言
淡水生态系统的重金属污染是工业化国家普遍遭遇的问题。重金属具有剧毒,在自然环境中无法代谢,在水中积累到一定限度后,会对水生植物和水生动物造成破坏,进而对整个水生生态系统造成破坏。由于重金属在环境中是具有持久性的,所以物种长期接触金属往往会持续一代以上的时间。污染地区的自然种群可能受到选择性压力,导致死亡率增加和繁殖力降低 [1] ,也可能会使得物种通过表型可塑性的进化或适应性的发展来响应多代暴露于金属,维持种群的续存,然而对野生环境中暴露在污染下的进化反应的研究和理解是有限的 [2] [3] 。目前研究表明,一些种群已经能够适应污染下的环境,产生了进化 [4] [5] ,N G Hairston研究了淡水浮游动物水蚤对其环境中蓝藻丰度增加的选择响应,发现浮游动物能够通过表型可塑性的进化适应蓝藻增加与食物质量的变化 [4] 。部分学者则验证,有的物种在接触化学污染后未能适应或变得不适应 [6] [7] ,如Gregor Rolshausen验证孔雀鱼对水体环境中石油的污染并不能产生适应和进化,其生长发育受到了污染的影响。
砷,俗称砒,是水生生态系统中天然存在的一种金属,是一种有毒并具有持续性危害的类金属污染物 [8] 。被认为是低浓度的有毒暴露,因为它可以作为生物替代品过程中的基本元素,通过替代磷酸酶产生磷,这反过来又可能破坏能源生产 [9] 。砷对人体具有高度危害性,世界卫生组织制定的饮用水标准将砷含量规定为10 μg/L。然而,受人类活动的影响,包括采矿活动、煤炭燃烧、农药和杀虫剂使用等,大量的砷被释放到环境中,这些砷通过流域进入河流或湖泊,最终会污染水体。当砷积累到一定浓度,不仅会对水中各种生物直接造成危害,还会通过食物链和食物网的传播间接影响水生生物。针对湖泊砷污染的研究,Hong等 [10] 研究了淡水生物学中砷的形态,以便通过分析不同的淡水介质样本(浮游动物、悬浮颗粒物和水样)更好地了解砷的分布和生物累积行为。Barrett等 [11] 研究了砷在水体不同层次中对浮游动物和浮游植物的迁移和积累行为。有关砷污染的研究大多集中在急性毒理实验中,但水生物种能否在砷污染湖泊中快速适应并进化以维持物种生存仍有待研究。
本研究旨在探讨在砷污染水体中,物种是否可以通过自然群落选择向砷进化。在室内培养时添加三种不同浓度的砷(0 μg/L、50 μg/L、150 μg/L),对群落进行为期一年的自然选择。自然选择后,挑选在三个砷浓度下都存活的物种,研究在不同的砷浓度选择条件下,种群是否对砷产生适应进化。
2. 材料与方法
2.1. 试验生物
选取云南师范大学校园湖未受到砷污染的水体为采样对象从校园湖里用64 μm浮游生物网采集浮游动物(轮虫,枝角类、桡足类),将从自然水体中获得的浮游动物混合均匀后平均分配到12个体积为120 L的实验单元中。实验前期,任意选取4个实验单元添加砷酸钠使砷浓度达到50 μg/L,选取另外4个实验单元添加砷酸钠使砷浓度达到150 μg/L,最后4个实验单元不添加砷,作为对照组。实验持续一年以上,使浮游动物群落在3种砷浓度(0 μg/L、50 μg/L、150 μg/L)条件下生长。控制室内温度在20℃~25℃,光周期12 h:12 h,定期向实验单元添加营养盐,避免浮游生物死亡后沉积,带走营养盐造成营养水平不一致,也起到维持浮游植物生长,为浮游动物持续提供食物的作用。
在选择实验结束后,检查所有实验单元的浮游动物种类,选取在所有砷浓度下均存在的同一个种来开展进化实验。检查筛选后发现共有种为螺形龟甲轮虫。按砷浓度,从相同浓度的四个实验单元里中分离出一定数量的螺形龟甲轮虫组成1个种群,共组成无砷(0 μg/L)、低砷(50 μg/L)、高砷(150 μg/L)三个种群,待螺形龟甲轮虫繁殖2个世代去除母体效应后作为实验对象开展实验。
螺形龟甲轮虫(Keratella cochlearis Gosse)隶属于单巢目、臂尾轮科、龟甲轮属,广泛分布于世界各地的淡水湖泊和池塘等水体 [12] [13] ,对不同温度、盐度、水体营养状态都具有较强耐受性。螺形龟甲轮虫具有较强的表型可塑性,易于鉴定和测量,这使其成为轮虫多态性进化及对环境变化响应研究的理想模型 [14] [15] 。
2.2. 试验方法
将去除母体效应的三个螺形龟甲轮虫幼体种群转移到容量为5 ml细胞孔。每3 d更换1次培养液(BG11),每两天喂食小球藻Chlorella。小球藻参照OECD化学品测试准则“201”中绿藻的要求培养。投饵密度为0.5 × 106 cells/mL,每天监测小球藻的密度,待其稀释到投饵密度后再喂食。砷酸钠砷浓度设置为四个梯度,分别为200 μg/L,250 μg/L,300 μg/L,350 μg/L。
将去除母体效应后的无砷(0 μg/L)、低砷(50 μg/L)、高砷(150 μg/L)螺形龟甲轮虫(Keratella cochlearis Gosse)种群分别向四个砷梯度(200 μg/L,250 μg/L,300 μg/L,350 μg/L)转移20只,共12个实验单元。在无光照条件下培养3天后,检查每个实验单元种群的存活个体数、死亡个体数、出生个体数,再随机从三个种群中随机挑选20个存活个体,转移有新鲜培养基和相应砷浓度的细胞板中,待培养3天后按照上述方法对螺形龟甲轮虫进行检验和计数。此步骤共重复4次,由于高浓度死亡数较多后面采用一天观察一次,重复五次,实验共持续17天。
2.3. 数据处理
计算各实验单元的出生率、死亡率和自然增长率。采用单因素方差分析——LSD检验,比较对照组与各处理组间各项指标的差异显著性。采用双因素方差分析对各响应变量进行统计分析,当P < 0.05时视为存在显著性差异。
3. 结果与分析
3.1. 种群出生率
各种群出生率见图1、图2。无砷组种群的出生率极低,几乎为零,而低砷组和高砷组的出生率均值在200 μg/L的砷浓度下分别为0.22和0.29;在250 μg/L的砷浓度下分别为0.13和0.26;在350 μg/L的砷浓度下分别为0.13和0.08;在350 μg/L的砷浓度下为0.19和0.18。低砷高砷组的种群出生率均值均高于无砷组,且无砷组种群出生率与低砷组种群出生率之间具有显著性差异(P < 0.05);而低砷组与高砷组的出生率并无显著性差异。说明不同砷浓度下均可产生选择进化,且在砷条件下选择的种群面对砷胁迫时能显著提高出生率以适应砷胁迫。
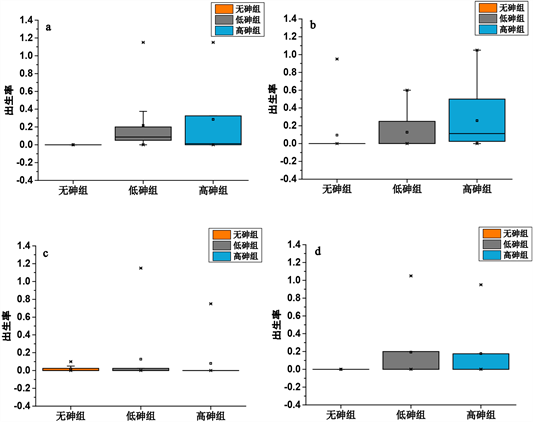 (图(a)~(d)依次为200 μg/L,250 μg/L,300 μg/L,350 μg/L四个砷浓度下的种群出生率箱线图)
(图(a)~(d)依次为200 μg/L,250 μg/L,300 μg/L,350 μg/L四个砷浓度下的种群出生率箱线图)
Figure 2. Box plot of population birth rate
图2. 种群出生率箱线图
3.2. 种群死亡率
各种群死亡率见图3、图4。三个种群在200 μg/L的砷浓度下死亡率均值分别为0.12、0.08和0.04;250 μg/L的砷浓度下死亡率均值分别为0.13/0.12和0.04;300 μg/L的砷浓度下死亡率分别为0.16、0.06和0.07;350 μg/L的砷浓度下死亡率分别为0.169、0.09和0.05。低砷组和高砷组的死亡率并无显著差异(P > 0.05),但在250 μg/L和300 μg/L下无砷组的死亡率明显高于低砷和高砷组(P < 0.05),而随着砷浓度的上升,低砷高砷组的死亡率也是有所增加,但仍显著低于无砷组。说明在高浓度下,砷实验组的优势会见底,种群数量也会呈现下降趋势。由此可见,在胁迫条件下生存的种群可以通过显著降低死亡率以适应砷胁迫。
虽然种群进化后可以耐受一定浓度的污染物,但也不是无限制的,在超高浓度下,可能会短时间内大量死亡,无法完成胁迫条件下选择进化。
 (图(a)~(d)依次为200 μg/L,250 μg/L,300 μg/L,350 μg/L四个砷浓度下的种群死亡率箱线图)
(图(a)~(d)依次为200 μg/L,250 μg/L,300 μg/L,350 μg/L四个砷浓度下的种群死亡率箱线图)
Figure 4. Box plot of population mortality
图4. 种群死亡率箱线图
3.3. 种群增长率
种群增长率如图5、图6所示。在200 μg/l的浓度上,无砷组的增长率为负值,而低砷高砷的则呈正增长。且低砷高砷与无砷空白克隆之间有显著差异(P < 0.01),说明在砷环境下生存下来的种群,再次面对砷环境时其增长率更高。而在更高浓度250 μg/L下,低砷高砷种群增长率均有所下降,且与低砷种群之间差异不显著。在300 μg/L以及高浓度350 μg/L的砷浓度下,低砷高砷种群的增长率均低于0,呈现了负增长趋势。虽然在砷环境下上涨的种群比在无砷环境下生长的种群更加适应高砷环境,但是在超过某个浓度限度之后就会呈现负增长趋势,以至于导致种群的消失甚至灭亡。过高的污染浓度会对浮游动物的生理指标造成影响,林汝榕等检测中华哲水蚤氨基酸含量的变化作为生理指标,证实低浓度重金属对动物有刺激效应,能使其活动加强,氨基酸含量明显提高,浓度提高则产生抑制效应 [16] 。
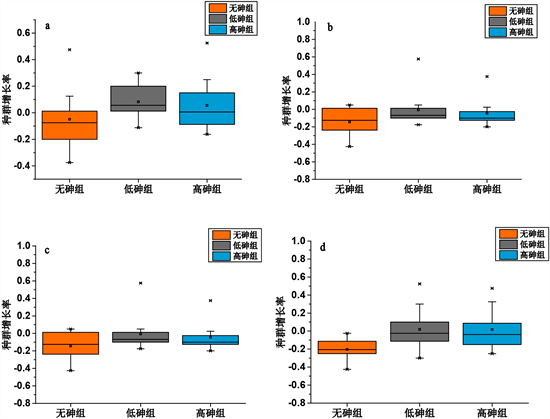 (图(a)~(d)依次为200 μg/L,250 μg/L,300 μg/L,350 μg/L四个砷浓度下的种群增长率箱线图)
(图(a)~(d)依次为200 μg/L,250 μg/L,300 μg/L,350 μg/L四个砷浓度下的种群增长率箱线图)
Figure 6. Box plot of population growth rate
图6. 种群增长率箱线图
对比低砷(50 μg/L)和高砷(150 μg/L)选择下的种群发现,不同砷浓度下的环境选择对螺形龟甲轮虫进化能力影响较小,其都能在高浓度200 μg/L下适应且其增长率之间无显著差异,在超过300 μg/L之后,也均出现了负增长的情况。
4. 结论
1) 在不同砷浓度下,无砷组种群的出生率几乎为0,而低砷组和高砷组的出生率均值在200 μg/L的砷浓度下分别为0.22和0.29;在250 μg/L的砷浓度下分别为0.13和0.26;在350 μg/L的砷浓度下分别为0.13和0.08;在350 μg/L的砷浓度下为0.19和0.18。由此可见,在砷污染环境下选择的种群与原始没有污染的种群,面对有砷环境时,有砷污染历史的种群能更好适应环境的污染,其出生率比没有污染历史的种群高10%~20%左右。
2) 无砷(0 g/L)、低砷(50 g/L)、高砷(150 g/L)三个种群在200 μg/L的砷浓度下死亡率均值分别为0.12、0.08和0.04;250 μg/L的砷浓度下死亡率均值分别为0.13、0.12和0.04;300 μg/L的砷浓度下死亡率分别为0.16、0.06和0.07;350 μg/L的砷浓度下死亡率分别为0.169、0.09和0.05。无砷环境下选择的种群死亡率是高于低砷和高砷环境下生长的种群,说明有砷污染背景的种群能提高种群对砷污染物的耐受能力,减少死亡率。
3) 在砷环境选择下的螺形龟甲轮虫种群对砷酸钠产生了适应进化,主要表现为提高种群出生率和降低种群的死亡率,进而维持了种群在有砷环境下的续存。在不同砷浓度下选择进化并不影响螺形龟甲轮虫的进化效果,无论是在低砷(50 g/L)还是高砷(150 g/L)环境中选择的螺形龟甲轮虫种群,均对砷环境产生了适应进化,因此说明砷浓度不影响进化效果。
5. 不足与讨论
不同的浮游动物物种,对污染物的耐受性也不尽相同,轮虫的个体较小,世代时间短,在短时间内可以繁殖多代以不断调整适应进化。而枝角类桡足类的机理尚不明确,可能还需要类似的实验进行检验说明。
该实验只是验证了在环境砷浓度下生活的螺形龟甲轮虫是否产生了进化,只停留在生活史参数,并未探索到生理指标方面考察具体是因为什么生理指标的变化导致的。