1. 引言
2022年国家肿瘤中心数据显示,我国有482万癌症新发病例及321万死亡病例 [1] ,每天有超过1万人确诊癌症,而且数字至今一直在上升,因此迫切需要寻找新型抗肿瘤治疗手段。近年来,声动力疗法(Sonodynamic Therapy, SDT)被越来越多的科研人员关注,SDT是先将声敏剂富集在肿瘤处,用低强度的超声波激活肿瘤处的声敏剂,促使激发态的声敏剂与肿瘤组织附近的氧气作用产生多种活性氧物质(Reactive Oxygen Species, ROS)。此外,超声波引起的空化效应也会使系统产生ROS,进而损伤肿瘤细胞的DNA、蛋白质、脂质等内源性物质,最终诱导细胞凋亡 [2] [3] 。因而,提高SDT的效用、寻找具有良好声动力活性的声敏剂并合理使用对SDT的临床应用具有重要意义。
纳米金颗粒(Gold Nanoparticles, GNPs)是近年来研究较多的纳米材料,具有许多在生物医学中应用的特性,如良好的生物相容性、无毒副作用等。目前制得GNPs的方法主要是通过还原氯金酸、改变还原剂的种类及浓度即可改变GNPs的粒径,因而GNPs还具有粒径形状易控性的特点 [4] 。除此之外,GNPs因其较好的声敏性和抗肿瘤活性,常被用作声敏剂,在SDT中展示出优秀的效果,近年来已被广泛应用于抗肿瘤研究之中。人血清白蛋白(Human Serum Albumin, HSA)是人体血浆中最主要的蛋白质,约占血浆总蛋白的60%,螺旋结构较高,在维持机体营养与渗透压、运输内源及外源物质以及其他生理功能的调节中起着关键性作用 [5] [6] [7] 。当HSA因外源性因素而活性降低或数量减少时,机体会出现乏力食欲降低、水肿、贫血、免疫力下降等症状,更有甚者会有恶心、呕吐、体力下降等症状 [8] 。因此,探究当GNPs作为声敏剂杀伤肿瘤细胞过程中产生的副作用对HSA的损伤程度显得十分重要。
本论文主要探究GNPs在超声照射下对HSA分子所造成的损伤情况,并在此基础上考察了GNPs浓度、超声功率的影响因素。其次,又探究了上述GNPs声动力损伤HSA过程的机制。希望本研究能对GNPs高效应用于SDT治疗肿瘤有所帮助。
2. 实验
2.1. 仪器与试剂
紫外–可见分光光度计(UV-2550型,日本岛津公司);荧光光谱仪(F-7000型,日本日立公司);超声装置(苏州工业园区海纳科技有限公司);四水氯金酸(国药集团化学试剂有限公司);柠檬酸三钠(天津市致远学试剂厂);浓硝酸(沈阳经济技术开发区试剂厂);浓盐酸(沈阳经济技术开发区试剂厂);人血清白蛋白(北京博奥拓达科技有限公司);1,3-二苯基异苯并呋喃(上海麦克林生化试剂有限公司);其它试剂均为市售分析纯,实验用水为双蒸水。
2.2. GNSs的制备
实验开始前用王水处理实验过程中所用到的所有玻璃仪器,王水处理1 h,然后用自来水洗一遍,再用蒸馏水洗一遍,放入恒温为60℃的烘箱烘1 h。配置质量分数为0.01%的氯金酸溶液和质量分数为1%的柠檬酸钠溶液,用量筒称取200 mL氯金酸(0.01%),倒入250 mL圆底烧瓶,并放入转子,冷凝回流条件下,用数显智能控温磁力搅拌器油浴加热,磁力搅拌器转速设置为200 r/min,温度以每10℃递增,当温度超过100℃时,以每5℃递增加热至沸腾。此时,向圆底烧瓶迅速加入2 mL柠檬酸钠(1%),观察颜色从浅黄色至紫黑色,最后变成红色后,再加热18 min,移走热源后放置室温冷却,放在4℃冰箱遮光保存 [9] 。
2.3. GNSs浓度对其声动力损伤HSA的研究
取5个25 mL容量瓶标记为a~e,分别向其中加入10 mL浓度为2.5 × 10−5 mol/L的HSA溶液,a为空白组,向b~e中分别加入1.25 mL、1.50 mL、2.50 mL、5.0 mL的GNSs溶液,用PBS缓冲液稀释至刻度,配成浓度分别为0.00、0.25、0.30、0.50、1.00 × 10−2 g/L的GNSs溶液。将上述溶液平均分成两份,一份置于单杯培养皿中,在频率为0.5 MHz、功率为0.16 W/cm2的条件下进行避光超声2 min,另一份于暗处放置同样时间。超声结束后分别测定荧光光谱,激发波长280 nm,狭缝均为5 nm,扫描波段范围200~800 nm,考察GNSs浓度因素对HSA损伤的影响 [10] 。
2.4. 超声功率对GNSs声动力损伤HSA的研究
取4个25 mL容量瓶标记为a~d,分别加入10 mL浓度为2.5 × 10−5 mol/L的HSA溶液,用PBS缓冲液稀释至刻度,使HSA浓度为1.0 × 10−2 g/L。b~d则分别加入5.0 mL的GNSs溶液,用PBS缓冲液稀释至刻度,配成浓度为1.0 × 10−2 g/L的GNSs溶液。然后从容量瓶中分别取4 mL溶液置于单杯培养皿中,分别在频率为0.5 MHz、功率为0.08、0.16、0.24 W/cm2的条件下进行避光超声2 min。超声结束后分别测定荧光光谱,激发波长280 nm,狭缝均为5 nm,扫描的波段范围200~800 nm [10] 。
2.5. 超声联合GNSs损伤HSA机制研究
取2个25 mL容量瓶标记为a和b,分别加入10 mL浓度为2.5 × 10−5 mol/L的HSA溶液,然后向b中加入5.0 mL的GNSs溶液,最后用PBS缓冲液统一稀释至刻度。将上述溶液平均分成两份,一份置于暗处放置2 min,另一份置于单杯培养皿中,在频率为0.5 MHz、功率为0.24 W/cm2的条件下进行避光超声2 min,将处理后的样品进行紫外–可见光谱检测及同步荧光检测。
另取2个25 mL容量瓶标记为a和b,分别加入7.2 mL的单线态氧荧光探针1,3-二苯基异苯并呋喃(1,3-Diphenylisobenzofuran, DPBF)溶液(700 μmol/L),然后向b中加入5.0 mL的GNSs溶液,最后用去离子水统一稀释至刻度。a、b两瓶中分别取出7 mL样品置于单杯培养皿中,经由0.5 MHz、0.16 W/cm2超声照射。从a、b两瓶中另各取7 mL样品不超声,作为对照。2 min后,以无水乙醇作为空白参比测定所有样品溶液在415 nm处的吸光度 [11] 。
3. 结果与讨论
3.1. GNSs浓度对其声动力损伤HSA的研究
当光束照射到溶液中时,溶液中的分子能够吸收一定波长的光,经过能量积累后能发射出较长波长的光,这种发射出来的光即荧光,而这种能够产生荧光的物质被称为荧光物质。当荧光物质中加入另外一种物质,二者相互作用后,会发生荧光猝灭现象,即荧光物质的荧光强度明显降低,引起荧光猝灭的物质称为猝灭剂。当HSA与GNSs结合后,蛋白质分子的荧光会被GNSs猝灭 [12] 。
由图1可见,在超声照射条件下,随着GNSs浓度的增加,HSA的荧光强度有规律的降低。说明超声不仅可激活GNSs对HSA造成损伤,并且作用效果随GNSs浓度的增加而增强,很可能是因为GNSs浓度越大,被超声激活后产生的ROS越多,进而对HSA中荧光基团产生更大的破坏作用。

Figure 1. Fluorescence spectra of the effect of HSA by sonodynamic damage with GNSs concentration
图1. GNSs浓度对其声动力损伤HSA影响的荧光光谱
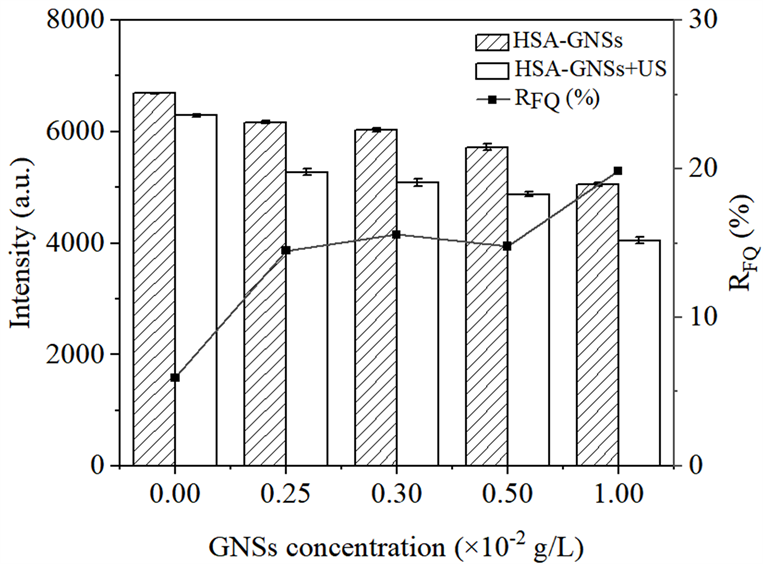
Figure 2. Changes of fluorescence intensity of HSA and HSA-GNSs system with GNSs concentration
图2. HSA和HSA-GNSs体系的荧光强度随GNSs浓度的变化
采用公式(1)计算荧光淬灭率 [13] 。
(1)
计算不同GNSs浓度时超声损伤HSA的相对荧光猝灭率(RFQ),式中F0表示未超声条件下HSA-GNSs体系的荧光强度,FU表示超声照射条件下HSA-GNSs体系的荧光强度。由图2可见,当GNSs浓度从0增加到1 × 10−2 g/L时,RFQ随着GNSs浓度的增加而增加,说明在超声照射条件下HSA的损伤程度随着GNSs浓度的增大而增强。同时,从图2中可以看出,在超声照射条件下,HSA-GNSs体系的荧光强度均低于同浓度未超声的条件下HSA-GNSs体系的荧光强度,证明超声加剧了GNSs对HSA分子的损伤。
3.2. 超声功率对GNSs声动力损伤HSA的研究
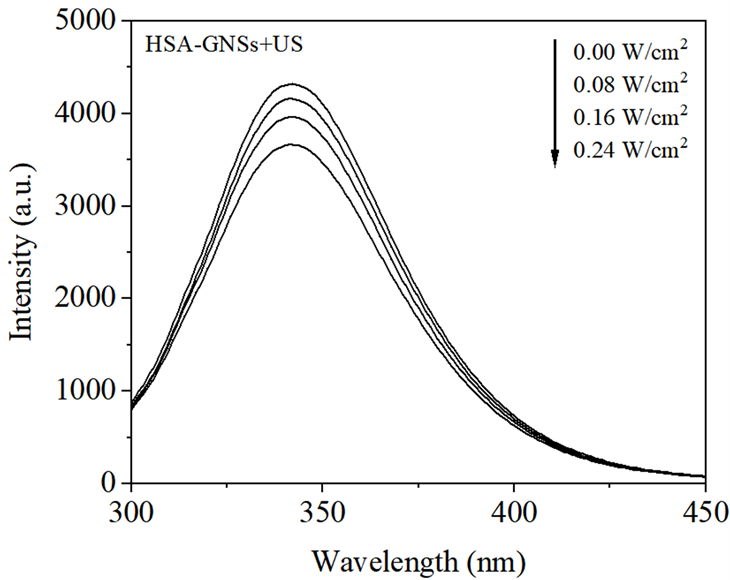
Figure 3. Fluorescence spectra of the effect of HSA by GNSs sonodynamic damage with ultrasonic power
图3. 超声功率对GNSs声动力损伤HSA影响的荧光光谱

Figure 4. Changes of fluorescence intensity of HSA and HSA-GNSs system with increasing ultrasonic power
图4. HSA和HSA-GNSs体系随超声功率增强的荧光强度变化
超声功率的改变对HSA-GNSs体系荧光强度影响如图3所示。由图3可见,在超声照射条件下,HSA-GNSs体系荧光强度随超声功率的增加而不断降低。从图4中可以看出,在超声照射条件下,HSA和HSA-GNSs体系的荧光强度都随着超声功率的增加而降低,且相同超声功率下,HSA体系的荧光强度始终大于HSA-GNSs体系的荧光强度。这是因为超声功率的增大不仅会导致体系中空化效应的增强 [2] ,同时促使更多的GNSs被激活,使体系中产生更多的ROS,进而加剧了对HSA分子中可产生荧光的氨基酸残基破坏程度,使其不再具有荧光性,最终导致HSA荧光强度随之降低。采用公式(1)计算HSA随超声功率改变时RFQ的变化,由图4可见,RFQ随着超声照射功率的增加而呈上升趋势,得出结论,超声与GNSs的协同作用对HSA分子的损伤随着超声功率的增加而加重。
3.3. 超声联合GNSs损伤HSA机制研究
从体系波长差Δλ = 15 nm和Δλ = 60 nm时分别扫描的同步荧光光谱图5和图6来看,HSA与GNSs混合溶液超声后损伤程度最大,其次是混合后不超声,损伤程度相对较小的是HSA单独超声。
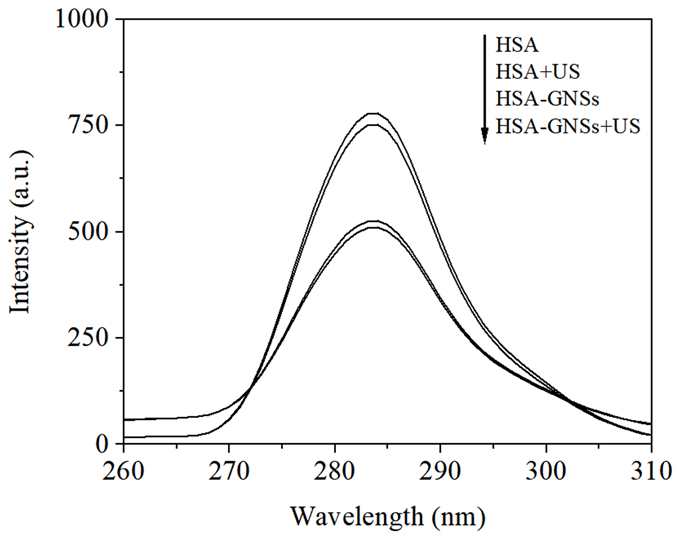
Figure 5. Synchronous fluorescence spectra of HSA under different conditions (Δλ = 15 nm)
图5. 不同条件下HSA的同步荧光光谱图(Δλ = 15 nm)
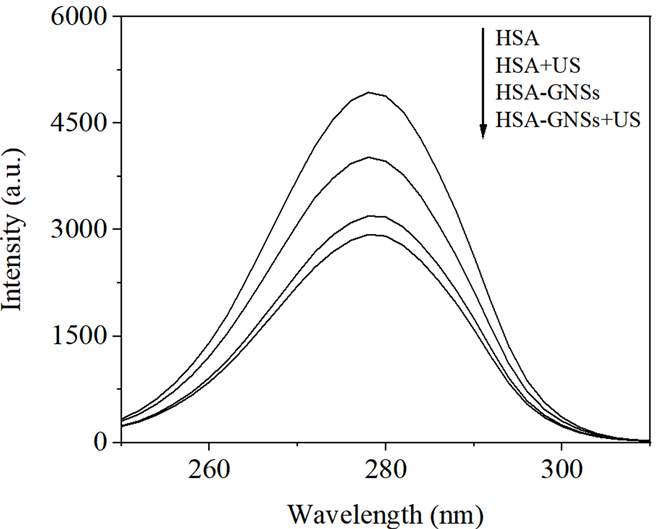
Figure 6. Synchronous fluorescence spectra of HSA under different conditions (Δλ = 60 nm)
图6. 不同条件下HSA的同步荧光光谱图(Δλ = 60 nm)
为进一步探讨产生上述现象的原因,检测了体系中产生的ROS。ROS是氧分子的不完全还原产物,包括超氧负离子、过氧化氢和羟基自由基等。ROS的过量蓄积会引起多种人体疾病的发生,如癌症,ROS具有相对矛盾的功能,正常细胞存活需要合适且稳定的ROS浓度,而ROS异常积累会导致正常细胞向恶化转变,过多的ROS会破坏细胞内物质如DNA、蛋白质和脂质等,从而使细胞死亡 [14] 。由于ROS活性高,半衰期较短,目前能够直接对ROS进行检测的方法非常有限。本研究利用ROS高反应活性与单线态氧探针DPBF反应,并基于DPBF的改变间接对ROS做出定量或定性分析 [15] 。DPBF是一种常用的1O2指示荧光探针,在415 nm处具有特征吸收峰。当溶液中有1O2存在时,DPBF将与其反应,导致ROS形成过氧化物并且DPBF分解成为1,2-联苯甲酰苯,该过程不可逆转,会使DPBF位于415 nm处的吸收峰逐渐减弱。因此,使用紫外–可见分光光度计检测DPBF在415 nm处吸收强度的变化,可以检测溶液中1O2含量的变化 [16] 。
从图7看出,当超声功率为0.16 W/cm2,随着GNSs浓度从0增加到1.0 × 10−2 g/L时,DPBF的吸光强度呈下降趋势,说明超声照射条件下,GNSs浓度增加将引起HSA-GNSs体系中ROS含量增加,进而损伤HSA活性。这与图1得到的结论一致,在超声照射条件下,HSA-GNSs体系中HSA的损伤程度随着GNSs浓度的增加而增加。从图8可以看出,当GNSs浓度为1.0 × 10−2 g/L,超声功率由0 W/cm2向0.24 W/cm2递增时,DPBF的吸收强度呈阶梯式下降,即说明HSA-GNSs体系中ROS含量增加,表明超声照射下GNSs对HSA的损伤程度随着超声功率的增大而增强。
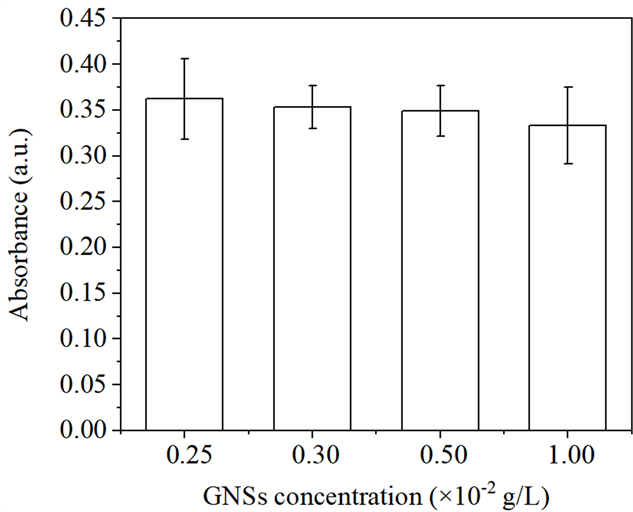
Figure 7. Effect of ROS yield of ultrasound system under GNSs concentration
图7. GNSs浓度对超声体系中ROS产量的影响
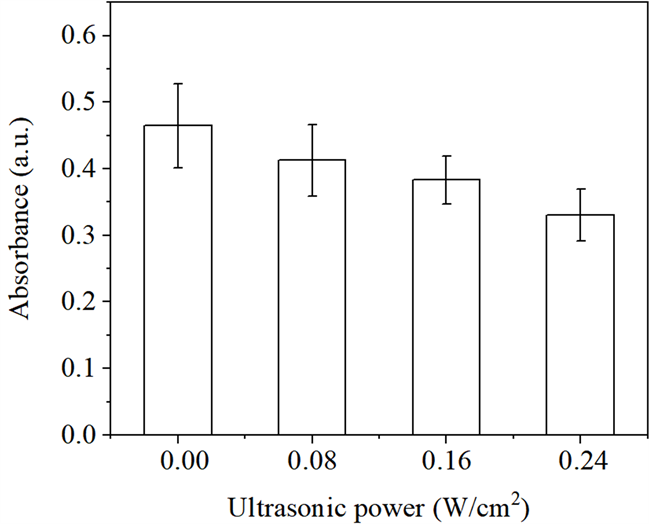
Figure 8. Effect of ROS yield of ultrasound system with ultrasonic power
图8. 超声功率对超声体系中ROS产量的影响
4. 结论
本研究借助紫外–可见光谱法、荧光光谱法等手段,考察了超声照射下GNSs对HSA分子活性的损伤,探究了GNSs浓度和超声功率对HSA的影响。结果表明,在频率为0.5 MHz、超声功率为0.16 W/cm2的条件下,随着GNSs浓度从0~1.0 × 10−2 g/L逐渐增加,HSA的损伤程度逐渐加重;在GNSs浓度为1.0 × 10−2 g/L的条件下,随着超声频率从0~0.24 W/cm2逐渐增加,HSA的损伤程度逐渐加重。进一步探究其作用机制,发现GNSs浓度增加和超声频率的增大将导致ROS含量的过度蓄积,损伤HSA内源性物质,从而导致活性降低甚至HSA的凋亡,该研究对于从分子水平上研究纳米金合理应用于杀伤肿瘤细胞具有重要意义。
基金项目
本文由辽宁大学“大学生创新创业训练计划项目”(X202310140074)资助。
NOTES
*通讯作者。