1. 引言
在《普通高中化学课程标准》(2017年版2020年修订)中提出:化学学科核心素养的水平应达到能对复杂的化学问题情境中的关键要素进行分析以建构相应的模型 [1] 。发展学生建模能力是我国新一轮课程标准中化学学科核心索养“证据推理与模型认知”的重要组成部分。提高学生建模能力,发展学生化学学科核心素养是至关重要的 [2] 。模型是对认识对象所作的一种简化描述 [3] 。在理解化学反应理论模型的基础上,自主地再次建构理论模型的表征模型,形成解答问题的思路模型,使本来复杂的问题变得有规律可循 [4] 。模型的表征形式越形象、直观、容易套用,对理解抽象概念的帮助越大。模型的构建和使用是形成科学思维的重要途径,使疑难问题简单化、抽象问题具体化,不仅可以提高学生学习化学的兴趣,还有利于学生创新精神的培养 [5] 。本文提出一种“敬礼”模型,即能反应的两种微粒在模型中正好处于左上角和右下角的相对位置角度,是右手“敬礼”的角度关系,所以形象地称之为“敬礼”模型,位置关系符合右手“敬礼”模型的能反应,否则不能反应。经过多年的实践教学研究,该模型的建立不仅解决了中学化学中知识点极易混淆的复分解反应,而且进一步将其应用在氧化还原反应中,结论准确,模型精确,学生对化学知识的学习兴趣得到了极大的提升,方便了学生的理解记忆。
2. 问题的提出
复分解反应是化学四大基本反应类型之一。反应前后化合价不变,仅仅是原子或原子团发生的重新组合。相对反应物来说,如果生成物是原子或原子团相结合成更稳定的形式,那么原子或原子团就会发生重新组合,该复分解反应就能够发生。
常见的复分解反应类型有:① 氢离子与氢氧根离子重新组合成水;② 酸或酸式根电离出来的氢离子与其他物质电离出来的弱酸根离子或弱酸酸式根离子重新组合成更弱的酸或弱酸酸式根离子;③ 碱电离出来的氢氧根离子与其他物质电离出来的弱碱阳离子组合成更弱的碱;④ 一种物质电离出来的阴离子与另一种物质电离出来的阳离子组合成难溶的物质。
其中第②种类型——重新组合成更弱的酸。首先我们需明确这里的酸的定义是广义化的酸,不局限于酸分子——所有给出氢离子的微粒都是酸,对应的剩余部分叫做盐;所有结合氢离子的微粒都是盐,结合氢离子对应的产物叫做酸。其次第②种类型——重新组合成更弱的酸,这种反应类型实质上是氢离子与弱酸根离子或弱酸酸式根离子的重新组合,氢离子可能来自于强酸分子,也可能来自于弱酸分子,还可能来自于酸式盐中的酸式根离子,所以这种类型的反应在生产生活中更为普遍;同时弱酸酸式根离子可能是给出氢离子做反应物,也可能是重新组合的产物,弱酸酸式根离子的这种双重角色更是解题需要考虑的细节,部分学生按照基本原理和常规思路进行分析解答这种类型的反应时,表现出费时费力绕晕弄反,从而出现为难情绪。能反应的两种微粒在模型中正好处于左上角和右下角的相对位置角度,是右手“敬礼”的角度关系,所以形象地称之为“敬礼”模型,位置关系符合右手“敬礼”模型的能反应,否则不能反应。
例如:在高中化学教学中常常遇到下面这种题型:
已知下表数据:
请写出下列反应的化学反应方程式:
① Na2CO3溶液中通入少量SO2_____________________________________
② Na2CO3溶液中通入过量SO2_____________________________________
③ Na2SO3溶液中通入少量CO2_____________________________________
④ Na2SO3溶液中通入过量CO2_____________________________________
⑤ NaHCO3溶液中通入SO2________________________________________
⑥ NaHSO3溶液中通入CO2________________________________________
⑦ NaHSO3溶液与NaHCO3溶液混合________________________________
这组题涉及的化学反应原理是易溶盐 + 较强酸→易溶盐 + 较弱酸的复分解反应原理,其反应实质是较弱酸的生成,只有当反应物中酸的酸性强于生成物中酸的酸性时,反应才能发生。
该组题目的难度在于反应涉及的两种酸均为多元弱酸,一方面酸根结合H+的时候,是一个一个结合的,同样酸分子给出H+的时候,也是一个一个给出去的。同时题目涉及到少量过量问题,需明确判断是哪一种物质要夺取结合哪一种物质的H+,该结合自己的第几个H+,要夺取的是别人的第几个H+。接下来,还必须搞明白:
能否夺取H2SO3的第一个H+变成
,
能否夺取H2SO3的第二个H+ (即
的H+)变成
;
能否夺取H2SO3的第一个H+变成H2CO3,
能否夺取H2SO3的第二个H+ (即
的H+)变成H2CO3;反过来,
能否夺取H2CO3的第一个H+变成
,
能否夺取H2CO3的第二个H+ (即
的H+)变成
,
能否夺取H2CO3的第一个H+变成H2SO3,
能否夺取H2CO3的第二个H+ (即
的H+)变成H2SO3;这些都取决于H2SO3、H2CO3、
、
四种微粒酸性的相对强弱,取决于它们的电离平衡常数的相对大小。学生在具体书写每个反应方程式时,还要先明确需要判断比较的是哪一种酸的第几步电离平衡常数,该组题目的另一个难度在于两种酸的逐级电离平衡常数大小关系(即酸性强弱)彼此交错
,部分学生按照基本原理和常规思路进行分析解答时很容易混淆而出错。该类题目的处理方式教师仅是按照课本的方法讲授,没有一个很好的解决办法,因此,学生在遇到此类问题表现出为难情绪,思维能力弱的学生甚至在判断酸式盐在不同反应中究竟是酸还是盐的时候表现出没有耐心而放弃思考。
3. 解题策略
对“较强酸 + 较弱酸对应的易溶盐→较弱酸 + 较强酸对应的易溶盐”的反应原理,构建更为直观的表征模型——“敬礼”模型,降低理论分析压力,使解题又快又准。
3.1. “敬礼”模型的构建思路
以一元酸CH3COOH与一元酸HClO之间的相关反应为例进行说明。
第一步:排序。将反应所涉及的逐级酸电离出H+的能力从大到小排序并用大于号连接。然后将每种酸失去一个H+后对应的酸根离子上下对齐,书写在酸的下方,并用小于号连接,这实际上是酸根离子结合H+能力从小到大的排序。
记录为:酸电离出H+的能力:CH3COOH > HClO
酸根离子结合H+能力:CH3COO− < ClO−
第二步:标识及判断。
标识:找到反应物涉及的酸和酸根,将他它们用短线相连,如CH3COOH与NaClO反应标识如下。
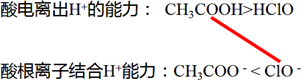
判断:若被标识的两种物质如CH3COOH和ClO−这样分布在两行且处于左上角和右下角的相对位置关系,则符合强强能反应,同时上下对应对齐的物质就是生成物,反应方程式为:
CH3COOH + ClO− = CH3COO− + HClO,与用原理分析书写出来的方程式完全吻合相一致。
左上角和右下角的位置角度关系刚好是右手“敬礼”的角度关系,所以形象地称之为“敬礼”模型,位置关系符合(右手)“敬礼”模型能反应,否则不能反应,如CH3COO−和HClO的位置关系不符合(右手)“敬礼”模型,二者之间不能反应。与用原理分析书写出来的方程式完全吻合相一致。

对于涉及多元酸的反应,若被标识的“敬礼”斜线两端的物质的位置关系左右紧邻,中间没有相隔,则上下对应对齐的物质就是生成物;若以标识物质为边界的矩形区域内有相应的逐级酸,则产物除了为上下对应对齐的物质这种情况之外。还会存在反应物少量过量问题,此时谁过量产物就选靠近谁的且在以标识物质为边界的矩形区域内的相关对应物质。
例如:已知下表数据写出Na2S和H2CO3的反应方程式
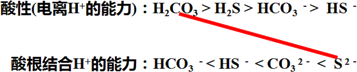
Na2S和H2CO3的反应方程式为:
Na2S + H2O + CO2 = NaHCO3 + NaHS (产物是上下对应对齐的物质)
Na2S + 2H2O + 2CO2 (过量) = 2NaHCO3 + H2S (产物是区域内上下对应靠近H2CO3的物质)
2Na2S (过量) + H2O + CO2 = Na2CO3 + 2NaHS (产物是区域内上下对应靠近S2−的物质)
这些都与用原理分析书写出来的方程式完全吻合相一致。
综上,敬礼模型可以直观表征出强酸制弱酸复分解反应的反应过程以及反应物和生成物,以免去具体强弱关系的繁杂比较和判断。
3.2. “敬礼”模型的运用
“敬礼”模型的运作需要两步:排序(各类酸酸性由大到小排序→上下对齐写失去一个氢离子后的剩余部分,用“<”连接)→标识敬礼方向,判断出结论。
例1:一元酸与多元酸
已知下表数据:
请写出下列反应的化学反应方程式
① NaClO溶液中通入少量CO2_____________________________
② NaClO溶液中通入过量CO2_____________________________
③ Na2CO3溶液和HClO___________________________________
④ NaHCO3溶液和HClO__________________________________
第一步:排序。根据电离常数越大,酸性越强。
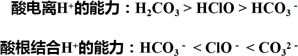
第二步:标识及判断。
① NaClO溶液中通入少量CO2_____________________________
② NaClO溶液中通入过量CO2_____________________________

被标识的H2CO3和ClO−的位置关系符合“敬礼”模型,反应可以发生,且H2CO3和ClO−的位置关系左右紧邻,中间没有间隔隔,也就不存在反应物少量过量问题,上下对应对齐的物质就是生成物,所以二者的反应方程式只有一个NaClO + CO2 + H2O = NaHCO3 + HClO,①②两题的答案都是这个。与用原理分析书写出来的方程式完全吻合相一致。
③ Na2CO3溶液和HClO___________________________________

被标识的HClO和
的位置关系符合“敬礼”模型,反应可以发生,且H2CO3和ClO−的位置关系左右紧邻,中间没有间隔隔,也就不存在反应物少量过量问题,上下对应对齐的物质就是生成物,所以二者的反应方程式为Na2CO3 + HClO = NaHCO3 + NaClO,与用原理分析书写出来的方程式完全吻合相一致。
④NaHCO3溶液和HClO__________________________________

被标识的HClO和
的位置关系不符合右手“敬礼”模型,反应不能发生。与用原理分析书写出来的方程式完全吻合相一致。
例2:多元酸与多元酸
已知下表数据:
请写出下列反应的化学反应方程式
① Na2CO3溶液中通入少量SO2____________________________________
② Na2CO3溶液中通入过量SO2____________________________________
③ Na2SO3溶液中通入少量CO2___________________________________
④ Na2SO3溶液中通入过量CO2____________________________________
⑤ NaHCO3溶液中通入SO2_______________________________________
⑥ NaHSO3溶液中通入CO2_______________________________________
第一步:排序。根据电离常数越大,酸性越强。

第二步:标识及判断。
① Na2CO3溶液中通入少量SO2__________________________________
② Na2CO3溶液中通入过量SO2__________________________________

被标识的H2SO3和
的位置关系符合“敬礼”模型,反应可以发生;但以H2SO3和
为边界的矩形区域内有相应的逐级酸,所以产物除了上下对应对齐的物质的情况之外,还会存在反应物少量过量问题,此时谁过量产物就选靠近谁而且在以H2SO3和
为边界的矩形区域内的相关对应。
所以Na2CO3溶液和SO2的反应方程式为:
Na2CO3 + H2O + SO2 = NaHCO3 + NaHSO3 (产物是上下对应对齐的物质)
2Na2CO3 + H2O + SO2 (少量) = 2NaHCO3 + Na2SO3 (产物是区域内上下对应靠近
的物质)
Na2CO3 + H2O + 2SO2 (过量) = 2NaHSO3 + CO2↑ (产物是区域内上下对应靠近H2SO3的物质),与用原理分析书写出来的方程式完全吻合相一致。
③ Na2SO3溶液中通入少量CO2__________________________________
④ Na2SO3溶液中通入过量CO2__________________________________
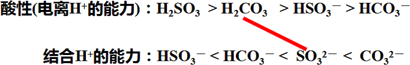
被标识的H2CO3和
的位置关系符合“敬礼”模型,反应可以发生,且H2CO3和
的位置关系左右紧邻,中间没有间隔,也就不存在反应物少量过量问题,上下对应对齐的物质就是生成物,二者的反应方程式只有一个Na2SO3 + CO2 + H2O = NaHCO3 + NaHSO3,③④两题的答案都是这个。
⑤ NaHCO3溶液中通入SO2________________________________________
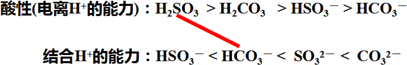
被标识的H2SO3和
的位置关系符合“敬礼”模型,反应可以发生,且H2SO3和
的位置关系左右紧邻,中间没有间隔,也就不存在反应物少量过量问题,上下对应对齐的物质就是生成物,所以⑤题的反应方程式为NaHCO3 + SO2 = NaHSO3 + CO2,与用原理分析书写出来的方程式完全吻合相一致。
⑥ NaHSO3溶液中通入CO2________________________________________
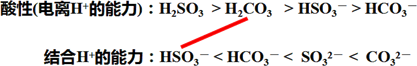
被标识的
和H2CO3的位置关系不符合右手“敬礼”模型,反应不能发生。与用原理分析书写出来的方程式完全吻合相一致。
本人将此敬礼表征模型运用于多年的课堂教学中,收到了非常理想的教学效果:1. 模型比较简单,学生很容易听懂,也愿意主动画出。2. 每当遇到复分解型的酸盐反应时,学生都能积极主动运用这种方法,无论多复杂的酸盐组合,学生都能在较短的时间内作出答案,且不用花费耗神耗力的抽象思维,最终取得巨大成就感。
4. “敬礼”模型的迁移应用
“敬礼”模型,还可以用在氧化还原反应中:


应用一:“敬礼”模型可以帮助我们判断反应能否发生以及反应的产物并直接书写方程式:2Al + 3Cu2+ = 2Al3+ + 3Cu;Fe3+ + 2I- = Fe2+ + I2。
应用二:“敬礼”模型可以帮助我们很快地合理选择氧化剂、还原剂。
如:(1) Fe→Fe2+可以选择Sn2+、Pb2+、H+、Cu2+、Fe3+、少量Ag+;I2、S…
(2) Fe2+→Fe3+可以选择的试剂除了浓H2SO4、HNO3、KMnO4、Na2O2等以外,还可以选择Ag+、F2 (非水环境)、Cl2、Br2

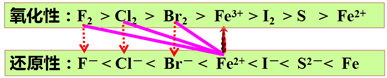
(3) Fe→Fe3+可以选择的试剂除了浓H2SO4、HNO3、KMnO4、Na2O2等以外,还可以选择Ag+、F2 (非水环境)、Cl2、Br2
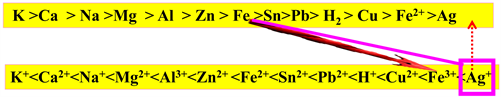
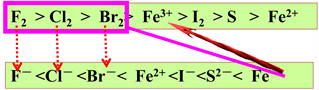
Fe3+→Fe2+、Fe2+→Fe、Fe3+→Fe试剂的选择方法都可以利用这个模型。
本人将此敬礼表征模型运用于多年的课堂教学中,收到了非常理想的教学效果:1. 模型比较简单,学生很容易听懂,也愿意主动画出。2. 每当遇到复分解型的酸盐反应时,学生都能积极主动运用这种方法,无论多复杂的酸盐组合,学生都能在较短的时间内作出答案,且不用花费耗神耗力的抽象思维,最终取得巨大成就感。3. 每当分析置换反应以及分析FeBr2与Cl2、FeI2与Cl2等反应时,学生都会快乐地使用氧化还原反应的敬礼模型。敬礼表征模型尤其适合思维能力不是很强的学生,尤其中等以下的学生,帮助这些学生重新树立做题信心,并形成“办法总比困难多”观念,遇到问题,能积极主动想办法,通过感受模型的魅力,主动建构模型简化复杂问题。
5. 结论
经过多年的实践研究,敬礼表征模型可以将复杂的知识简单化,培养学生的逻辑思维能力。学生在遇到问题时,仅需要先进行排序,进而标识及判断,符合模型则反应可以发生,并直接写出化学反应方程式,提高了学习效率。总之,建构一个有思维灵魂、简单直观明了、实用性强的模型,可以帮助学生体验科学模型建构过程,同时能更有效地帮助学生理解物质现象和化学过程。
NOTES
*通讯作者。