1. 引言
正在进行的严重急性呼吸系统综合征SARS-CoV-2大流行,清楚地说明了传染性的潜力疾病继续在全国范围内造成重大感染和死亡,外界也还关注了其活动性感染后病原体诱导的死亡率的重要性 [1] [2] ,即感染后死亡率(下文称为“PIM”)。因此,为了了解严重急性呼吸系统综合征SARS-CoV-2的潜在未来动态,表征PIM对流行病动态的影响很重要。在更广泛的背景下,目前对严重急性呼吸系统综合征SARS-CoV-2的PIM观察是研究感染对宿主的长期影响的更广泛的工作的一部分。早期的历史研究结果表明,生命早期遇到的病原体 [3] ,由于空气传播,后期死亡率升高。尽管这些影响很普遍,但流行病学模型通常只包括感染阶段的毒力,而忽略PIM。
一般来说,PIM可以通过至少两种生物机制出现。首先,病原体可能会造成损害,但在活跃感染期间不会导致宿主死亡,但最终会导致缩短宿主寿命的其他影响(与从未感染的易感个体相比)。例如,SARS-CoV-2感染的许多其他长期并发症,如心血管问题 [4] ,表明了恢复后死亡率增加的潜在机制。其他导致长期影响的病原体的例子如下,从感染恢复范围由人乳头瘤病毒(HPV)引起癌症 [5] ,到可能导致多重感染的爱泼斯坦–巴尔病毒硬化 [6] 。最近的研究表明,麻疹感染引起的免疫调节随之增加对其他疾病的易感性 [7] 。反过来,这些后果增加了PIM发生的可能性。
其次,为了成功清除感染病原体,宿主可能会不成比例地分配资源,以发动强大的免疫反应。这可能会导致其他后果,与那些从未感染过的易感个体相比,增加了感染后的死亡率。例如,寄生线虫感染可以触发白细胞介素33 (IL-33)的释放,作为一种防御机制 [8] 。反过来,IL-33可能与炎症性肠病有关,并可能导致寿命缩短。相关的权衡也被用来理解免疫系统的进化出现。这两种机制都非常普遍,因此PIM有相当大的潜力成为感染的常见结果。
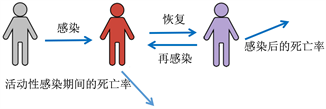 (a) 模型框架中包含的流行病学过程的示意图
(a) 模型框架中包含的流行病学过程的示意图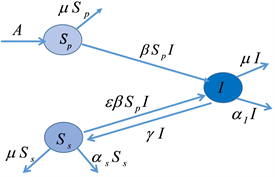 (b) 模型流程图与每个隔间的进出率
(b) 模型流程图与每个隔间的进出率
Figure 1. Formulation of epidemiological model with PIM
图1. 用PIM方法建立流行病学模型
虽然存在大量的流行病学建模文献,其中包括宿主在活动性感染期间的死亡率(通常被称为“毒力”) [9] 。研究者制定并分析了一个在感染和康复中具有额外死亡率的模型(完全免疫)状态,一旦宿主免疫力减弱,个体恢复到完全易感状态,没有额外的死亡率。最近的模型包括缓冲的易感性研究表明,免疫的强度对流行病动态的影响至关重要 [10] 。特别是,简单的流行病学模型揭示了亲属对后续感染的易感性(一旦一段时间的完全自然免疫或疫苗免疫减弱)可以控制中期流行轨迹。因此,一个关键问题是通过降低对再感染的易感性来确定PIM与宿主免疫之间潜在相互作用的流行病学影响。
本文研究了PIM对流行病动力学的影响。我们还研究了如果存在宿主免疫反应(减少恢复后再次感染的可能性)或在活动性感染期间存在疾病引起的更多感染时出现的相互作用。为了实现这一点,我们利用了一个嵌入PIM的简单模型,即缓冲敏感性以及活动性感染期间疾病引起的死亡率。研究表明,除非获得性免疫非常强大,否则PIM本身和感染期间的毒力都具有很强的不稳定作用。
2. 模型框架
如图1,为了提炼PIM对流行病学动态的影响,我们使用一个数学模型来区分从未感染易感人群和哪些易感个体以前被感染过,如图1(a)。
在我们的模型中,招募的个体(通过出生和免疫迁移,以恒定的速率
)首先是从未感染(和完全)易感(
)。通过成功感染,它们成为感染性(I),并以
的速率恢复到“次级”易感类(
)。在此阶段,PIM发生的速率是
。恢复后,个体对(再)感染的相对易感性为
,其中
。因此,如果感染使人对再次感染产生一定的免疫力,则
。另一方面,如果恢复后无免疫反应,则为
。
表示活动性感染期间的感染致死率,
表示人口死亡率。我们的模型如图1(b)所示,公式如下:
(2.1a)
(2.1b)
(2.1c)
因为总人口:
由此得出:
(2.2)
任意三个
,I,
和N方程决定了系统的动力学。
3. 流行病动力学
在模型(2.1)中,可以清楚地看到,存在一个无病平衡
与
和
。因为只有一个受感染的隔室,所以重新排列
给出了基本繁殖数
为
(3.1)
在生物学上,由于
是没有疾病时的人口(种群)规模,
表示新感染的人数,每一次在完全易感人群中。
为感染个体在I类中停留的平均时间。因此,
是完全易感人群中新感染的平均人数。注意,该模型中的
不依赖于PIM(
)。直观地说,与流行病学的区室模型一样,
是一个关键的流行病学阈值。若
,则
是局部渐近稳定的。另一方面,如果
,
是不稳定,且有一个独特的地方性平衡
。
a) 地方均衡特征
相关材料中给出了
、
和
的地方值的显式公式。为了更好地理解PIM如何影响流行病动态,我们研究了模型中的流行病状态如何随PIM变化。我们发现未感染易感物的平衡值
是PIM的一个递增函数。相比之下,传染性和以前感染的易感个体的平均值
和
,随着PIM的增加而降低。
我们说明了对于免疫
的不同稳健性,
、
和
如何随着
的增加而变化(图S1A-S1C),传播率(图S1D-S1F)和活动性感染期间疾病引起的死亡率(图S1G-S1I)。在各种情况下,
增加,最终随着PIM的增加而减少(图S1A、S1D和S1G)。与此同时,虽然
随着PIM的增加而降低,但它似乎最终也会减少(图S1B、S1E和S1H)。其他宿主和病原体特征对
对PIM依赖性的影响尚不清楚,这可以通过其他疾病参数内部和之间的比较来说明(图S1C、S1F和S1I)。因此,在人口水平上的易感性景观关键取决于PIM的程度。此外,随着PIM的增加,这种易感性景观如何变化取决于免疫的稳健性、病原体传播水平和活动性感染期间疾病引起的死亡率程度。
在PIM不存在的情况下,即
,模型(2.1)中的地方性均衡无论何时存在,都是局部渐近稳定的。因此,从长期来看,流行病学轨迹达到了这个值。
b) 感染后死亡率可诱发流行病周期
如果PIM发生,即
,则确定局部平衡的稳定性更为复杂,并且可以对局部平衡下
、I和N方程的雅可比矩阵的特征值进行数值计算。为了测定PIM对流行病动态的影响,我们开始的分析是通过检查恢复后没有免疫力的极限情况,即
,类似于SIS模型(特别是,如果没有PIM [即
]模型简化为SIS模型[通过设置
]),我们先假设在活动期间没有死亡感染(
)。对于其他参数,我们取恢复速率
周,即感染持续一周,以及
年。最后,我们假设吸收率
的大小等于
。为了解释,最后一个假设意味着状态变量
、
、
和
,表示这些类别中相对于初始(无病)人群规模的人口比例。因此,传输速率
在大小上近似等于
。
图2:
、
和
时间序列的示例说明,用于不同传输速率
和不同PIM速率
下PIM可能产生的周期性行为。因为
和
,
。对于图(a, c, e)和(g),我们模拟600年,第一周有
,
,
,我们绘制400周(52) + 1至600周(52)。图(b, d, f)和(h)给出了不同PIM
值下关于地方性平衡的
,I和N方程的雅可比矩阵的复共轭值的一对特征值。这些图中的“星号”符号对应于相应的先前图中使用的
值。在所有四个面板中,
和
。
图2说明了实际参数值与PIM的潜在流行病学动态。随着PIM的增加,我们发现可能出现流行病周期。作为PIM速率和不同传输速率的函数,我们在图2(b),图2(d),图2(f),图2(h)中绘制了雅可比矩阵的一对特征值(在复平面上),当PIM足够大时,其实际部分最终变为正值(
由线色表示)。因为一对特征值的实部变成正的,存在一个Hopf分岔,从而产生一个极限环。请注意,对于每个图,我们选择了这些PIM值,以强调PIM可能导致振荡。在图2(a)、图2(c)、图2(e)、图2(g)中,我们给出了相应的流行病学动力学时间序列,说明在PIM足够的情况下,传播率会增加,从而引发周期性(图2(b),图2(d),图2(f),图2(h)中的每个星号表示前一图中时间序列中使用的PIM值)。在这些图中,为了说明极限循环,并且由于循环周期可能很长,我们绘制了周数(52 × 400) + 1至52 × 600。
如图2所示,PIM的低值足以触发周期性,特别是对于低
。在图2的例子中,随着传播率的增加,流行病循环需要更大的PIM值;由此产生的周期更短。如果PIM非常强,则特征值对应的实部再次变为负(图2(h))。直观地说,非常高的PIM意味着以前感染的个体对易感人群的贡献大大减少,最终可以忽略不计。在
的极限下,即个体在“康复”后立即死亡,我们的模型类似于SI流行病学模型。在SI模型中,地方性均衡无论何时存在都是局部渐近稳定的。
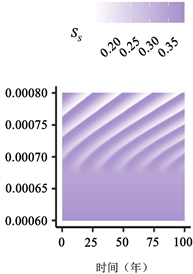 (a)
(a) 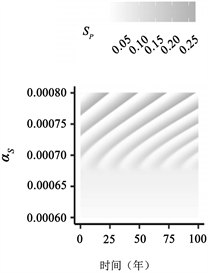 (b)
(b) 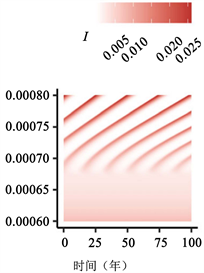 (c)
(c)
Figure 3. Transition to endogenous periodicity
图3. 向内生周期性过渡
图3:PIM触发内生周期性的示例。作为PIM的(a)
、(b)
和(c) I的时间序列的热图是变化的。在所有面板中,
,
,
,
和
。为了获得这些热图,我们模拟了500年,初始条件(第一周)为
,
,
。对于热图,我们放弃前400年,绘制第400 (52) + 1至500 (52)周。
在图3中,我们说明了随着PIM的增加,从稳定的地方性平衡到周期性平衡的转变。由于这些参数值的结果周期比图2(a)、图2(c)、图2(e)中的周期短,因此我们将周数(52 × 400) + 1绘制为52 × 500。如图3(c)所示,对于不导致循环的较小
值,与地方均衡值相比,周期性行为可能导致
的较大变化。有趣的是,PIM越大,周期的感染峰值似乎越高(图3(c))。我们还突出显示
相位平面中的极限循环示例(注意,我们绘制了(52 × 300) + 1至52 × 500周的图来说明之前
相平面中的行为,如图3所示)。
由于疾病传播通常是季节性的,我们研究了年强迫传播率的影响,
,当PIM较弱且地方病平衡稳定时,传播的季节性变化会导致年度周期(图S3A)。然而,当PIM启用周期时,我们发现增加季节性传输速率会导致复杂的动力学(图S3B-S3D)。特别是,小疫情爆发后立即出现大疫情;然后减弱,慢慢减少到感染水平非常低。在这段时间里,易感人群不断增加,从而使这一过程得以重复。
c) 其他特征对流行病的影响感染后死亡率的动态变化
为了确定PIM对流行病动态的影响,我们专注于最简单的类似SIS的模型包括PIM,但不包括活动性感染或康复后的免疫力。然而,直接传播的疾病往往偏离这些基本假设,模型复杂性的增加可能会对流行病动力学产生微妙的影响。特别是,这些额外的生物复杂性可以与由PIM驱动的突发性周期性相互作用。我们来说明下面的一些例子。
图4:附加宿主和病原体特征与PIM的相互作用。(a)~(d)宿主免疫对PIM流行病动态影响的说明性例子。(a)~(c)中的热图如图3所示,但变化的是
而不是
。(d)如图2(b),图2(d),图2(f),图2(h)所示,但
变化。在(a)~(d)中,
,
,
,
,
。(e)~(h)活动性感染期间疾病引起的死亡率影响的说明性例子。面板(e)~(g)如图3所示,但
变化而不是
。(h)与(d)相同,但
的变化不是
。在(e)~(h)中,
,
,
,
,
和
。对于(a)~(c)和(e)~(g)的热图,如图3(a)所示,绘制了400 (52)周 + 1至500 (52)周。
1) 宿主免疫
许多疾病不表现出典型的SIS型特征,宿主在恢复后会产生一些免疫力。例如,麻疹在恢复后引起非常强大的免疫力。其他病原体,如呼吸道合胞病毒或轮状病毒,会引起对再感染的免疫,但它是不完整的 [11] 。在这些情况下,
,即亲属对再次感染的易感性低于对初次感染的易感性。我们发现,在部分免疫的情况下,PIM仍然可以出现周期性(图4(a)~(d))。
在感染后宿主免疫“完美”且不可能再感染的极限情况下,即
,则地方性平衡
是局部渐近稳定的。这一结果表明,对于在SIS病例中诱发循环的固定PIM值,足够强大的宿主免疫可催化流行病循环崩溃至地方性平衡.我们在图4(a)~(d)中说明了这种转换。直观地看,随着免疫力的增强和关键“崩溃”点的临近,更频繁的流行病发生了(图4(a)),易感性的格局也相应发生了变化(图4(b),图4(c))。如果PIM较高,则周期性可能持续存在抗扰度更强,即
的值较小。
2) 活动性感染期间病原体引起的死亡
到目前为止,我们关注的是在活动性感染期间没有病原体诱导的死亡率的情况,即
。然而,病原体会导致一些具有传染性的个体在感染期间死亡。因此,我们接下来放松这一初始假设,并研究感染期间疾病导致的死亡(即
)对PIM流行病动力学的影响。
当不存在PIM时,我们证明了地方性均衡在
时是局部渐近稳定的。令人惊讶的是,我们发现,在一些有限的PIM不足以自行触发循环的情况下,活动性感染期间的疾病诱导死亡率可能导致从稳定的地方病状态向周期性转变(图4(e)~(h))。因此,该分析表明,感染期间疾病导致的死亡会加剧PIM对流行病动态的影响。
4. 讨论与结论
在简单流行病学模型中寻找周期性一直是一个研究重点。Liu等人 [12] 使用非线性发生率来模拟传播,发现多种行为是可能的,包括周期解。Hethcote等人 [13] 证明了具有三个或更多恢复类的SIRS模型可以出现周期性。在这一结果的推广中,在具有四个或更多感染阶段的SIS模型中,通过Hopf分支可以出现循环。此外,在一个简单的数学模型中,研究发现免疫启动可以引起周期性。相比之下,可以制定了一个SIRS模型,该模型具有指数级出生和死亡,并且感染和康复类别的死亡率都可能增加。在该模型中,每个隔间中个体比例的独特地方性平衡是全局渐近稳定的。
在这里,我们使用了一个简单的数学模型来表明PIM与回归(某些)易感性相结合可以导致周期性。这一关键结果的直觉是PIM通过影响次级易感群体来干扰再次感染。当出现周期性时,研究表明,周期的长度部分由传输速率的大小决定(注意,传输速率越大,PIM的速率就越大)。此外,我们发现活动性感染期间疾病引起的死亡可以协同促进循环。相比之下,强大的宿主免疫力(通过对再次感染的低相对易感性获得)降低了次级易感群体对流行病动态的影响,因此可能导致循环行为的消失。因此,对于完全免疫或几乎免疫的儿童感染,如麻疹,我们的结果表明PIM不会从质量上改变动态(即没有潜在的周期性)。另一方面,对于动力学传染病在恢复后不会引起终身免疫,强调了一个被忽视但可能非常常见的复杂性驱动因素,周期出现。特别是,我们的发现揭示了(潜在的部分)易感个体的特征,除了他们对再次感染的潜在易感性之外,还可以破坏流行病动态的稳定性。解开这些特征需要简单的模型以及详细的数据收集和分析。特别强调了在没有强大免疫力的传染病系统中量化PIM的必要性。
由于已有证据表明SARS-CoV-2感染可导致康复后死亡率升高,研究的结果表明,确定
的值对于预测未来SARS-CoV-2的动态非常重要。此外,鉴于PIM含量低可能会引发周期性变化,这种现象可能在可能导致早期死亡的流行性地方病中广泛存在。为了测量PIM,设计了大型队列研究,研究SARS-CoV-2及其以后的免疫流行病学和进化可能包括明确的长期发病率和死亡率。在研究的基础上,还有许多其他潜在的未来途径需要调查。特别是,我们假设了类似SIS的动力学,即个体要么终身免疫,要么在康复后立即(潜在地)再次感染。然而,在恢复(部分)易感性(类似于SIR(S)模型之前,应确定一段“完全免疫”时期的影响,例如应确定超越流感免疫的毒株。同样,我们忽略了急性感染后没有(或很少)额外死亡风险的短期恢复期的可能性,随后PIM增加。我们还考虑了一个同质的人口与被忽视的年龄异质性。由于不同年龄组之间和不同年龄组之间的传播模式可能不同(例如,老年人可能较少参与传播),未来的工作应检查PIM和年龄结构的融合。由于发病率升高和再次感染之间的相互作用,我们的模型中出现了周期性,我们推测,要么是一段完全免疫的时期,要么是PIM降低后发病率增加的短暂恢复期,要么是年龄结构(老年人,或年轻人和老年人患PIM的风险都升高)仍然会导致周期性,只要这种相互作用仍然存在。也许更重要的是,疫苗接种可以对病原体动力学产生重要的流行病学和进化效应。接种疫苗可以预防(或降低)通过宿主免疫感染的可能性反应。此外,正如SARS-CoV-2所强调的那样,疫苗还可能潜在地降低感染后长期症状(长冠状病毒)的可能性,甚至可能减少接种疫苗前感染者的长期症状。这种长期症状的减少可能代表PIM的减少。因此,应调查疫苗接种对PIM流行病动态的影响。
就宿主对感染的反应而言,我们采取了一个简化的假设,即继发性和继发性感染相当于原发性感染。然而,感染的传播能力和持续时间可能不同。特别是,如果存在宿主免疫,则可能与原发性感染相比,再次感染的传播性更低,持续时间更短。未来的工作应该研究这些其他形式的免疫对PIM流行病动态的影响。与此相关,假设继发性感染恢复后的敏感性与原发性感染恢复后的敏感性相同。然而,在现实中,它们的特征可能不同。首先,由于多重感染造成的长期损害,PIM可能随着感染数量的增加而增加。其次,当宿主经历多次感染时,免疫力可能会变得越来越强。因此,合并了多个类别的易感性,具有潜在的不同程度PIM为未来的研究提供了一条卓有成效的途径。虽然我们已经制定了种群水平的模型,但未来的一个关键方向是采用宿主内动力学的跨尺度建模方法。这样的模型可能能够解开形成的潜在机制PIM,活动性感染期间疾病引起的死亡率,以及恢复后的免疫力。其他有趣的途径是学习PIM和不同的出生功能形式之间的潜在相互作用,或野生动物种群中的动态出生,并检查随机性的影响(作为潜在的驱动因素和局部灭绝)。最后,虽然我们在模型中关注的是长期行为,但对PIM产生的瞬态动力学进行表征,了解生态学中的瞬态动力学将是有用的。总的来说,我们的研究结果强调了在人群中对不同程度的易感性进行特征化的重要性,以及随着易感性的变化,个体的生活史轨迹。特别是,已经说明了易感个体在康复后特征的微小变化(即死亡率增加)会导致惊人的人口水平效应。一般来说,我们的工作强调使用简单的流行病学模型来获得定性的见解,由于PIM在最简单的模型公式中包含了周期,因此我们的工作强调了在更大、更难以处理的流行病动力学模型中研究PIM影响的重要性。同时,我们的结果表明,量化PIM的实证研究是可预测性的关键。
基金项目
陕西省哲学社会科学研究专项(2023HZ0808)。