1. 引言
我国作为农业大国,土壤环境直接关系到人民群众的粮食安全与食品安全 [1] [2] [3] [4] [5] 。然而,2014年我国原环境保护部 [1] 调查公报显示,我国的土壤环境状况不容乐观,土壤中重金属超标点位占总点位的82.8%。研究表明,我国受Cd污染的耕地已超过13万km2,涉及11个省市,25个地区 [2] 。生物炭是以生物质为原料,进行限氧高温热解制成的一种炭黑材料,具有微孔结构,有良好的吸附性能和稳定性 [6] 。近年来,生物炭被广泛应用于农业、环境和能源等领域 [7] 。在农业领域中,生物炭也被应用于重金属污染土壤修复 [8] [9] [10] 。但深入探讨生物炭应用与土壤镉污染修复之间的内在关系及其治理效应的研究较少,本研究围绕生物炭对镉污染土壤环境质量的影响展开研究,探讨其镉污染土壤修复效果,为有效实施土壤镉污染治理与修复提供参考与借鉴。
2. 材料与方法
2.1. 试验材料
试验地点位于福建省福州市渔溪镇现代农业示范园,供试土壤属黄赤土,pH值为4.94,总镉含量为0.05 mg/kg,有效态镉含量未检出。猪粪有机肥pH为7.23,总镉含量为0.41 mg/kg,C/N为16.91。花生壳生物炭pH为9.31,总镉含量为0.49 mg/kg,C/N为55.5。
2.2. 试验设计
设计2种镉污染水平,4种花生壳生物炭添加量;同时设置原土样和未添加生物炭的处理,以作对照。每个处理添加了2%的猪粪堆制的有机肥作为基肥,每个处理做四个重复。具体各处理的设计和生物炭、猪粪有机肥添加比例如表1所示。
2.3. 测定内容与方法
2.3.1. 脲酶测定
称取5 g鲜土置于50 mL塑料瓶中,往塑料瓶中加入1 mL甲苯,注意通风。静置10 min后,加入柠檬酸缓冲液(pH 6.7) 20 mL、10%尿素溶液10 mL。摇匀后,将样品放入培养箱中,调温至37℃进行培养。24 h后,对样品进行过滤。吸取1 mL滤液并移液至25 mL比色管并加10 mL蒸馏水,充分摇匀。依次精确加入苯酚钠溶液2 mL、次氯酸溶液1.5 mL,注意通风,定容后充分摇匀,静置20 min以待样品显色。正常情况下,溶液呈蓝色。显色后的样品用紫外分光光度计于578 nm波长处进行吸光值测定,测定需在1 h内完成。每个土样设置一个无基质对照和一个无土对照。无基质对照以等体积(10 mL)的柠檬酸缓冲液(pH 6.7)代替10%尿素溶液,其他操作与实验相同。本测定方法参考关松荫的《土壤酶及其研究方法》 [11] 。
2.3.2. 过氧化氢酶测定
称取2 g风干土样置于50 mL塑料瓶中,依次加入去离子水40 mL、0.3% H2O2溶液5 mL后,放入恒温振荡机内进行震荡。20 min后取下并迅速加入饱和铝钾矾1 mL,摇匀,迅速过滤于盛有5 mL 1.5 mol/L H2SO4溶液的三角瓶中,过滤后制得母液。将母液直接用紫外分光光度计于240 nm处用石英比色皿测定吸光度。每个土样设置无基质对照和一个无土对照。无基质对照以等体积(5 mL)的去离子水代替0.3% H2O2溶液,其他操作与样品处理相同。本测定方法参考杨兰芳的《紫外分光光度法测定土壤过氧化氢酶活性》 [12] 。
2.3.3. 碱式磷酸酶测定
称取5 g风干土样于50 mL塑料瓶中,往塑料瓶中加入1 mL甲苯,注意通风。静置15 min后,依次加入苯磷酸二钠溶液、硼酸缓冲液(pH 10.0)各5 mL。摇匀,培养12 h于37℃恒温箱中。取出后,加蒸馏水使甲苯浮于50 mL刻度线处,摇匀后,用三层滤纸过滤。取1毫升滤液于100 mL容量瓶中,依此加入5 mL硼酸缓冲液(pH 9.0),3 mL 2.5%的铁氰化钾溶液和3 mL 0.5%的4–氨基安替吡啉溶液。定容后充分摇匀,静置20 min以待样品显色,正常情况下,溶液呈粉色。显色后的样品用紫外分光光度计570 nm波长处测定吸光度,测定需在1 h内完成。每个土样设置一个无机质对照和一个无土对照。无基质对照以等体积(5 mL)的蒸馏水代替苯磷酸二钠溶液,其他操作与实验相同。本测定参考赵兰坡的《土壤磷酸酶活性测定方法的探讨》 [13] 。
2.4. 数据统计与分析
应用Microsoft Excel 2013进行数据处理;用Origin 8.5进行图表绘制;用SPSS Statistics 18.5进行相关性分析和单因素方差分析,显著水平P < 0.05。
3. 结果与分析
3.1. 生物炭对Cd污染土壤养分含量的影响
3.1.1. 不同处理对Cd污染土壤可溶性有机碳的影响
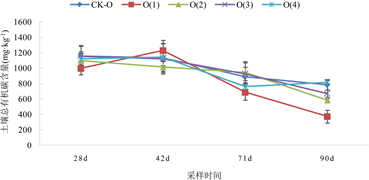
由图1可知,三种Cd浓度土壤水平中,土壤中可溶性有机碳含量变化趋势大致相同,在整个种植期间,土壤可溶性有机碳含量均呈现不同程度的缓慢下降趋势。第90 d时,未添加Cd的土壤中可溶性有机碳含量的降幅为63.42%~31.13%,2.5 mg/kg Cd污染土壤降幅为64.45%~41.54%,5.0 mg/kg Cd污染土壤降幅为48.70%~55.82%。
不同生物炭添加量的处理对土壤可溶性有机碳含量有明显的影响。在未添加Cd水平下,与CK-O处理相比,O(1)处理的可溶性有机碳含量上升了9.99%~57.51%,O(2)处理的可溶性有机碳含量上升了11.44%~80.45%,O(3)处理的可溶性有机碳含量上升了12.29%~111.38%,O(4)处理的可溶性有机碳含量上升了16.09%~119.44%,且它们与CK-O处理间的差异达显著性水平(P < 0.05)。
在2.5 mg/kg Cd水平下,与CK-L处理相比,L(1)处理的可溶性有机碳含量上升了4.49%~38.53%,L(2)处理的可溶性有机碳含量上升了8.30%~58.89%,L(3)处理的可溶性有机碳含量上升了13.55%~69.47%,L(4)处理的可溶性有机碳含量上升了13.55%~100.67%,且它们与CK-L处理间的差异达显著性水平(P < 0.05)。
在5.0 mg/kg Cd水平下,与CK-H处理相比,H(1)处理的可溶性有机碳含量上升了1.79%~27.58%,H(2)处理的可溶性有机碳含量上升了7.62%~32.11%,H(3)处理的可溶性有机碳含量上升了13.34%~47.41%,H(4)处理的可溶性有机碳含量上升了28.52%~36.99%,且它们与CK-H处理间的差异达显著性水平(P < 0.05)。
 (A)
(A) 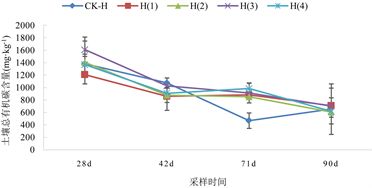 (B)
(B) 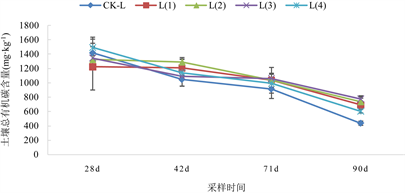 (C) (A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。 注:图(A)中,CK-O、O(1)、O(2)、O(3)和O(4)分别表示未添加生物炭处理、添加5 g/kg生物炭处理、添加10 g/kg生物炭处理、添加20 g/kg生物炭处理和添加40 g/kg生物炭处理。图(B)中CK-L、L(1)、L(2)、L(3)和L(4)分别表示2.5 mg/kg Cd水平下未添加生物炭处理、添加5 g/kg生物炭处理、添加10 g/kg生物炭处理、添加20 g/kg生物炭处理和添加40 g/kg生物炭处理。图(C)中CK-H、H(1)、H(2)、H(3)和H(4)分别表示5.0 mg/kg Cd水平下未添加生物炭处理、添加5 g/kg生物炭处理、添加10 g/kg生物炭处理、添加20 g/kg生物炭处理和添加40 g/kg生物炭处理。28 d、42 d、71 d和90 d分别表示小白菜定苗后第28 d、42 d、71 d和90 d。下同。
(C) (A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。 注:图(A)中,CK-O、O(1)、O(2)、O(3)和O(4)分别表示未添加生物炭处理、添加5 g/kg生物炭处理、添加10 g/kg生物炭处理、添加20 g/kg生物炭处理和添加40 g/kg生物炭处理。图(B)中CK-L、L(1)、L(2)、L(3)和L(4)分别表示2.5 mg/kg Cd水平下未添加生物炭处理、添加5 g/kg生物炭处理、添加10 g/kg生物炭处理、添加20 g/kg生物炭处理和添加40 g/kg生物炭处理。图(C)中CK-H、H(1)、H(2)、H(3)和H(4)分别表示5.0 mg/kg Cd水平下未添加生物炭处理、添加5 g/kg生物炭处理、添加10 g/kg生物炭处理、添加20 g/kg生物炭处理和添加40 g/kg生物炭处理。28 d、42 d、71 d和90 d分别表示小白菜定苗后第28 d、42 d、71 d和90 d。下同。
Figure 1. Soluble organic carbon content in soil at three Cd pollution levels under different biochar treatments
图1. 不同生物炭处理下3种Cd污染水平土壤可溶性有机碳含量
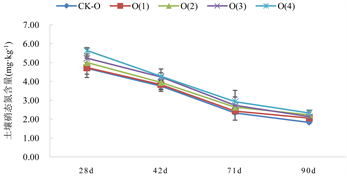
3.1.2. 不同处理对Cd污染土壤速效磷的影响
三种Cd浓度土壤中速效磷含量变化如图2所示。
三种Cd浓度土壤水平中,土壤中速效磷含量变化趋势大致相同,在整个种植期间,土壤速效磷含量均呈现不同程度的缓慢下降趋势。第90 d时,与第28 d相比较,未添加Cd的土壤中速效磷含量总体的降幅33.52%~50.15%,2.5 mg/kg Cd污染土壤速效磷含量降幅为47.25%~61.11%,5.0 mg/kg Cd污染土壤速效磷含量降幅为53.53%~60.86%。
在未添加Cd水平下,与CK-O处理相比,O(1)处理的土壤速效磷含量上升了8.39%~14.48%,O(2)处理的土壤速效磷含量上升了6.06%~21.78%,O(3)处理的土壤速效磷含量上升了18.52%~54.46%,O(4)处理的土壤速效磷含量上升了27.22%~80.20%,且它们与CK-O处理间的差异达显著性水平(P < 0.05)。
在2.5 mg/kg Cd水平下,与CK-L处理相比,L(1)处理的土壤速效磷含量上升了4.91%~26.89%,L(2)处理的土壤速效磷含量上升了3.27%~13.45%,L(3)处理的土壤速效磷含量上升了7.84%~36.13%,L(4)处理的土壤速效磷含量上升了12.75%~52.94%,且它们与CK-L处理间的差异达显著性水平(P < 0.05)。
在5.0 mg/kg Cd水平下,与CK-H处理相比,H(1)处理土壤速效磷含量上升了4.91%~26.89%,H(2)处理的土壤速效磷含量上升了3.27%~13.45%,H(3)处理土壤速效磷含量上升了7.84%~36.13%,H(4)处理的土壤速效磷含量上升了12.75%~52.94%,且它们与CK-H处理间的差异达显著性水平(P < 0.05)。
 (A)
(A) 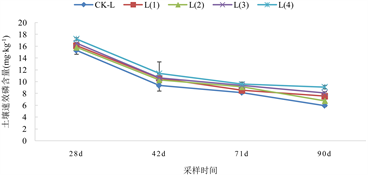 (B)
(B) 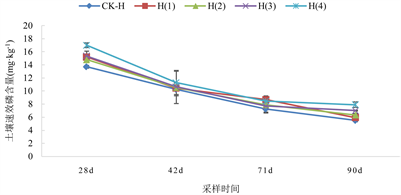 (C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
(C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
Figure 2. Available phosphorus content in soil at three Cd pollution levels under different biochar treatments
图2. 不同生物炭处理下3种Cd污染水平土壤速效磷含量
3.1.3. 不同处理对Cd污染土壤硝态氮的影响
 (A)
(A) 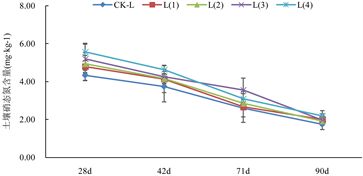 (B)
(B)  (C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
(C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
Figure 3. Nitrate nitrogen content in soil at three Cd pollution levels under different biochar treatments
图3. 不同生物炭处理下3种Cd污染水平土壤硝态氮含量
三种Cd浓度水平土壤的硝态氮含量变化如图3所示。
三种Cd浓度土壤水平中,土壤硝态氮含量变化趋势大致相同,在整个种植期间,土壤硝态氮含量均呈现不同程度的缓慢下降趋势。第90 d时,与第28 d相比较,未添加Cd的土壤中硝态氮含量总体的降幅55.33%~60.99%,2.5 mg/kg Cd污染土壤硝态氮含量降幅为56.92%~65.38%,5.0 mg/kg Cd污染土壤硝态氮含量降幅为44.44%~49.64%。
在未添加Cd水平下,与CK-O处理相比,O(1)处理的土壤速效磷含量上升了0.64%~12.73%,O(2)处理的土壤硝态氮含量上升了4.87%~21.82%,O(3)处理的土壤硝态氮含量上升了11.35%~17.14%,O(4)处理的土壤硝态氮含量上升了13.27%~27.27%,且它们与CK-O处理间的差异达显著性水平(P < 0.05)。
在2.5 mg/kg Cd水平下,与CK-L处理相比,L(1)处理的土壤硝态氮含量上升了2.56%~14.50%,L(2)处理的土壤硝态氮含量上升了9.62%~13.85%,L(3)处理的土壤硝态氮含量上升了12.79%~36.54%,L(4)处理的土壤速效磷含量上升了19.23%~28.46%,且它们与CK-L处理间的差异达显著性水平(P < 0.05)。
在5.0 mg/kg Cd水平下,与CK-H处理相比,H(1)处理土壤硝态氮含量上升了4.05%~14.75%,H(2)处理的土壤硝态氮含量上升了9.46%~16.81%,H(3)处理土壤硝态氮含量上升了9.46%~24.59%,H(4)处理的土壤硝态氮含量上升了29.83%~52.50%,且它们与CK-H处理间的差异达显著性水平(P < 0.05)。
3.1.4. 不同处理对Cd污染土壤铵态氮的影响
 (A)
(A)  (B)
(B)  (C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
(C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
Figure 4. Ammonium nitrogen content in soil at three Cd pollution levels under different biochar treatments
图4. 不同生物炭处理下3种Cd污染水平土壤氨态氮含量
三种Cd浓度水平土壤的铵态氮含量变化如图4所示。
三种Cd浓度土壤水平中,土壤铵态氮含量变化趋势大致相同,在整个种植期间,土壤铵态氮含量均呈现不同程度的缓慢下降趋势。其中至试验第90 d时,与第28 d相比较,未添加Cd的土壤中铵态氮含量总体的降幅9.14%~18.39%,2.5 mg/kg Cd污染土壤铵态氮含量降幅为13.56%~20.97%,5.0 mg/kg Cd污染土壤铵态氮含量降幅为15.97%~25.73%。
在未添加Cd水平下,与CK-O处理相比,O(1)处理的土壤铵态氮含量上升了4.38%~8.88%,O(2)处理的土壤铵态氮含量上升了3.58%~14.45%,O(3)处理的土壤铵态氮含量上升了5.03%~13.03%,O(4)处理的土壤铵态氮含量上升了10.48%~17.43%,且它们与CK-O处理间的差异达显著性水平(P < 0.05)。
在2.5 mg/kg Cd水平下,与CK-L处理相比,L(1)处理的土壤铵态氮含量上升了5.90%~16.54%,L(2)处理的土壤铵态氮含量上升了3.85%~21.68%,L(3)处理的土壤铵态氮含量上升了16.68%~25.89%,L(4)处理的土壤铵态氮含量上升了22.61%~32.69%,且它们与CK-L处理间的差异达显著性水平(P < 0.05)。
在5.0 mg/kg Cd水平下,与CK-H处理相比,H(1)处理土壤铵态氮含量上升了7.60%~15.96%,H(2)处理的土壤铵态氮含量上升了6.87%~20.48%,H(3)处理土壤铵态氮含量上升了5.68%~11.06%,H(4)处理的土壤铵态氮含量上升了8.99%~16.67%,且它们与CK-H处理间的差异达显著性水平(P < 0.05)。
生物炭添加量较高的O(4)处理、L(4)处理和H(4)处理的土壤铵态氮含量均比其他处理的土壤铵态氮含量高。
3.2. 生物炭对Cd污染土壤酶活性的影响
3.2.1. 生物炭对Cd污染土壤脲酶活性与变化的影响
 (A)
(A) 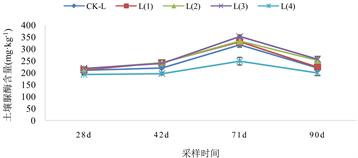 (B)
(B) 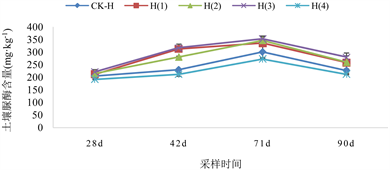 (C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
(C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
Figure 5. Urease activity in soil at three Cd pollution levels under different biochar treatments
图5. 不同生物炭处理下3种Cd污染水平土壤脲酶活性
不同采样时间各处理土壤脲酶活性变化如图5所示。
在三种Cd水平下,生物炭添加量对O(4)、L(4)和H(4)处理的土壤脲酶活性均低于其他处理。而其余三个生物炭处理与未添加的生物炭处理相比,土壤脲酶活性均有不同程度的提高。在未添加Cd水平下,与CK-O处理相比,O(1)、O(2)、O(3)处理的土壤脲酶活性分别提高了0.11%~8.74%、2.45%~19.23%和9.64%~27.09%。
在2.5 mg/kg Cd水平下,与CK-L处理相比,L(1)、L(2)、L(3)处理的土壤脲酶活性分别提高了1.08%~10.08%、3.07%~10.08%和4.17%~17.38%。
在5.0 mg/kg Cd水平下,与CK-H处理相比,H(1)、H(2)、H(3)处理的土壤脲酶活性分别提高了3.52%~35.91%、5.27%~22.02%和8.11%~37.66%。其中,以生物炭添加量为2%处理最高。
3.2.2. 生物炭对Cd污染土壤过氧化氢酶活性的影响
不同采样时间各处理土壤过氧化氢酶活性变化如图6所示。
在未添加Cd水平下,整个种植过程的土壤过氧化氢酶活性呈下降趋势。在2.5 mg/kg Cd水平下,过氧化氢酶活性在整个种植过程中呈现逐渐增加的趋势。在5.0 mg/kg Cd水平下,过氧化氢酶活性呈现先增后减再增的变化趋势。除生物炭添加量最高的O(4)、L(4)和H(4)处理外,其他添加生物炭的处理与未添加生物炭的处理相比,在未添加Cd水平下,O(1)、O(2)、O(3)处理的土壤过氧化氢酶活性分别提高了4.95%~19.40%、5.99%~30.35%和17.15%~37.06%。
在2.5 mg/kg Cd水平下,与CK-L处理相比,L(1)、L(2)、L(3)处理的土壤过氧化氢酶活性分别提高了1.79%~31.17%、2.80%~38.38%和3.56%~51.71%。
在5.0 mg/kg Cd水平下,与CK-H处理相比,H(1)、H(2)、H(3)处理的土壤过氧化氢酶活性分别提高了0.54%~17.28%、6.97%~28.33%和9.65%~38.53%,表现为随着生物炭添加量的增加土壤过氧化氢酶活性增加的趋势。
 (A)
(A) 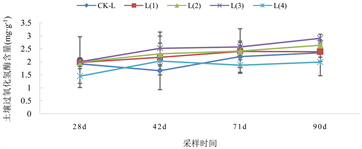 (B)
(B) 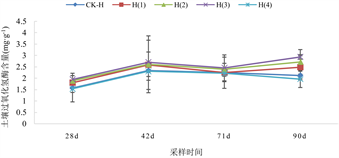 (C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
(C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
Figure 6. Catalase activity in soil at three Cd pollution levels under different biochar treatments
图6. 不同生物炭处理下3种Cd污染水平土壤过氧化氢酶活性
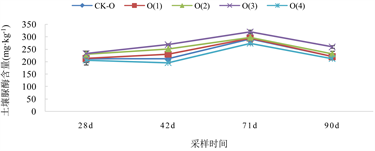
3.2.3. 生物炭对Cd污染土壤碱性磷酸酶活性的影响
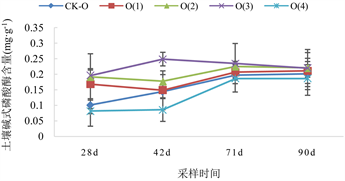
不同采样时间各处理土壤碱性磷酸酶活性变化如图7所示。
在未添加Cd水平下(如图7(A)所示),生物炭添加量为2%的O(3)处理与其他处理相比,碱性磷酸酶活性一直维持在较高水平。而生物炭添加量最高的O(4)处理的碱性磷酸酶活性则低于其他处理,在42 d与其余处理达显著差异(P < 0.05)。
2.5 mg/kg水平Cd水平下的土壤碱性磷酸酶活性变化如图7(B)所示,在整个种植过程中,土壤的碱性磷酸酶呈现出缓慢上升的趋势。其中,与未添加生物炭的CK-L处理相比较,L(1)、L(2)和L(3)处理的碱性磷酸酶活性均有不同程度的上升,上升幅度分别为7.89%~33.33%、26.83%~70.83%、27.66%~51.28%。
5.0 mg/kg水平Cd水平下的土壤碱性磷酸酶活性变化如图7(C)所示,在整个种植过程中,土壤的碱性磷酸酶变化总体呈上升趋势。H(4)处理在整个种植周期内的土壤磷酸酶活性显著低于其他处理。与未添加生物炭的CK-H处理相比较,H(1)的上升幅度为3.12%~12.20%;H(2)的上升幅度为6.90%~30.43%;H(3)的上升幅度为17.24%~43.98%。
 (A)
(A) 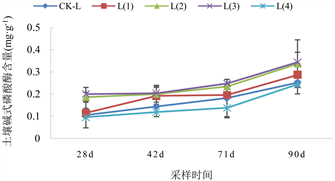 (B)
(B) 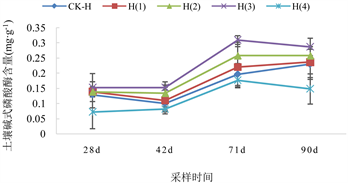 (C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
(C)(A):未添加Cd水平土壤;(B):2.5 mg/kg Cd水平土壤;(C):5.0 mg/kg Cd水平土壤。
Figure 7. Alkaline phosphatase activity in soil at three Cd pollution levels under different biochar treatments
图7. 不同生物炭处理下3种Cd污染水平土壤碱性磷酸酶活性
4. 讨论
本研究中随着种植时间的延长,不同Cd水平下土壤可溶性有机碳含量、速效磷含量、硝态氮和铵态氮含量均出现不同程度的下降。其中,土壤铵态氮含量下降的幅度低于土壤可溶性有机碳、土壤速效磷和土壤硝态氮。衡量土壤肥力水平的指标有很多,其中土壤可溶性有机碳作为土壤有机碳中变化相对大的部分就是其中之一 [14] 。与此同时,土壤可溶性有机碳也在土壤生态系统中扮演着至关重要的角色 [15] [16] 。本研究的结果显示,随生物炭添加量的增加,土壤中可溶性有机碳含量表现出上升趋势。有研究表明,施用生物炭可以显著提高土壤有机质质量分数 [17] [18] ,而宋大利等在研究秸秆生物炭对冬小麦的过程中也发现了相同的特点。与此同时,Beesley等也做过类似的研究,研究结果也表明添加生物炭能提高土壤中可溶性有机碳的含量 [19] 。随生物炭添加量增加,土壤中速效磷含量、硝态氮和铵态氮含量也呈现一定的上升趋势。2017年,刘悦等人的研究表明,生物炭的添加能不同程度增加退化草地盐碱地土壤中有效养分的含量 [20] 。生物炭具有多孔径结构的特征可有效增加土壤的持水能力,当生物炭被施加到土壤后,提高了土壤的持水能力,有效养分如速效磷、可溶性有机碳等会被溶解到土壤中,一方面避免了被淋失到土壤外部,另一方面也有助于养分的缓慢释放。
土壤酶是土壤微生物活动、动植物残体产生的一类相对稳定且具有生物活性的蛋白质,在土壤物质循环和能量转化中起着重要作用 [21] 。土壤过氧化氢酶、磷酸酶和脲酶对重金属污染敏感,可以作为评价土壤重金属污染和生态环境质量的重要生物指标 [22] 。重金属影响酶活性的机理,抑制了酶的活性 [23] 。当土壤中重金属达到一定质量分数时,微生物出现大面积死亡,会导致土壤酶活性降低。高大翔等对Hg、Cd单一胁迫和复合胁迫环境下的土壤酶活性进行探究发现,土壤脲酶和脱氢酶活性均不同程度受到Hg和Cd的抑制,并随土壤重金属Hg和Cd浓度的增加而活性降低 [24] 。而在Cd污染条件下,施加生物炭能降低土壤重金属有效性,同时提高土壤中酶活性。在本研究中,生物炭添加能够对土壤脲酶活性、土壤过氧化氢酶活性和土壤碱性磷酸酶活性产生影响。随生物炭添加量增加,土壤酶活性有明显的提高。土壤酶活性提高的原因有可能是生物炭的多孔径特点为土壤中微生物提供生长空间,同时生物炭的持水保肥特性为微生物生长提供了充足的养分,促进土壤微生物的生长、发育和代谢。也可能是由于生物炭对土壤中有效态重金属产生了钝化作用,从而降低了重金属对土壤酶的毒害。郭文娟用生物炭和氮磷钾复合肥以及发酵鸡粪复配施入Cd污染土壤后,发现土壤酶活性均有不同程度的提高 [25] 。然而,当土壤中生物炭含量超过一定限度时,土壤的酶活性出现了显著的降低。酶活性降低有可能是由于过量的土壤生物炭含量提高了土壤pH,较高的土壤pH对土壤微生物有抑制作用,最终导致了土壤酶活性的降低 [26] 。
5. 结论
生物炭作为一个相对低成本的化学钝化修复剂,是近期研究中的热点之一,但深入探讨生物炭应用与土壤镉污染修复之间的内在关系及其治理效应的研究较少,本研究发现:1) 随着种植时间的延长,土壤中可溶性有机碳、速效磷、硝态氮和铵态氮的含量总体呈下降趋势。生物炭添加可以增加土壤中可溶性有机碳、速效磷、硝态氮和铵态氮的含量,其中以40 g/kg生物炭添加处理最高。2) 在三种Cd水平土壤中,一定的生物炭添加量有助于提高土壤酶活性,而过量的生物炭添加则会抑制土壤酶活性。
基金项目
福建省农业科学院自由探索科技创新项目(ZYTS202220)和福建省农科院协同创新工程(XTCXGC2021010)。