1. 前言
随着社会的进步和科技的发展,药物滥用和毒品问题日益引起人们的关注。为了应对这一挑战,有效的药物检测技术显得尤为重要。在过去的几十年中,各种药物检测技术不断涌现,其中光子晶体技术作为一种前沿的方法,为药物检测领域带来了新的机遇和挑战。光子晶体作为一种特殊的光学材料,具有结构可调、光学性能敏感等特点,为药物检测提供了独特的优势。
本文旨在探讨光子晶体在药物检测方面的应用,特别关注分子印迹二维光子晶体水凝胶传感器的优势和研究进展。通过对相关文献的综合分析,将介绍光子晶体技术在不同药物检测领域的应用案例,包括阿片类药物、抗生素、血管扩张药等的检测。同时,还将探讨光子晶体在药物检测中的优势,如高灵敏度、特异性、实时监测等,并深入分析其在不同药物检测技术中的比较优势。
通过本文的探讨,我们希望能够深入了解光子晶体在药物检测中的应用潜力和优势,为进一步推动药物检测技术的发展提供参考和启示。
2. 目前在药物检测方面主要的技术手段
如图1,荧光法作为一种高灵敏度的检测技术,在药物检测领域受到了广泛的关注。Abraham等人(2020)对电化学检测吗啡的研究进展进行了详细回顾,强调了不同修饰电极在吗啡检测中的应用情况 [1] 。这种方法利用荧光信号的变化来实现药物的定量分析,具备快速、准确的特点。光子晶体在荧光检测中的应用不仅能够提升荧光信号的灵敏度,还能够实现高度选择性的分析,从而在药物检测中具备更广泛的应用前景,但其也存在一些劣势和不足之处。其中一个主要劣势是荧光法在复杂样品矩阵中的应用受到限制,可能会受到样品中其他成分的干扰而影响准确性。此外,荧光信号的稳定性和背景噪音的干扰也可能会影响检测结果的准确性。与此同时,比色法作为一种简便易行的检测方法,在药物检测领域同样发挥着重要作用 [2] 。
Salajegheh等人(2019)通过运用分子印迹技术,巧妙地设计了一种基于计算模拟的改性电极,用于吗啡的比色检测,实现了对吗啡的高灵敏度检测 [3] 。这种方法基于比色反应的颜色变化来进行定量分析,具备操作简单、成本较低的优点,尤其适用于大规模的药物检测需求。光子晶体在比色法中的应用能够进一步提升检测的灵敏度和选择性,为药物检测提供了一种新的技术支持。然而,比色法也存在一些劣势。首先,比色法通常需要人工观察颜色变化,可能会受到主观因素的影响,从而降低定量分析的准确性。其次,比色法在某些情况下可能对样品的透明度和色素影响敏感,限制了其适用范围。在光子晶体的应用中,尽管光子晶体可以增强比色反应的灵敏度,但仍需要注意光子晶体自身的特性对比色效应的影响,以确保可靠的分析结果。

Figure 1. Advantages, disadvantages and improvements of the main technical means [4]
图1. 主要的技术手段的优势、劣势与改进 [4]
电化学法作为一种基于电化学信号的检测技术,在药物检测中展现出广泛的应用前景。Nielsen等人(2018)在他们的研究中对可待因依赖进行了系统性的回顾,特别强调了电化学法在可待因依赖检测中的潜力 [5] 。作者指出,该方法通过监测电化学信号的变化,能够高度准确地定量分析药物,且具备高灵敏度和选择性。这一特点使得电化学法在药物滥用监测等领域中具有重要作用,为了更好地控制药物滥用问题提供了一种有效手段。但也存在一些劣势和不足之处。其中一个主要劣势是电化学法对样品基质的要求较高,复杂样品基质可能会影响电化学信号的稳定性和准确性。此外,电化学法在实际应用中可能会受到电极表面修饰的影响,导致传感器的稳定性和再现性受到限制 [5] 。
3. 光子晶体对药品检测的优势及不同技术比较研究
3.1. 2, 4-二氯苯酚分子印迹二维光子晶体水凝胶

Figure 2. 2, 4 Preparation of two-dimensional photonic crystal hydrogels imprinted with 4-DCP molecules
图2. 2, 4-DCP分子印迹二维光子晶体水凝胶的制备
在药物检测领域,光子晶体与2, 4-二氯苯酚分子印迹二维光子晶体水凝胶密切相关,它们共同展现出一系列优势,为药品分析提供了强大的支持。Qin等人(2020)开展了关于2, 4-二氯酚分子印迹二维光子晶体水凝胶的研究 [6] 。他们的研究旨在利用分子印迹技术结合光子晶体材料,实现对2, 4-二氯酚的高选择性检测。该研究基于光子晶体的周期性结构,如图2通过分子印迹技术在水凝胶中嵌入对2, 4-二氯酚分子特异性的空位,从而实现了对目标分子的识别。研究结果表明,这种分子印迹二维光子晶体水凝胶在药物检测中具有潜在的应用价值,能够实现对2, 4-二氯酚的高灵敏度检测。这种创新性的研究为光子晶体技术在药物检测领域的进一步应用提供了新的思路和方法。在Wang等人(2019)的研究中,受到变色龙的启发,他们探索了结构色致动器的设计 [7] 。他们指出,光子晶体通过其结构色效应,能够对微小的环境变化产生高度敏感的响应,为药物检测提供了潜在机会。这种结构色效应意味着光子晶体的颜色会随着环境中的分子发生变化,从而实现药物分子的快速和准确定量分析。这种实时监测的能力对于药物检测而言具有重要意义,尤其是在微量药物的分析中,光子晶体能够提供高灵敏度和快速响应。Zhao等人(2019)关注于生物启发的传感和致动材料的研究 [8] 。他们认为,光子晶体可以通过调控其周期性结构来实现对环境中化学分子的敏感识别。光子晶体的周期性结构可以用于制备分子印迹材料,从而实现对特定药物分子的高度选择性识别。这种分子印迹二维光子晶体水凝胶能够以一种定制的方式捕获目标分子,从而在复杂的样品基质中实现高度准确的分析。其特异性和高灵敏度使得该方法能够用于药物检测,尤其是对微量目标分子的检测。
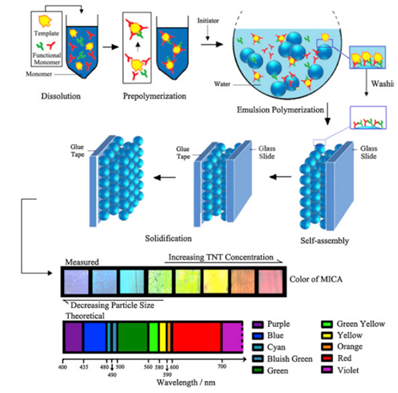
Figure 3. Visual detection of 2, 4, 6-trinitrotoluene
图3. 2, 4, 6-三硝基甲苯的可视化检测
Lu等人(2016)的研究集中在分子印迹胶体阵列光子晶体对2, 4, 6-三硝基甲苯的可视化检测 [9] 。他们指出,结合分子印迹技术和光子晶体的结构色效应,可以实现对特定药物分子的高选择性和灵敏检测。这种分子印迹胶体阵列光子晶体的设计不仅提高了检测的灵敏度,还能够避免对药物样品的破坏,因此为药物分析提供了一种非破坏性的检测手段。对于2, 4-二氯苯酚这种目标分子,分子印迹光子晶体水凝胶的应用可以实现高效、准确的定量分析如图3。Smith等人(2017)的研究则关注光子晶体在二维自组装和排序方面的应用 [10] 。他们认为,光子晶体在材料自组装中的独特性质使其能够构建高度有序的结构,从而实现对药物分子的高选择性识别。这种自组装的优势使得光子晶体能够应用于药物检测中,能够对复杂样品的准确分析,尤其在药物质量控制和安全性监测方面发挥关键作用。在光子晶体水凝胶中,通过这种有序的结构,能够有效地捕获目标分子并实现药物检测的高效性和准确性。
综上所述,光子晶体以及2, 4-二氯苯酚分子印迹二维光子晶体水凝胶共同展示出了在药物检测领域的独特优势。其高灵敏度、选择性、实时监测能力以及分子印迹技术的应用,使得光子晶体在药物分析中具有广泛的应用前景。通过结合不同的方法和技术,这些优势有望为药物检测提供高效、准确的解决方案。
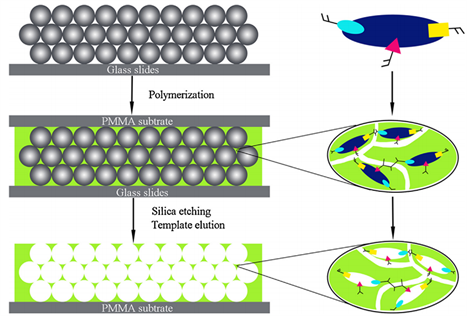
Figure 4. A schematic diagram showing the fabrication of atropine-MIpH with a layered structure
图4. 展示具有分层结构的阿托品–MIPH的制造示意图
3.2. 分子印迹光子水凝胶,可高灵敏度快速筛选生物样品中的阿托品
分子印迹光子水凝胶技术能够实现高灵敏度快速筛选生物样品中的阿托品。Meng等人(2013)在其研究中探讨了分子印迹光子水凝胶在生物样品中快速筛选阿托品的应用 [11] 。他们针对药物阿托品的检测需求,利用分子印迹技术结合光子晶体材料,设计了一种分子印迹光子水凝胶传感器如图4。该传感器基于光子晶体的周期性结构,通过分子印迹技术在水凝胶中构建阿托品分子的特异性空位,从而实现了对阿托品的高选择性和高灵敏度检测。研究结果表明,这种分子印迹光子水凝胶传感器在生物样品中能够快速、准确地筛选阿托品,并具备高灵敏度。这项研究的创新性在于将分子印迹技术与光子晶体材料相结合,为药物检测领域提供了一种新的方法,有望在毒物分析和法医学等领域发挥重要作用。
Aehle和Dräger(2010)在其研究中回顾了茨曼生物碱的分析方法,强调了色谱和电泳技术的更新。然而,这些方法可能存在分析时间长、操作复杂等问题 [12] 。分子印迹光子水凝胶技术则可以在短时间内实现高效的阿托品筛选。通过分子印迹技术,可以在水凝胶中嵌入与阿托品相匹配的分子印迹,从而实现高度选择性的识别。这种高度特异性的识别机制使得光子水凝胶能够在复杂的生物样品基质中快速、准确地筛选阿托品。Broecker等人(2012)探讨了毛发中的广谱未知物质筛选方法,采用液相色谱-杂化四极杆飞行时间质谱技术 [13] 。然而,复杂的样品基质可能影响分析的准确性。相比之下,分子印迹光子水凝胶技术通过特异性的分子印迹识别机制,可以减少样品基质的干扰。通过在水凝胶中形成与阿托品分子形状相匹配的孔洞结构,能够高度选择性地捕获和检测阿托品分子,从而提高分析的准确性和可靠性 [14] 。Yuan等人(2010)研究了非水毛细管电泳与电化学发光和电化学双重检测相结合的方法,用于阿托品、山莨菪碱和东莨菪碱的同时测定 [15] 。然而,这种方法可能在复杂样品中受到其他物质的干扰,导致分析结果的误差。分子印迹光子水凝胶技术的独特之处在于,其分子印迹结构能够对特定目标分子实现高度选择性的捕获,从而避免了其他物质的干扰。这使得光子水凝胶技术能够在生物样品中实现对阿托品的高灵敏度快速筛选,为药物分析提供了一种可靠的解决方案。
综上所述,分子印迹光子水凝胶技术作为一种能够高灵敏度快速筛选生物样品中的阿托品的方法,具备对于复杂样品基质的高选择性和特异性。相比传统方法,这种技术在分析速度和准确性方面具备明显优势,有望为生物样品中阿托品的筛选提供一种高效、可靠的分析手段。
3.2.1. 荧光光子晶体分子印迹传感器阵列,用于磺胺类药物的识别
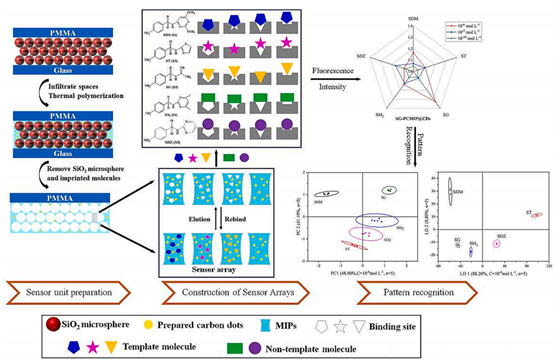
Figure 5. Schematic diagram of sensor array preparation and recognition of SAs
图5. 传感器阵列的制备和识别SAs的示意图
如图5,Zhang等人(2023)在其研究中提出了一种荧光光子晶体分子印迹传感器阵列,用于磺胺类药物的识别 [16] 。磺胺类药物作为一类常见的抗生素,其滥用和残留问题引起了人们的担忧。研究团队将碳点嵌入到光子晶体分子印迹传感器中,以增强荧光信号的灵敏度。通过分子印迹技术,他们构建了针对不同磺胺类药物的分子印迹位点,实现了对特定磺胺类药物的选择性识别。当目标药物与分子印迹位点相互作用时,碳点发出荧光信号发生变化,从而实现药物的检测和定量分析。研究结果表明,这种荧光光子晶体分子印迹传感器阵列能够在复杂食品样品中实现磺胺类药物的快速、准确识别。这项研究不仅为食品安全领域的药物残留检测提供了新的方法,还进一步丰富了光子晶体技术在药物检测中的应用。
Xie等人(2020)回顾了敏感检测和快速去除磺胺类药物的趋势,指出了磺胺甲恶唑等药物的存在和排放问题 [17] 。而传统的检测方法可能存在分析时间长、操作繁琐等问题。分子印迹二维光子晶体水凝胶传感器则通过在水凝胶中引入磺胺甲恶唑的分子印迹,实现对目标分子的高度选择性捕获。这种选择性识别机制使得光子晶体水凝胶能够在复杂的样品基质中实现高灵敏度的磺胺甲恶唑检测。Zhu等人(2021)研究了电子束辐照对水环境中典型磺胺类抗生素的影响,强调了磺胺类药物在水环境中的分布和去除机制 [18] 。然而,复杂的水环境可能导致分析结果的不准确。分子印迹二维光子晶体水凝胶传感器通过分子印迹技术,能够高度选择性地捕获磺胺甲恶唑分子,从而避免了其他干扰物质的影响。这种特异性的识别机制使得光子晶体水凝胶技术能够在复杂的水样品中实现高效、准确的磺胺甲恶唑检测。
3.2.2. 磺胺甲恶唑分子印迹二维光子晶体水凝胶传感器

Figure 6. (a) Preparation process of PS microspheres and 2D-PC (i and ii) (b) Preparation process of SMZ-MIPCH sensor (iii-v)
图6. (a) PS微球和2D-PC的制备过程(i和ii) (b) SMZ-MIPCH传感器的制备过程(iii-v)
磺胺甲恶唑分子印迹二维光子晶体水凝胶传感器技术在磺胺甲恶唑检测领域具有独特的优势,能够实现高灵敏度的检测和快速的筛选。Cao等人(2021)在其研究中提出了一种基于磺胺甲恶唑分子印迹的二维光子晶体水凝胶传感器,用于磺胺甲恶唑的检测 [19] 。他们的研究目标是开发一种高灵敏度、高选择性的检测方法,以实现对磺胺甲恶唑的准确检测。如图6通过分子印迹技术,研究团队在二维光子晶体水凝胶中引入了针对磺胺甲恶唑的分子印迹位点。这种分子印迹使得光子晶体的结构在存在磺胺甲恶唑时发生变化,从而产生可观测的光学信号响应。研究结果表明,这种二维光子晶体水凝胶传感器对磺胺甲恶唑表现出高度的灵敏度和选择性,能够在复杂样品基质中实现准确的检测。这项研究的创新性在于将分子印迹技术与光子晶体材料相结合,为磺胺甲恶唑的检测提供了一种新的、高效的方法。
总之,磺胺甲恶唑分子印迹二维光子晶体水凝胶传感器技术作为一种能够高灵敏度快速筛选生物样品中磺胺甲恶唑的方法,具备对于复杂样品基质的高选择性和特异性。相比传统方法,这种技术在分析速度和准确性方面具备明显优势,有望为磺胺甲恶唑的检测和监测提供一种高效、可靠的解决方案。
3.3. 分子印迹二维光子水凝胶传感器快速筛选奶制品中抗生素

Figure 7. Selective identification of antibiotics by photonic crystal hydrogel sensor
图7. 光子晶体水凝胶传感器选择性识别抗生素
如图7 Wang等人(2019)在其研究中提出了一种快速筛选奶制品中抗生素的方法,利用分子印迹二维光子水凝胶传感器实现 [20] 。抗生素在奶制品中的残留问题引起了广泛关注,因为其存在可能会对人体健康产生影响。研究团队设计了一种分子印迹二维光子水凝胶传感器,通过引入与抗生素分子相互作用的分子印迹位点,实现对抗生素的高选择性识别。当抗生素分子与分子印迹位点相结合时,光子晶体的结构发生变化,导致光学信号发生变化。实验结果表明,这种传感器对奶制品中的抗生素表现出快速响应和高灵敏度,能够实现对抗生素的快速筛选和定量分析。这项研究为食品安全领域的抗生素残留检测提供了一种新的解决方案,同时也展示了分子印迹二维光子水凝胶传感器在药物检测中的潜力。Yan等人(2017)在其研究中提出了一种基于硅芯片上光子晶体生物传感器阵列的特异性抗生素检测方法 [21] 。他们的研究旨在开发一种高度特异性的检测技术,用于抗生素的检测。通过在硅芯片上制备光子晶体传感器阵列,研究团队能够实现多种抗生素的特异性检测。这种传感器的工作原理是基于抗生素与光子晶体材料相互作用导致传感器的结构性改变,从而产生特定的光学响应。研究结果表明,这种硅芯片上光子晶体传感器阵列能够高效、准确地检测不同类型的抗生素,并具备高度的特异性。这项研究的创新性在于将光子晶体技术与硅芯片相结合,为抗生素检测提供了一种新的、高效的解决方案,具备广阔的应用前景。Booth等人(2020)对全球环境中超出预测无效浓度的抗生素残留物进行了回顾性分析,强调了抗生素类药物在环境中的存在和影响 [22] 。
传统的检测方法可能无法满足环境监测的需求。分子印迹二维光子晶体水凝胶传感器技术通过在光子晶体水凝胶中嵌入与磺胺甲恶唑相匹配的分子印迹,能够高度选择性地捕获和检测目标分子。这种高度特异性的检测机制使得光子晶体水凝胶技术能够在环境样品中实现对磺胺甲恶唑的精确、快速筛选。Qiu等人(2020)研究了基于分子印迹光子晶体的高灵敏度α-鸟苷酸传感器 [23] 。他们指出,分子印迹光子晶体技术能够通过分子印迹识别机制实现对特定分子的高度选择性识别,从而提高检测的灵敏度和精确度。类似地,磺胺甲恶唑分子印迹二维光子晶体水凝胶传感器技术也能够通过分子印迹识别机制实现对磺胺甲恶唑的高度选择性识别,从而在样品中实现高灵敏度的检测和快速的筛选。
3.4. 微波金属光子晶体激发共振探针,通过Au NP比色探针的微波光谱法检测血管扩张药
药物检测领域的持续进步与光子晶体技术的兴起不可分割。随着科技的推动,我们正见证着一种全新的药物检测方法崭露头角:微波金属光子晶体激发共振探针结合Au NP比色技术的微波光谱法,它所呈现的优越性和潜力,引发了广泛的关注。Aljuffali等人(2014)研究了将药物通过脂质纳米载体输送到毛囊和人体真皮乳头细胞的方法 [24] 。Alizadeh和Hemati(2014)开发了一种基于分光光度法的安托利普定含量测定方法 [25] 。然而,传统的分光光度法可能受到样品基质的影响,限制了检测的准确性。如图8使用微波金属光子晶体激发共振探针,通过Au NP比色探针的微波光谱法检测血管扩张药技术通过光子晶体的共振现象实现了高灵敏度的检测。与此同时,Au NP比色探针通过颜色的变化实现了药物的定量分析,避免了样品基质的干扰。Park等人(2014)探讨了通过太赫兹超材料实现微生物检测的方法 [26] 。然而,传统的微生物检测方法可能受到复杂的样品基质和操作的限制。使用微波金属光子晶体激发共振探针,通过Au NP比色探针的微波光谱法检测血管扩张药技术通过微波激发实现了对血管扩张药的高灵敏度分析。金属光子晶体在微波频率下的共振响应能够增强探针的信号,而Au NP比色探针能够通过颜色变化的方式进行药物的检测,使得检测方法更加快速和准确。
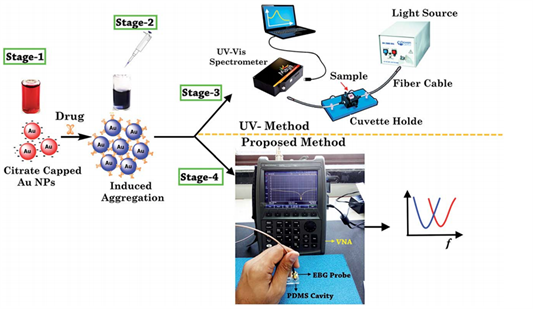
Figure 8. Schematic diagram of sensing and measuring techniques for spectra of two vasodilator drugs
图8. 两种血管扩张药物光谱的传感和测量技术示意图
Rawat等人(2015)研究了使用未修饰金纳米颗粒作为探针实现药物定量检测的方法。然而,传统的金纳米颗粒探针可能受到样品基质的影响,导致分析结果不稳定 [27] 。使用微波金属光子晶体激发共振探针,通过Au NP比色探针的微波光谱法检测血管扩张药技术通过光子晶体的共振效应增强了探针的信号。同时,Au NP比色探针能够在药物存在的情况下通过颜色变化的方式进行可视化分析,提高了检测的准确性和稳定性。Saha等人(2012)研究了金纳米颗粒在化学和生物传感中的应用 [28] 。综上所述,使用微波金属光子晶体激发共振探针,通过Au NP比色探针的微波光谱法检测血管扩张药技术具有高灵敏度和高特异性的优势。这种结合的检测方法能够在复杂样品基质中实现血管扩张药的准确分析,为药物质量控制和安全性监测提供了新的可能性。
4. 总结展望
本文系统地探讨了光子晶体在药物检测领域的应用,特别关注了分子印迹二维光子晶体水凝胶传感器在不同药物检测中的优势。通过综合分析相关文献,我们深入了解了光子晶体作为一种新兴的检测平台,在药物检测方面的独特优势。光子晶体传感器能够通过结构色效应和分子印迹技术实现对药物分子的高灵敏度、高选择性识别,为药物分析提供了一种快速、准确的方法。在实时监测、特异性识别和高灵敏度方面,光子晶体传感器在药物检测领域具有巨大的潜力。
特别是针对2, 4-二氯苯酚、磺胺甲恶唑、左氧氟沙星 [29] 、加替沙星 [30] 等药物的检测,分子印迹光子水凝胶传感器在实现高灵敏度、快速筛选和特异性识别方面表现出色。通过调控光子晶体结构和分子印迹技术,这些传感器能够在复杂样品中实现对特定药物的准确检测,为药物质量控制和安全性监测提供了有力的支持。
然而,光子晶体在药物检测中仍面临一些挑战。样品基质的干扰、实际应用环境的适应性以及大规模制备等问题需要进一步解决。随着技术的不断发展,我们可以期待光子晶体传感技术在药物检测领域的更广泛应用。将来,光子晶体传感器可能通过与其他检测技术的融合,进一步提升检测的性能和可靠性。此外,针对不同药物的检测需求,还可以探索定制化的分子印迹光子水凝胶传感器,以实现更高水平的药物检测精度。总之,光子晶体在药物检测领域的应用具有巨大的前景。通过不断的研究和创新,我们可以期待光子晶体传感技术在药物检测领域发挥更大的作用,为保障公共健康和安全做出更重要的贡献。
参考文献
NOTES
*通讯作者。