摘要: 蒙古裸腹溞(
Moina mongolica)为水产养殖重要的生物饵料,为了探究高效、低成本的培养方法,本试验在室内水温21~26℃,盐度为15,裸腹溞初始接种密度为40 ind./L,进行了2个验,1) 投喂微拟球藻(
Nannochloropsis salina,A1)、对虾尾水沉积物(B1)、微拟球藻 对虾尾水沉积物(C1)、微拟球藻+ 有机酸(D1)、对虾尾水沉积物 有机酸(E1);2) 以仅投喂微拟球藻为对照组(A2),向养殖水体中添加1000 mg/L (5 mL) (B2)、2000 mg/L(10 mL) (C2)、3000 mg/L (15 mL) (D2)浓度的有机酸。连续培养22 d,结果表明:1) A1组蒙古裸腹溞最高密度、日均增长量、日均增长率和最终增长倍数均最高,分别为4203 ind./L、189.2 ind./(L·d)、21.2%/d和105倍。第22 d,该组水体中氨氮(TAN)和亚硝酸氮(NO
2−-N)浓度最高,分别为2. 45 mg/L、0.53 mg/L,显著高于其他各组(
P < 0.05),A1组溶解氧(DO)浓度显著低于其他组(
P < 0. 05);2) D2组蒙古裸腹溞最高密度、日均增长量、日均增长率和最终增长倍数均最高,分别为4543 ind./L、204.6 ind./(L·d)、21.5%/d和113.6倍。第22 d,该组培养水体中TAN和NO
2−-N浓度最低,分别为2.08 mg/L、0.46 mg/L,显著低于其他各组(
P < 0. 05),D2组DO浓度显著低于其他组(
P < 0.05)。本试验条件下,投喂微拟球藻有利于蒙古裸腹溞种群增长,添加有机酸能够进一步改善水质,增强培养效果。
Abstract:
The Moina mongolica is an important live food organism in aquaculture. In order to explore efficient and low-cost cultivation methods, two experiments on culture of M. mongolica were carried out under indoor conditions in seawater with a water temperature of 21 ~ 26˚C and a salinity of 15, 1) feeding Nannochloropsis salina (A1), sediments from shrimp tail water (B1), N. salina sediments from shrimp tail water (C1), N. salina organic acid (D1), and sediments from shrimp tail water organic acid (E1), and 2) feeding N. salina alone as the control group (A2) and adding 1000 mg/L (5 mL) (B2), 2000 mg/L (10 mL) (C2), 3000 mg/L (15 mL) (D2)volumes of organic acid simultaneously to the culture water as treatment groups. The initial inoculum density was 40 ind./L for 22 d of continuous incubation. Results showed that 1) M. mongolica in the A1 group had the highest maximum density, average daily growth, average daily growth rate, and final growth multiple with values of 4203 ind./L, 189.2 ind./(L·d), 21.2%/d, and 105.1 times, respectively. On the 22nd day, the highest total ammonia nitrogen (TAN) and nitrite nitrogen (NO2−-N) concentrations in the culture water were found in this group, which were 2.45 mg/L and 0.53 mg/L, respectively, and were significantly higher than those in the other groups(P < 0.05). The DO content in the A1 group was significantly lower than that in the other groups(P < 0.05); 2) M. mongolica in the D2 group had the highest maximum density, average daily growth, average daily growth rate, and final growth multiple, with values of growth of 4543 ind./L, 204.6 ind./(L·d), 21.5%/d, and 113.6 times, respectively. On the 22nd day, the TAN and NO2−-N concentrations in the culture water were the lowest in this group, which were 2.08 mg/L and 0.46 mg/L, respectively, and were significantly lower than those in the other groups (P < 0.05). The DO content in the D2 group was significantly lower than that in the other groups (P < 0. 05). These findings suggest that under the conditions of this experiment, feeding N. salina favors the growth and development of the M. mongolica population; feeding N. salina and addition of organic acid solution to aquaculture water can significantly increase the population density of M. mongolica and improve water quality, enhancing the effectiveness of cultivation.
1. 引言
蒙古裸腹溞(Moina mongolica Daday, 1901)隶属于节肢动物门(Acthropoda),甲壳亚门(Crustacea),鳃足纲(Branchiapoda),枝角类(Cladocera),异足目(Anomopoda),裸腹溞科(Moinidae),裸腹溞属(Moina) [1] 。同其他生物饵料相比,蒙古裸腹溞具有生活史简短、生长发育速度快的特点,常作为水生毒理学研究的实验对象。而其易捕食、营养丰富又是水产经济动物繁育阶段理想的生物饵料,规模化培养与应用能够降低养殖成本 [2] 。在过去的几十年里,国内外学者对蒙古裸腹溞生物学及环境毒理学展开大量研究 [3] ,蒙古裸腹溞也是持久性有机污染物 [4] 、赤潮藻及其麻痹性贝毒 [5] 、农药和水产药物 [6] 、石油及石油类化合物 [2] [7] 海洋酸化 [8] 和有机溶剂 [9] 等试验的重要受试生物之一。蒙古裸腹溞集约化培养往往受限于水质与饵料的平衡关系,投喂营养丰富且不易污染水质的饵料,同时做好水质调节工作,减少残饵、粪便及代谢产物积累是高密度培养的关键技术。邢浩等 [10] 研究表明,铜绿微囊藻显著抑制蒙古裸腹溞的种群生长,添加小球藻可以缓解这一现象。孔石莼对共培养体系蒙古裸腹溞的生长与繁殖起着有利的作用 [11] 。花尾胡椒绸仔鱼摄食用微拟球藻培养的枝角类,脂肪酶活性最高,蛋白酶的比活力高出轮虫组近15倍 [12] 。迄今,有关蒙古裸腹溞稳定培养条件的探究一直在延续,如何建立稳定、高效、低成本的培养技术体系仍然具有研究意义与商业价值。
本文通过投喂微拟球藻与对虾养殖尾水沉淀物及其组合,使用商品化有机酸调水剂,测定蒙古裸腹溞的种群密度增长及相关水质指标,旨在为蒙古裸腹溞高密度、高质量培养工艺的建立提供参考。
2. 材料与方法
2.1. 试剂材料
蒙古裸腹溞取自辽宁省盘锦光合蟹业有限公司基地池塘,选取规格相近的个体进行试验。海水微拟球藻藻膏为商业化产品(藻细胞密度为400 × 108 cells/g),使用前稀释成浓缩藻液(藻密度8 × 106 cells/mL),对虾尾水沉积物取自企业对虾工厂化养殖车间。试验所用有机酸溶液(Water Farm Brick)为辽宁汇鑫生物科技有限公司产品,含有富里酸、氨基酸、小分子肽、低聚多糖等物质。试验海水经沉淀和砂滤处理后,以80 mg/L浓度的漂白粉消毒,连续曝气、紫外杀菌,待用。
2.2. 方法
2.2.1. 投喂不同饵料对蒙古裸腹溞种群密度与水质的影响
试验分组如表1所示。试验期间,采用的是8 L小体积水槽,水槽中注入5 L经过过滤、消毒、曝气,盐度为15的海水,连续充气,室内自然光照培养,水温26 ± 3℃。蒙古裸腹溞的初始接种密度为40 ind./L,全程于室内自然光照中培养,每天早晚两次投喂配制好的饵料。每天早上投喂前换水20%,定期吸出底部杂质,试验每3 d取一次样,连续培养22 d,每组3个平行。
各组试验进行期间,每3 d测定一次种群密度。测定方法为:用玻璃棒缓慢搅动水槽内的水体,将蒙古裸腹溞尽量混合均匀,用100 mL烧杯在水槽的左中右三个位置分别进行取样,每个位置取样3次,每个重复均进行记录,记录后将溞体重新放回原水槽中继续进行培养。各指标按如下公式计算,其中:N0和NC分别表示增殖计算开始和结束时蒙古裸腹溞的密度(ind./L);Nt表示在某试验时间的蒙古裸腹溞密度(ind./L);t为试验时间(d)。
(1)
(2)
(3)
所有水样经分类编号后,在水化学实验室2 h内完成测定。盐度使用便携式盐度计(METTLER TOLEDO 738-ISM,梅特勒-托利多仪器(上海)有限公司)测定;pH采用便携式pH计(PHB-1,上海三信仪表厂)测量;溶解氧(DO)浓度采用的是美国YSI550A便携式溶解氧测定仪直接测定。氨氮(TAN)浓度采用纳氏试剂分光光度法测定,亚硝酸氮(NO2−-N)浓度采用重氮–偶氮光度法测定 [13] 。
2.2.2. 有机酸对蒙古裸腹溞种群密度与水质的影响
以蒙古裸腹溞仅投喂微拟球藻藻液为对照组(A2),以及同时向养殖水体添加1000 mg/L (5 mL) (B2)、2000 mg/L (10 mL) (C2)、3000 mg/L (15 mL) (D2)容量的有机酸处理组,每组3个平行。
养殖及测定方法同上
2.2.3. 数据统计与分析
试验数据先用Excel 2010记录并作简单处理,通过SPSS 26.0软件单因素方差分析法(one-way ANOVA)进行统计分析,使用Duncan多重比较法进行组间差异性检验。若P < 0.05,则认为存在显著性差异,统计结果以平均值 ± 标准差的形式表示。
3. 结果与分析
3.1. 投喂不同饵料对蒙古裸腹溞种群密度与水质的影响
3.1.1. 投喂不同饵料对蒙古裸腹溞种群密度的影响

Figure 1. Changes of feeding strategies on the population density of M. mongolica
图1. 投喂不同饵料蒙古裸腹溞种群密度的变化
由图1可知,A1组、C1组和D1组裸腹溞种群密度呈上升趋势,随着培养时间的延长,在第22 d达到最大值,分别为(4203 ± 77) ind./L、(2848 ± 150) ind./L、(3068 ± 157) ind./L。B1组和E1组种群密度显著低于其他3组,在第10 d达到最大密度,试验结束时,A1组蒙古裸腹溞种群密度最高,显著高于其他各试验组(P < 0.05)。在试验结束时,A1组的日均增长量最大,显著高于其他各组(P < 0.05)。A1组日均增长率最高,为(21.2 ± 0.1) %/d,显著高于B1组、C1组、D1组和E1组(P < 0.05)。从增长倍数来看,A1组的增长倍数最高,为(105 ± 2)倍,和其他各组有着显著性差异(P < 0.05) (表2)。

Table 2. Effects of feeding strategies on the population density of M. mongolica
表2. 投喂不同饵料对蒙古裸腹溞种群密度的影响
注:同列中标有不同字母者表示组间有显著性差异(P < 0.05),标有相同字母者表示组间无显著性差异(P > 0.05),下同。
3.1.2. 投喂不同饵料对蒙古裸腹溞培养水质的影响
试验期间,A1组、C1组和D1组蒙古裸腹溞培养水体溶解氧(DO)浓度随着时间的增长而降低,各试验组在初始时,DO浓度最高,A1组、C1组和D1组在试验结束时,DO浓度达到最低,A1组DO浓度显著低于其他各组(P < 0.05),B1组在第13 d时DO浓度降到最低,为7.43 ± 0.03 mg/L,E1组在第10 d时DO浓度降到最低,为7.44 ± 0.03 mg/L (图2)。

Figure 2. Effects of feeding strategies on DO concentration in the water column
图2. 投喂不同饵料对培养水体溶解氧浓度的影响
试验期间,各试验组pH呈波动较小的起伏变化,在试验第4 d时,A1组pH达到最大值,为8.77 ± 0.02,显著高于其他各试验组(P < 0.05),B1组在试验结束第22 d时,pH达到最大值,在第10 d,B1组的pH达到最低,为8.20 ± 0.01,显著低于其他各试验组(P < 0.05) (图3)。
试验期间,A1组、C1组和D1组水体氨氮(TAN)浓度整体呈上升趋势,组初始TAN浓度最低,A1组、C1组和D1组在试验结束第22 d,TAN浓度最高,其中A1组TAN浓度显著高于其他各试验组(P < 0.05),B1组和E1组在第10 d TAN浓度达到最高,之后呈现缓慢下降趋势(图4)。

Figure 3. Effects of feeding strategies on pH in the water column
图3. 投喂不同饵料对培养水体pH的影响

Figure 4. Effects of feeding strategies on TAN concentration in the water column
图4. 投喂不同饵料对培养水体氨氮浓度的影响
由图5可知,试验期间,A1组、C1组和D1组蒙古裸腹溞培养水体亚硝酸氮(NO2−-N)的浓度整体呈上升趋势,各试验组在初始时,NO2−-N浓度最低,A1组、C1组和D1组在试验结束时,NO2−-N浓度达到最高,其中A1组NO2−-N浓度显著高于其他各试验组(P < 0.05)。B1组和E1组在第13 dNO2−-N浓度达到最高。
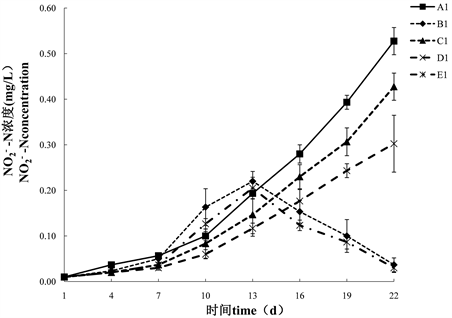
Figure 5. Effects of feeding strategies on NO2−-N concentration in the water column
图5. 投喂不同饵料对培养水体NO2−-N浓度的影响
3.2. 有机酸对蒙古裸腹溞种群密度与水质的影响
3.2.1. 有机酸对蒙古裸腹溞种群密度的影响

Figure 6. Changes in population density of M. mongolica in each group supplemented with organic acids
图6. 添加有机酸各组蒙古裸腹溞种群密度的变化
由图6可知,随着培养时间的延长,各试验组溞体种群密度不断增长,整体呈先上升后趋势趋于平缓的趋势,第22 d各组密度为最大值。试验结束时,D2组蒙古裸腹溞种群密度最高,为(4543 ± 164) ind./L,日均增长量最大,日均增长率最高,均显著高于其他各组(P < 0.05)。从增长倍数来看,D2组的增长倍数最高,显著高于其他各组(P < 0.05),A2组和B2组种群增长倍数之间差异并不显著(P > 0.05) (表3)。

Table 3. Effects of add organic acid on the population density increasement of the M. mongolica
表3. 添加有机酸对蒙古裸腹溞种群增长的影响
3.2.2. 有机酸对蒙古裸腹溞培养水质的影响
试验期间,各组蒙古裸腹溞培养水体DO的浓度随时间增长而降低,其中D2组DO浓度显著低于其他试验组(P < 0.05),A2组和C2组之间存在显著性差异(P < 0.05),A2组和B2组,B2组和C2组之间无显著性差异(P > 0.05) (图7)。
Figure 7. Effects of organic acid on DO concentration in the water column
图7. 有机酸对培养水体溶解氧浓度的影响
试验期间,各试验组pH均呈波动较小的变化,A2组在试验第13 d时,pH达到最高值,显著高于其他各组(P < 0.05),D2组在第16 d时pH达到最低值,为(8.26 ± 0.02),和其他各组呈显著性差异(P < 0.05) (图8)。

Figure 8. Effects of organic acid on pH in the water column
图8. 有机酸对培养水体pH的影响
试验期间,各组蒙古裸腹溞培养水体TAN浓度随着时间的增长呈上升趋势,在试验结束时,A2组TAN浓度最高,和其他组TAN浓度存在显著性差异(P < 0.05),D2组TAN浓度显著低于其他各组(P < 0.05) (图9)。

Figure 9. Effects of organic acid on TAN concentration in the water column
图9. 有机酸对培养水体氨氮浓度的影响
试验期间,各组蒙古裸腹溞培养水体NO2−-N的浓度随着时间的增长而上升,在试验结束时,A2组NO2−-N浓度最高,和B2组差异性不显著(P > 0.05),D2组NO2−-N浓度最低,显著低于其他各组(P < 0.05) (图10)。

Figure 10. Effects of organic acid on NO2−-N concentration in the water column
图10. 有机酸对培养水体NO2−-N浓度的影响
4. 讨论
4.1. 投喂对蒙古裸腹溞种群密度与水质的影响
枝角类种类和数量丰富,在我国各地均有分布,常见于池塘、湖泊、湿地、稻田等水域中 [14] ,为食物链中重要的环节。其作为鱼类、甲壳类育苗阶段中重要的生物饵料,如何实现规模化、低成本培养一直是产业面临的问题,其中投喂和水质之间的关系备受关注。
本试验选用不同的饵料及组合投喂蒙古裸腹溞,探讨其种群密度、增长量等相关方面的研究。在为期22 d的试验过程中,投喂微拟球藻的蒙古裸腹溞种群密度及日均增长量均显著高于其他组,表明微拟球藻为蒙古裸腹溞适合的生物饵料。研究表明,枝角类培育过程中投喂微拟球藻,可以提高枝角类数量与繁育速度,且能个体微红,活力较好 [15] 。钱军等 [16] 探讨了不同藻类对蒙古裸腹溞的影响,发现投喂绿色巴夫藻,对蒙古裸腹溞效果较好。通过微拟球藻强化过的轮虫和卤虫的蛋白质含量均显著高于其他试验组 [17] 。然而,投喂三角褐指藻会对桡足类产生不利影响 [18] [19] [20] ,表明硅藻所含的营养成分不足以满足某些桡足类的生长繁殖发育,缺少相应的营养成分,并且其代谢产物会抑制桡足类繁殖 [21] [22] [23] [24] [25] 。养殖对象的排泄物会溶解在水中,释放出大量有害物质,恶化水体环境,不利于水生生物的发育繁殖 [26] 。本试验所用对虾尾水沉积物体积较大,少部分可通过300目筛绢网过滤于水中,但悬浮性能不佳可能影响了蒙古裸腹溞摄食。添加少量有机酸能够改善水质,但其并不具备饵料的特质,不能满足蒙古裸腹生长繁殖的需要,并且微拟球藻总量减少,所以种群密度要低于A1组。
水质恶化会给病原菌的繁殖提供合适的条件,造成养殖生物损失,且不利于生物的摄食和生长,饲料的利用率降低,增加养殖成本 [27] 。水产养殖中水质评价重要指标为TAN和NO2−-N的浓度 [28] 。高浓度的TAN会对水生生物的生长和发育产生负面影响,其可穿透动物细胞膜对水产生物造成伤害 [29] 。而NO2−-N浓度过高时,养殖生物抗病能力越弱,从而影响养殖对象的生殖发育 [30] 。
本试验对蒙古裸腹溞培养水体进行了连续水质检测,各组水体TAN、NO2−-N浓度总体呈上升趋势。试验1中,由于A1组、C1组、D1组种群密度不断升高,代谢产物也随之增多,因此水体中的TAN、NO2−-N浓度随之增加,水质恶化。在第22 d,A1组种群密度最大,TAN和NO2−-N浓度也是显著高于其他组。B1组投喂的对虾尾水沉积物会对水体中的TAN和NO2−-N产生影响,所以前期NO2−-N浓度较高,但是种群密度较小,并且是不断曝气的小水体,因此TAN和NO2−-N浓度变化较小。添加少量有机酸能够改善水质,并且微拟球藻总量减少,种群密度降低,水体中的代谢产物对水质的影响就会减小。赵乃刚等 [31] 在其研究中指出微藻不能在满足养殖对象的营养需要的同时,又能够促进养殖水体水质的改善。在试验过程中如果能及时摄食微拟球藻,不易造成水体水环境的恶化。
4.2. 有机酸对蒙古裸腹溞种群密度与水质的影响
本试验未添加有机酸的A2组溞种群密度等各项指标低于添加有机酸的B2、C2、D2组。各试验组添加的剂量越高,蒙古裸腹溞种群密度越高。D2组的养殖效果最好的原因可能是水体内的富里酸,氨基酸、小分子肽,低聚多糖等有机酸和Fe2+和SiO2等矿物元素含量均为最多,而有机酸在水产动物的养殖饲料中起着诱食剂的作用,可以帮助溞体加快摄食消化 [32] 。此外,有机酸能提高矿物质的可溶性并与其进行螯合,从而能够促进矿物质的利用率。添加的有机酸溶液能够促进改善水体微生物的平衡,减少养殖对象的死亡率 [33] 。
A2组未添加有机酸,水体TAN浓度显著高于其他各组。但B2组由于添加有机酸含量较少,与A2组NO2−-N浓度无显著区别。D2组添加有机酸添加量较大,水体中TAN和NO2−-N浓度显著低于其他各组,表明添加一定含量的有机酸可以更好地抑制水体环境中TAN、NO2−-N浓度的增长。已有研究表明,有机酸可以促进水体的自净功能,促进含氮有机物氧化分解,并改善水体微生物的平衡,促进鱼贝虾的生长,减短生长周期,且水体中有机酸含量越多,越能达到水质改良的良好效果 [34] 。
4.3. 蒙古裸腹溞培养工艺的优化
本试验发现投喂适量微拟球藻,对蒙古裸腹溞种群密度的增长效果显著,而随着培养时间延长,其种群密度虽然会显著增加,代谢产物增多水质会得到恶化,包括DO浓度和pH的降低,以及TAN、NO2−-N浓度的增加,种群密度增长放缓甚至下降。此外,投喂的微藻为离心后,经过−20℃冷冻保存的藻膏,容易沉积。在试验前期溞种群密度较小,对微拟球藻的利用较少,沉积的藻会腐败,进而加速水质恶化。添加适当剂量有机酸,可以有效净化水体,促进含氮有机物氧化分解,降低环境中的化学需氧量以及TAN和NO2−-N的浓度,促进水体微生物的平衡,改善水质,促进养殖对象的繁殖和生长。李蕾等 [35] 发现,蒙古裸腹溞的接种密度低于88 ind./L时,较难形成稳定的种群。本试验发现在环境较为稳定的情况下,初始密度较小时,也可以形成稳定种群。因此,提供稳定的培养条件,找到种群密度、投喂和水质之间的平衡点,就可能实现微藻与枝角类连续培养与采收,解决蒙古裸腹溞及其他枝角类等生物饵料的规模化培养问题。
5. 结论
1) 以微拟球藻藻液作为投喂饵料,有利于蒙古裸腹溞种群增长和发育。
2) 以微拟球藻藻液作为基础饵料,添加养殖水体3000 mg/L的有机酸溶液能够显著提高蒙古裸腹溞的种群密度,并改善水质。
项目资助
国家重点研发计划“政府间国际科技创新合作”项目2022YFE0117900;辽宁省首批“揭榜挂帅”科技攻关项目2021JH1/10400040;2023中央财政对辽宁渔业补助项目;2023年大学生创新创业训练计划项目。
NOTES
*第一作者。
#通讯作者。