1. 引言
随着我国经济的迅速发展,生活污水、工农业废水、水产养殖废水的不当排放等人为因素严重破坏了自然界的氮素循环,造成了氮素的累积,对自然环境及人类生存健康造成极大的危害。水体中的氮元素以硝态氮、亚硝态氮、氨氮和有机氮的形式存在,现有的物化脱氮工艺包括电渗析法、反渗透法、离子交换法、折点加氯法和化学沉淀法等 [1] ,但由于物化脱氮工艺的成本较高、效率较低且容易造成二次污染,现在较少应用于废水的脱氮。而生物脱氮工艺由于具有低成本、高效率、无二次污染等特点,已作为主体工艺被广泛应用 [2] 。传统生物脱氮技术认为硝化作用和反硝化作用是两个完全独立的主体:好氧条件下,氨氮经自养硝化菌转变为硝酸盐和亚硝酸盐,再在厌氧条件下通过反硝化作用还原成氮气 [3] 。直到1984年Robertson和Kuenen首次分离出好氧反硝化菌株 [4] ,之后越来越多的学者开始关注好氧反硝化菌的研究,并且从各种环境中都分离出了好氧反硝化细菌如土壤中、活性污泥中、地塘里等 [5] [6] 。与传统的厌氧反硝化菌相比,好氧反硝化菌能够在有氧气时进行反硝化,实现了硝化和反硝化在时间和空间上的统一;硝化过程生成的硝酸盐、亚硝酸盐可以直接被反硝化过程利用,防止了它们对反硝化过程的抑制;而反硝化过程产生的碱可中和硝化过程产生的酸,维持了系统的酸碱平衡 [7] ;一些好氧反硝化菌本身还可以进行硝化作用,独立的将水体中的氨氮除去 [8] [9] [10] 。
本研究着重对好氧硝化菌的反硝化特性和生理生化特性进行了研究,从巴陵石化己内酰胺污水中分离筛选好氧反硝化菌,得到一株高效菌B-5,再对其最佳反硝化培养体系条件(碳源、C/N、温度及pH)进行优化,目的在于使该菌株最大程度地发挥其好氧反硝化潜力。由于好氧反硝化理论突破了传统的反硝化理论,是一种新的微生物学现象。只有通过对好氧反硝化菌的深入研究,才能够对好氧反硝化技术进行更有意义的理论和技术指导,充分发挥这一新型生物脱氮技术的优势。
2. 材料与方法
2.1. 材料
2.1.1. 样品来源
巴陵石化的己内酰胺污水。
2.1.2. 培养基
1) R2A培养基:0.5 gL−1 yeast extract;0.3 gL−1 K2HPO4;0.5gL−1 peptone-D;0.5 gL−1 casamino acid;0.5 gL−1 D-glucose;0.5 gL−1 starch soluble;0.05 gL−1 MgSO4·7H2O;0.3 gL−1C3H3NaO3。R2A固体培养基需要加15 g琼脂。将pH调到7左右。
2) 反硝化细菌培养基(DM):7.9 gL−1 Na2HPO4·7H2O;1.5 gL−1 KH2PO4;0.3 gL−1 (NH4)2SO4;0.5 gL−1 MgSO4·7H2O;5.062 gL−1 sodium succinate;1.5 gL−1 KNO3和2 mL微量元素溶液。将pH调到7左右。微量元素溶液的配方为:50 gL−1 EDTA;2.2 gL−1 ZnSO4;5.5 gL−1 CaCl2;5.1 gL−1 MnCl2·4H2O;1.1 gL−1 (NH4)6Mo7O2·4H2O;5.0 gL−1 FeSO4·7H2O;1.6 gL−1 CuSO4·5H2O;1.6 gL−1 CoCl2·6H2O。
3) 溴百里酚蓝选择性培养基BTB:1 gL−1 KNO3;0.2 gL−1 CaCl2;1 gL−1 KH2PO4;0.5 gL−1 FeCl3·6H2O;1 gL−1 MgSO4·7H2O;8.6 gL−1 sodium succinate;21 gL−1 agarose;1 mL溴百里酚蓝。将pH调到7左右。
2.2. 好氧反硝化菌的富集与分离
将10 mL的样品加入到装有250 mL反硝化培养基的三角瓶中(已灭菌),用透气膜密封住瓶口,将三角瓶放在30℃、160 r/min的摇床中培养两天,对好氧反硝化菌进行富集培养。将最终得到的细菌悬液按102、104、105、106梯度稀释 [11] ,涂到BTB固体培养基上。将平板放在恒温培养箱(30℃)培养几天后,找出BTB培养基变蓝的平板,用无菌接种环分别挑取形态不同的菌落到新的BTB培养基平板上划线,如此反复直到出现单一的纯菌落。最后将分离纯化后的单菌落接种到R2A固体培养基上,在恒温培养箱里培养2天后于4℃保存。
2.3. 好氧反硝化菌的反硝化性能测定
挑取不同的单菌落分别接种到装有50 mL的DM培养基的150 mL三角瓶中(已灭菌),将三角瓶在好氧条件下于30℃、160 r/min的摇床中培养一天,再从中取2 mL菌液接种到新的装有100 mL的DM培养基的250 mL三角瓶中,在同样条件下再培养一天,最后将菌液离心取上清液测量其中的氨氮、硝态氮、亚硝态氮、总氮和化学需氧量。通过计算各菌株的氨氮、硝态氮、总氮的去除率以及亚硝态氮的累积量确定反硝化性能最佳的菌株以进行后续的研究。
2.4. 好氧反硝化菌的鉴定
2.4.1. 生理生化鉴定
参照《伯杰细菌鉴定手册》 [12] 和《常见细菌系统鉴定手册》 [13] 对筛选出的菌株做进一步鉴定,包括革兰氏染色、运动性观察、葡萄糖发酵实验、氧化酶实验、过氧化氢酶实验、甲基红实验、硝酸盐还原实验、柠檬酸盐利用实验、V-P实验、H2S产生实验。
2.4.2. 16S rDNA序列同源性分析
使用Omega Bio-TEK公司的细菌基因组DNA提取试剂盒,按照说明书提取DNA。将提取的菌株DNA作为PCR模板进行扩增,PCR引物选用27F (AGAGTTTGATCATGGCTCAG)和1492R (TACGGTTA CCTTGTTACGACTT) [14] 。将所测序列提交到GenBank并使用Basic Local Alignment Search Tool (BLAST)进行对比,再用Neighbor-Joining方法在MEGA7.0软件中构建系统发育树,确定菌株的属。
2.5. 菌株生长曲线的测定
为了解菌株的生长情况,按2%的接种量将处于对数生长期的菌株接种到液体培养基中,调整摇床转速为160 r/min,温度30℃,振荡培养。通过定时测量培养过程菌液的OD600值的变化,绘制菌株的生长曲线,掌握其生长规律。
2.6. 环境因素对细菌脱氮性能的影响
2.6.1. 碳源对脱氮效果的影响
为探求不同碳源对菌株好氧反硝化作用的影响,以DM液体培养基为基础,以硝酸钾为唯一氮源,分别以琥珀酸钠、乙酸钠、柠檬酸钠、蔗糖为碳源,初始C/N为15,初始pH值为7,温度为30℃,转速为160 r/min的条件下恒温振荡培养24 h,测定培养液中硝态氮和亚硝态氮的浓度,确定菌株利用不同碳源进行好氧反硝化作用的情况。
2.6.2. 不同C/N对脱氮效果的影响
为探求不同C/N对菌株好氧反硝化作用的影响,以DM液体培养基为基础,以琥珀酸钠为碳源,硝酸钾为唯一氮源,初始C/N分别设为6、9、12、15、20,初始pH值为7,温度为30℃,转速为160 r/min的条件下恒温振荡培养24 h,测定培养液中硝态氮和亚硝态氮的浓度,确定菌株利用不同初始C/N进行好养反硝化作用的情况。
2.6.3. 不同温度对脱氮效果的影响
为探求不同温度对菌株好氧反硝化作用的影响,以DM液体培养基为基础,以琥珀酸钠为碳源,硝酸钾为唯一氮源,初始C/N为15,初始pH值为7,温度分别为20℃、25℃、30℃、35℃、40℃,转速为160 r/min的条件下恒温振荡培养24 h,测定培养液中硝态氮和亚硝态氮的浓度,确定菌株在不同温度的条件下进行好养反硝化作用的情况。
2.6.4. 不同pH对脱氮效果的影响
为探求不同pH值对菌株好氧反硝化作用的影响,以DM液体培养基为基础,以琥珀酸钠为碳源,硝酸钾为唯一氮源,初始C/N为15,初始pH值分别为5、6、7、8、9,温度为30℃,转速为160 r/min的条件下恒温振荡培养24 h,测定培养液中硝态氮和亚硝态氮的浓度,确定菌株在不同初始pH值的条件下进行好养反硝化作用的情况。
3. 结果与讨论
3.1. 好氧反硝化菌的分离
经过分离纯化后,得到了5株形态各异的好氧反硝化菌,详见表1。
3.2. 细菌好氧反硝化性能的测定
测定离心后的菌液中的氨氮、硝态氮、亚硝态氮和总氮,去除率如图1所示。结果表明B-3、B-10和B-21对氨氮的去除率很高,具有很好的硝化性能,但反硝化性能欠佳;B-5和B-26的硝化和反硝化性能较好,其中B-5的硝态氮去除率可以达到90%以上,且可以独立完成硝化和反硝化过程,具有较强的脱氮能力,因此对B-5进行进一步的研究。
3.3. B-5的生理生化鉴定结果
菌株B-5的生理生化特性如表2所示。
3.4. B-5的16S rDNA鉴定
将菌株B-5的16S rDNA序列与GenBank中存储的基因序列进行对比分析,菌株B-5与已报道的

Table 1. The isolated aerobic denitrifiers
表1. 分离纯化得到的好氧反硝化菌

Table 2. Physiological and biochemical characteristics of B-5
表2. 细菌B-5的生理生化特性

Figure 1. Removal rates of TN,  and
and  of each strain
of each strain
图1. 各菌株的总氮、硝氮及氨氮的去除率
Pseudomonas citronellolis strain L8的相似性为99%,结合生理生化鉴定结果,确定该菌株为假单胞菌属(Pseudomonas sp.)。找出相似性高的细菌做同源性对比,构建系统发育树,如图2所示。
3.5. B-5的生长曲线
以培养时间为横坐标,以细菌在不同培养时间条件下的菌液OD600值为纵坐标,绘制B-5的生长曲线,如图3所示,前9 h为菌株的生长停滞期;9~24 h为菌株的对数生长期;24 h~30 h为菌株的生长稳定期;30 h之后为菌株生长进入衰减期。
3.6. 环境因素对细菌脱氮性能的影响
3.6.1. 碳源对脱氮效果的影响
测定结果如图4所示,分析可知,菌株B-5对琥珀酸钠和乙酸钠的利用效果都很好,以琥珀酸钠或

Figure 2. The phylogenetic tree of strain B-5
图2. 菌株B-5的系统进化发育树

Figure 3. The growth curve of strain B-5
图3. 菌株B-5的生长曲线
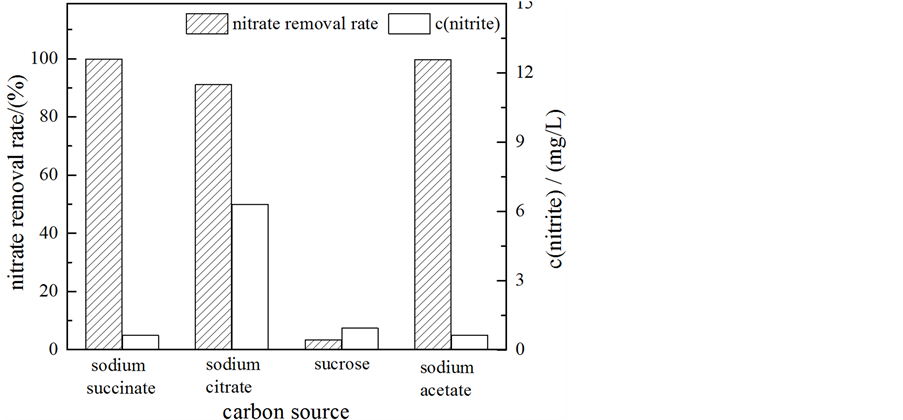
Figure 4. Effects of carbon sources on  removal rate and
removal rate and  production
production
图4. 碳源对硝态氮去除率和亚硝态氮的产生量的影响
乙酸钠作为唯一碳源时,硝态氮去除率达到99%以上,且亚硝态氮没有累积;以柠檬酸钠作为唯一碳源时,效果也较好,硝态氮的去除率为91.1%,但如图所示,24 h后亚硝态氮有一定累积,Richardson等的研究发现,周质硝酸盐还原酶活性很大程度上取决于碳源 [15] ;而以蔗糖作为唯一碳源时,硝态氮的去除率只有3.3%,这与安健等 [16] 的研究结果YX-6菌对乙酸钠和琥珀酸钠这类小分子碳源的利用率相对高于葡萄糖、蔗糖等大分子碳源的利用相一致。不同好氧反硝化菌对不同碳源的利用不尽相同,菌株B-5反硝化的最佳碳源是琥珀酸钠或乙酸钠。
3.6.2. 不同C/N对脱氮效果的影响
测定结果如图5所示,分析可知,随着C/N逐渐升高,硝态氮去除率也随之升高,当C/N为15时,硝态氮去除率达到最大,为99.72%;亚硝态氮的累积量随C/N的升高而逐渐降低,因为反硝化是一个消耗碳源的过程,碳源不足会造成反硝化的不完全;C/N为20时,硝态氮的去除率稍有下降,说明此时碳源已达到饱和,过高的碳源会抑制菌的活性。由图可知,当C/N为15时,硝态氮的去除率和亚硝态氮的累积达到最佳状态,确定菌株B-5反硝化的最佳C/N为15。对比其他已经报道的好氧反硝化菌 [17] ,菌株B-5的最佳C/N较大,相较于C/N需求量小的菌株,该菌更适合高COD工农业废水的处理。
3.6.3. 不同温度对脱氮效果的影响
测定结果如图6所示,分析可知,菌株B-5对硝态氮的去除率一开始随着温度的升高而逐渐升高,到30℃时去除率达到最高,为99.72%;35℃和40℃时略有减少。菌株在30℃~35℃的环境下的脱氮性能较好,反硝化的最佳温度为30℃。国内外的报道也显示出了相似的结果:Alcaligenes faecalis NO.4的最佳生长温度范围为30℃~37℃ [8] ,ES-SDK-3的最佳生长温度范围为30℃~35℃ [18] 。
3.6.4. 不同pH对脱氮效果的影响
测定结果如图7所示,分析可知,菌株B-5对pH有较宽的适应范围。当pH为7时,菌株B-5对硝态氮的去除率达到最大值99.72%;在偏酸的条件下,B-5对硝态氮的去除率也较好,因为反硝化是一个产碱的过程,可以中和偏酸的环境;在偏碱的环境下,菌株对硝态氮的去除率也较好,但是亚硝态氮有累积,这有可能是pH偏高会抑制菌体的生长和亚硝酸盐还原酶的活性。其他的报道在此方面也有类似的结果:异养硝化-好氧反硝化菌YL的最佳pH为7 [19] ,ES-SDK-3菌的最佳pH范围为5~9 [18] 。此类菌的最佳pH范围在弱酸、中性和弱碱的范围内,不适宜在极端pH环境下生长。菌株B-5脱氮的最适pH为6~7。

Figure 5. Effects of C/N on  removal rate and
removal rate and  production
production
图5. C/N对硝态氮去除率和亚硝态氮的产生量的影响

Figure 6. Effects of temperature on  removal rate and
removal rate and  production
production
图6. C/N对硝态氮去除率和亚硝态氮的产生量的影响

Figure 7. Effects of pH on  removal rate and
removal rate and  production
production
图7. pH对硝态氮去除率和亚硝态氮的产生量的影响
4. 结论
从巴陵石化的己内酰胺污水中分离得到5株具有较好脱氮性能的菌株,分别为B-3、B-5、B-10、B-21、B-26。考察这5株菌分别对氨氮、硝态氮、亚硝态氮的降解效果,确定B-5具有很好的硝化和反硝化性能。
对菌株B-5进行鉴定,经形态观察和生理生化反应特征结果初步鉴定其属于假单胞菌属(Pseudomonas sp.),后结合16SrDNA序列分析,可确定菌株B-5为假单胞菌属(Pseudomonas sp.)。
菌株B-5的降解特性实验结果表明,其最佳碳源为琥珀酸钠或乙酸钠;最佳碳氮比为15:1;最佳温度为30℃~35℃;最佳pH为6~7。由此可知环境因子对菌株的生长繁殖和硝酸盐的好氧反硝化反应影响重大。绘制的生长曲线表明,24 h达到最大OD600值1.494。前9 h为菌株的生长停滞期;9 h~24 h为菌株的对数生长期;24 h~30 h为菌株的生长稳定期;30 h之后菌株生长进入衰减期。该菌株生长速度很快,具有很好的脱氮性能,具有广阔的应用前景。