1. 引言
晚发性抑郁症(Late-onset depression, LOD)、轻度认知功能损害(Mild cognitive impairment, MCI)和阿尔茨海默病(Alzheimer disease, AD)存在紧密的联系但关系尚不明确。有学者 [1] 认为抑郁症状是MCI的常见并发症且能加快MCI患者进展为痴呆的速度。因此我们有必要对LOD伴MCI患者进行追踪研究,进行痴呆早期识别,寻找治疗痴呆的最佳时间窗。通过神经心理学测定发现,LOD伴MCI患者有整体认知功能的下降及延迟记忆、视空间与执行功能、注意及工作记忆水平的下降 [2]。但神经心理学测定无法真实反映脑功能状态变化,在判断LOD是否会进展为痴呆的准确性和敏感性上显得较为局限。基于静息态功能磁共振(resting-state function magnetic resonance imaging, rs-fMRI)技术的分数低频振荡振幅(fractional amplitude of low-frequency fluctuation, fALFF)的分析方法可反映大脑局部神经元自发性活动特征,fALFF增强说明脑区兴奋性增高,ALFF减弱说明神经元受到抑制,活动下降 [3]。故本研究首次将神经心理测试与fALFF数据分析方法相结合,对LOD伴MCI患者进行一年随访,探索其病情演变的认知神经机制,研究并阐明两者的关系,找到早期识别痴呆的方法,为延缓痴呆进程提供科学的干预依据。
2. 对象与方法
2.1. 对象
系2014年8月~2016那年2月期间,在上海市浦东新区精神卫生中心门诊随机选择LOD患者,入组前二周处于发作期、征询意见后同意入组的25例,其中男14例,女11例,其中男14例,女11例,平均年龄69.92 ± 5.34岁,发病年龄60.92 ± 10.32月,平均病程74.56 ± 119.71月。入组标准:年龄 ≥ 55;符合《ICD-10精神与行为障碍分类》抑郁症诊断标准,日常生活能力量表(ADL) ≤ 26分。对病例进行必要的体格检查,尤其是神经系统检查,并检验血糖、肝肾功能等生化指标,进一步排除其它可能引起认知损害的原因,如脑血管疾病(包括脑出血、脑梗死),血清学检查除外叶酸、VitB12及甲状腺功能低下,除外酒精滥用史;除外其它精神疾病史;除外严重头部外伤史。MCI诊断依据Peterson等提出的标准 [4] :① 存在由患者自己、家属或知情人提供的记忆主诉;② 记忆测验成绩低于年龄和文化程度匹配的正常对照l.5个标准差;③ 总体认知分级量表轻度异常,即临床痴呆评定量表(clinical dementia rating, CDR) 0.5分;④ 一般认知功能正常;⑤ 日常生活能力保持正常;⑥ 除外痴呆或任何可以导致脑功能紊乱的躯体和精神疾患。一年后3例患者拒访而脱失,共完成22例,其中男 14例,女 8例。LOD伴MCI组,共10例,平均年龄(标准差)为65.70 (5.44)岁,发病年龄为58.40 (13.48)月,平均病程为94.00 (168.50)月;LOD不伴MCI组,共12例,平均年龄(标准差)为66.25 (5.89)岁,发病年龄为62.33 (7.67)月,平均病程为68.58 (84.02)月,两组平均年龄、发病年龄、平均病程差异均无统计学意义(P < 0.05)。研究于2014年7月16日经浦东新区精神卫生中心伦理委员会批准,受试者或家属签署知情同意书。
2.2. 研究方法
2.2.1. 检测
对所有对象在入组时、随访一年后进行认知功能检测:1) 简易智能精神状态检查(mini-mental status examination, MMSE),该量表由Folstein等 [5] 设计,包括定向、记忆、计算、语言、视空间、运用及注意等11个方面,总分30分。2) 蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA),是由Nasreddine等 [6] 编制的专用MCI筛查工具,包括视空间执行能力、命名、记忆、注意、语言流畅、抽象思维、延迟记忆、定向等8方面的认知评估,总分30分。如果受试者受教育年限 ≤ 12年,在测试结果上加1分,校正受教育程度的偏倚,总分 ≥ 26分为正常。3) 上海市精神卫生中心重新修订后的NTB [7] ,包括以下内容:数字广度测验1和测验2。总分范围0~24分;听觉词汇学习测验即刻和延迟:分8个部分;联想学习测验:包括容易(有关联联想)和困难(无关联联想)成对词各6对。容易的词计0.5分,困难的词计1分,满分27分;视觉辨认功能测验:包括功能联系,语义联系。再认、视觉匹配和推理;语言流畅性测试;韦氏填图:满分21分;韦氏木块图。
2.2.2. 评分
所有入组的LOD患者使用选择性五羟色胺再摄取抑制剂进行抗抑郁药治疗,并在入组时、随访一年后进行汉密尔顿抑郁量表(HAMD) [8] :24项评分。
2.3. 磁共振检查
2.3.1. 常规扫描
所有受检对象均使用3.0 T(GE, HDXT)超导MRI成像系统,采用8通道头颈联合线圈进行头部扫描。先进行常规序列扫描。
2.3.2. fMRI扫描
在GE HDxt 3.0 T MRI系统及8通道相控阵列头颅线圈采集MRI数据。扫描期间,嘱被试保持闭目平卧,避免睡着,尽量保持不动。Rs-fMRI扫描共采集210个时间点,扫描参数为:水平斜位,扫描平面平行于前后连接,重复时间(TR) = 2000 ms,回波时间(TE)=30 ms,层数 = 33,矩阵 = 64 × 64,视野(FOV) = 240 mm,翻转角度 = 90°,层厚 = 4 mm,层间距 = 0 mm。
1) 图像后处理
在Matlab R2012b平台上使用静息态fMRI数据处理助手(DPARSFA) v2.2 (http://www.restfmri.net) 将原始数据进行预处理,基于结构像进行配准并空间标准化,去线性漂移,低频滤波,去除协变量。首先计算出全脑每个体素与其周围相邻的26个体素在时间序列上的相似性,得到该体素的和谐系数(Kendal’s coefficient of concordance, KCC)。然后以每个体素的KCC值除以全脑所有体素KCC的均值,得到标准化的fALFF。
2) 统计学分析
使用统计软件SPSS 16.0,对LOD伴MCI组和不伴MCI组的年龄、发病年龄、病程进行两独立样本t检验,对随访前后认知功能、全脑fALFF值进行两配对样本t检验,以P < 0.05认为差异具有统计学意义。
3. 结果
3.1. 两组入组时、随访一年后认知功能比较
LOD伴MCI组于入组时和一年后在MoCA复制图形、持续注意,NTB数字广度测验比较差异有统计学意义(P < 0.05),而LOD不伴MCI组在NTB听觉学习测验1、联想学习测验2比较差异有显著统计学意义(P < 0.01)。见表1。
3.2. LOD伴MCI患者入组时、随访一年后fALFF值比较
图1显示黄色区域即是右侧额上回,入组时、比较随访一年后右侧额上回fALFF值比较差异有统计学意义(P < 0.05),一年后较入组时升高,见表2。

Table 1. Comparison of cognitive function between patients with and without MCI and one year after follow-up ()
表1. LOD伴与不伴MCI患者入组时、随访一年后认知功能比较( )
)
注:*P < 0.05,**P < 0.01。

Table 2. Comparison of whole brain sfALFF between group with LOD and MCI when they were enrolled and one year after follow-up
表2. LOD伴MCI患者入组时、随访一年后全脑sfALFF组间比较
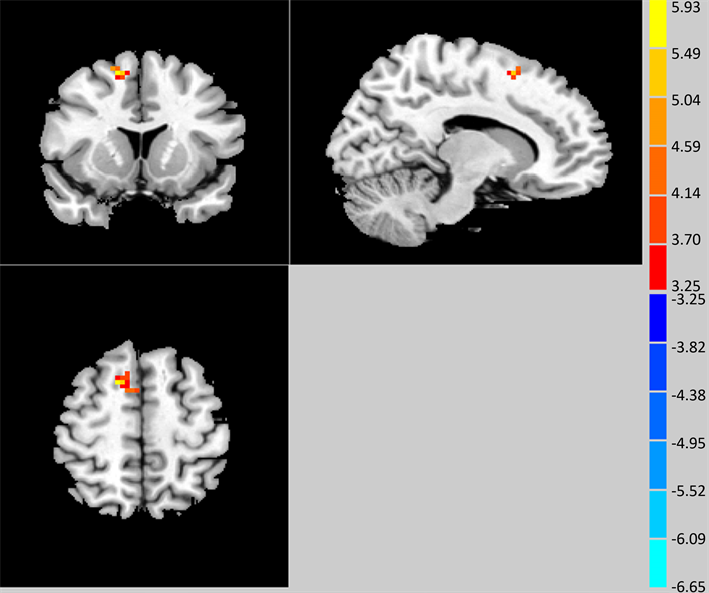
Figure 1. The yellow brain area is the right frontal frontal gyrus, and the value of fALFF in LOD patients with MCI is higher than that in the group after one year (P < 0.05)
图1. 黄色脑区即是右侧额上回,LOD伴MCI患者一年后fALFF值较入组时升高(P < 0.05)
3.3. LOD不伴MCI患者入组时、随访一年后fALFF值比较
图2显示蓝色脑区即是左侧枕中回、双侧额中上回、左侧顶上回/顶下回/楔前叶。LOD不伴MCI患者入组时、比较随访一年后左侧枕中回、双侧额中上回、左侧顶上回/顶下回/楔前叶fALFF值比较差异有统计学意义(P < 0.05),一年后较入组时下降。见表3。
4. 讨论
潘惠英等 [8] 调查分析发现,社区老年MCI患者的抑郁症患病率高达29.9%。Delis等 [9] 的研究发现,LOD和MCI的共病率达35%。一项针对MCI的三年随访研究证实了MCI是老年期痴呆的前驱期,其痴呆的发生率显著高于正常对照老人,并呈现出学习记忆、语言、抽象思维和执行功能等认知功能水平的显著下降 [10]。本研究在LOD患者中找出与MCI共病者以及不伴MCI者,进行为期一年的追踪,观察各自的认知功能变化,发现LOD伴MCI组在一年后MoCA持续注意较入组时下降,而一年后MoCA复制图形、NTB数字广度测验均较入组时上升,提示经过一年随访记忆、执行功能有改善,而注意功能处
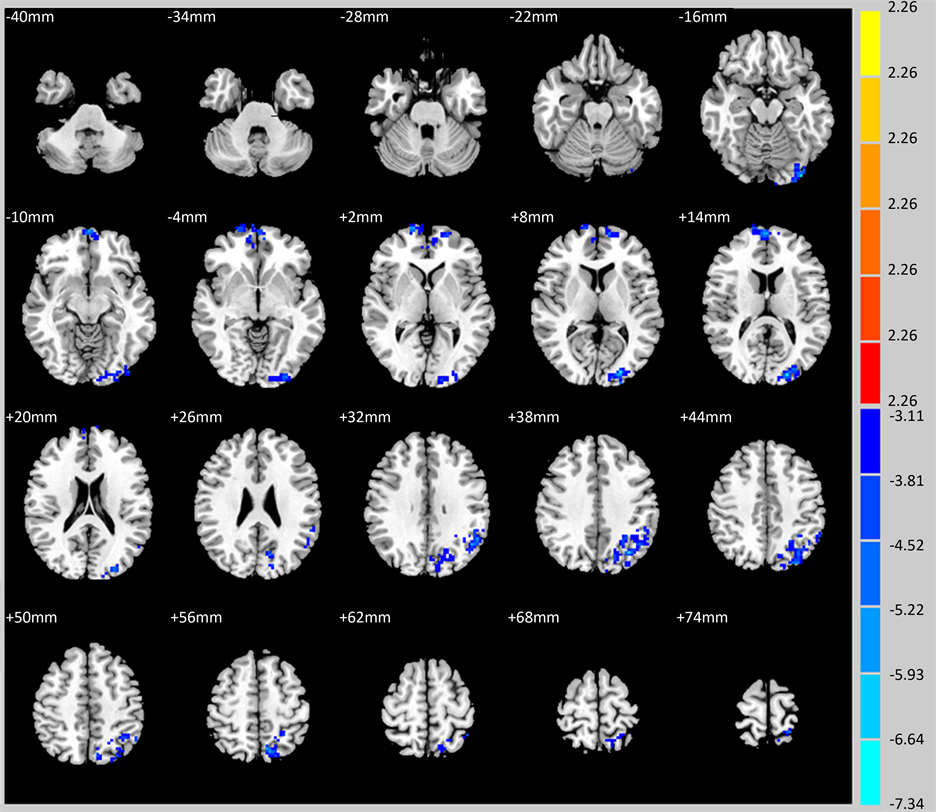
Figure 2. The blue brain region is the left middle occipital middle back, bilateral frontal frontal gyrus, left superior superior gyrus/top inferior gyrus/precuneus. The fALFF value of patients with LOD with MCI is lower than that of the group after one year (P < 0.05)
图2. 蓝色脑区即是左侧枕中回、双侧额中上回、左侧顶上回/顶下回/楔前叶,LOD伴MCI患者一年后fALFF值较入组时下降(P < 0.05)

Table 3. Comparison of whole brain sfALFF between group with LOD without MCI and one year after follow-up
表3. LOD不伴MCI患者入组时、随访一年后全脑sfALFF组间比较
于下降趋势。Butters等 [11] 研究发现,有认知功能损害的老年抑郁症患者某些认知功能会有所改善,但不一定能达到正常水平,特别是记忆和执行功能,本研究结果支持了上述结论。以往有研究认为AD患者在早期即出现注意障碍,注意是继记忆后AD患者第二受损功能 [12] ,可见本研究中先期出现的持续注意障碍,是加速LOD伴MCI患者向痴呆转化的主要认知变化,有别于MCI向痴呆转化的认知变化。另外LOD不伴MCI组在一年后NTB听觉学习测验1、联想学习测验2均较入组时上升,提示记忆功能不降反升,此结果似乎进一步证明了并不是所有的LOD都会向痴呆转变。
神经心理测试在预测LOD伴MCI患者向痴呆进展作为一种主观评价,尚不能客观反映局部脑功能的真实变化状况,rs-fMRI中的fALFF分析方法可以弥补这一不足。基于fALFF分析方法的LOD伴MCI患者局部脑功能变化是否能支持前述认知测试结果,为此,本研究进一步做了探究,以期找到LOD伴MCI患者可能进展为痴呆的确凿证据,以便对痴呆进行早期识别。
关于额叶,依据神经解剖联系及功能区域相结合的方式,Michael Koenigs提出将前额叶区域划分为背外侧及腹内侧前额叶皮质,前者主要包括额中回以及额上回,其主要接受感觉皮层具体的信号,与额叶运动前区、动眼区以及顶叶外侧皮层紧密连接,因此它主要负责认知、执行功能,包括维持操作工作记忆的内容,有目的的行为,抽象思维及注意控制等 [13]。并有静息态研究表明,双侧前额叶功能异常可能是抑郁症认知功能损害的脑功能病理基础 [14]。孙军等 [15] 研究20~59岁抑郁症患者经8周治疗,右侧前额叶ALFF较治疗前增高,并以此评价抗抑郁药疗效。本研究结果显示一年后LOD伴MCI组的右侧额上回的fALFF值较入组时升高,除了抗抑郁药的关系,和认知功能间是否存在关联也是本研究要考虑的。席芊等 [16] 研究发现遗忘型MCI患者前额叶ALFF较正常老年人降低,MCI患者执行记忆任务时,额叶等脑区可有激活增加表现,并认为这是对前额叶损伤的一种代偿。随着MCI向AD进展,代偿脑区的ALFF减弱,活动下降。这一结果给到我们启示,LOD伴MCI有向痴呆进展中,抗抑郁药使得部分执行和记忆功能有所改善,但无法逆转注意功能障碍持续下降,右侧前额叶脑功能激活的现象,很有可能是在执行注意任务时,额叶功能发生了代偿,用“代偿募集假说” [17] 可解释,即当额叶功能障碍时,为了维持等效的行为表现,此脑区会出现更多神经元活动,出现血氧水平依赖效应增强,从而出现较功能正常时更大范围的激活。
本研究另一个值得关注的结果是,LOD不伴MCI患者代表记忆功能的听觉学习测验和联想学习测验在一年随访中呈上升趋势同时,fALFF结果与之相反,发现了左侧枕中回、双侧额中上回、左侧顶上回/顶下回/楔前叶等多个脑区的神经自发活动下降的情况。Greicius等 [18] 用rs-fMRI验证了静息态下默认网络(default mode network, DMN)的存在,包括了本研究涉及到的楔前叶、额中上回、顶叶。近年来的研究发现DMN的异常可能与AD的病理生理具有密切关系。Wang等 [19] 发现,AD患者与DMN的脑区重叠存在广泛区域的功能连接下降。并有研究发现AD患者前额叶、顶叶ALFF是减弱的 [19]。本研究中fALFF的下降提醒我们LOD不伴MCI患者记忆功能改善可能只是抗抑郁药作用下的表象,与认知相关脑区的自发神经活动的下降预示着即使不伴MCI的LOD依旧隐藏着向AD转变的风险。
综上所述,通过一年的随访研究发现持续注意障碍是加速LOD伴MCI患者向痴呆转化的主要认知变化,基于rs-fMRI的fALFF分析方法发现右侧前额叶脑功能有代偿性激活的现象,虽然LOD不伴MCI患者认知功能一年后有提升,但左侧枕中回、双侧额中上回、左侧顶上回/顶下回/楔前叶等多个脑区的fALFF下降则预示着LOD不伴MCI患者仍有向AD转变的潜在风险,可见rs-fMRI结果可敏感于神经心理测试结果,可早期来反映LOD不伴MCI患者的脑功能真实状况,这也是本研究的新颖之处,此结果为AD的早期识别提供了认知神经方面的证据。本研究的不足之处在于样本量非常小,结论应慎重考虑,如单一的额叶功能增强的学说,并不能对抑郁症患者的认知障碍作出满意的解释。今后研究中还应扩大样本量以进一步探明LOD患者认知功能和脑区神经元活动的关系。