摘要:
目的:乳腺癌发生转移是患者死亡的主要原因。我们前期研发了具有良好抑制肿瘤细胞迁移的多肽。然而多肽在体内降解快,不稳定,影响药效。因此,亟需一种方法来降低多肽降解速率。方法:采用脂质纳米盘包裹多肽可以保护多肽,提高多肽稳定性。结果:本文成功构建了多肽纳米盘,纳米盘粒径为16.36 ± 0.37 nm,PDI为0.387 ± 0.039,粒径均匀。多肽的包封率为80.86% ± 0.77%,载药量为1.43% ± 0.01%。多肽对MDA-MB-231细胞没有细胞杀伤作用,空白纳米盘对MDA-MB-231细胞有显著杀伤效果,IC50为262.6 ug/ml。多肽能够显著抑制MDA-MB-231细胞的细胞迁移,在一定浓度范围,多肽浓度越高,抑制作用越强。结论:多肽纳米盘在体外能够显著抑制乳腺癌细胞转移,为转移性乳腺癌治疗提供新方法。
Abstract:
Objective: Breast cancer metastasis is the main cause of death. We have developed a peptide with good inhibition of tumor cell migration. However, the degradation of peptides in vivo is fast and unstable, which affects the efficacy of drugs. Therefore, there is an urgent need for a method to reduce the degradation rate of peptides. Methods: The peptide coated with lipid nanoparticles can protect the peptide and improve the stability of the peptide. Results: In this paper, peptide nanodiscs were successfully constructed. The diameter of nanodiscs was 16.36 ± 0.37 nm, and the PDI was 0.387 ± 0.039. The encapsulation efficiency was 80.86% ± 0.77%, and the drug loading was 1.43% ± 0.01%. The peptide had no cytotoxic effect on MDA-MB-231 cells, while blank nanodiscs had a significant killing effect on MDA-MB-231 cells with IC50 of 262.6 ug/ml. The polypeptide could significantly inhibit the migration of MDA-MB-231 cells. In a certain concentration range, the higher the peptide concentration, the stronger the inhibition effect. Conclusion: Peptide can significantly inhibit the migration of breast cancer cells in vitro, which provides a new method for the treatment of metastatic breast cancer.
1. 引言
乳腺癌是女性中发病率最高的恶性肿瘤,易转移、易复发、死亡率高。乳腺癌患者死亡的主要原因是发生转移 [1] [2] [3]。乳腺癌转移分为淋巴结转移(如腋窝淋巴结转移)和远处脏器转移(如骨转移、骨骼转移、肝脏转移、脑转移等),目前治疗乳腺癌转移的方法有手术、化疗、联合治疗等 [4] [5]。我们前期合成的多肽经研究发现具有良好的抑制肿瘤细胞迁移的作用 [6] [7]。然而,游离多肽容易在体内被降解,不利于给药。纳米盘具有粒径小、稳定性好、生物相容性好等优点 [8] [9]。故本文采用纳米盘将多肽制备成纳米制剂,纳米制剂给药后能够降低多肽在体内的降解速度,延长药物半衰期,具有良好的应用前景。
2. 实验方法
2.1. 实验材料与仪器
二肉豆蔻酰磷脂酰胆碱(1,2-Dimyristoyl-sn-glycero-3-phosphocholine, DMPC)、1,2-二油酰基-sn-丙三基-3-磷脂酰乙醇胺(1,2-Dioleoyl-sn-glycero-3-phosphoethanolamine, DOPE) (美国avanti公司),N-琥珀酰亚胺-3-(2-吡啶二硫代)丙酸酯((N-succinimidyl-3-(2-pyridyldithio)propionate), SPDP) (Sigma Aldrich公司),ApoA-I mimetic peptides 22A (PVLDLFRELLNELLEALKQKLK) (苏州强耀科技有限公司),抑制肿瘤迁移的多肽(同济大学合成,以下称多肽),二氯甲烷、甲醇、碘(国药集团化学试剂有限公司),HSGF254薄层色谱硅胶板(烟台江友硅胶开发有限公司),点样毛细管(Titan公司),柱层析硅胶(阿拉丁公司),石英砂(GENERAL-REAGENT公司),CCK-8试剂盒(日本Dojindo Laboratories),MDA-MB-231细胞(中科院上海细胞生物学研究所)。
MS205DU电子天平(瑞士MettlerToledo公司),R206D旋转蒸发仪(上海申生科技有限公司),Zetasizer nano ZS激光粒度分析仪(英国Malvern公司),JY92-IIDN超声波细胞粉碎机(宁波新芝生物科技股份有限公司),JEM2100F透射电子显微镜(日本JEOL公司),Multiscan MK3酶标仪(美国Thermo Scientific公司),OLYMPUS IX73荧光显微镜(Olympus公司),3111型CO2培养箱(美国Thermo Scientific公司),Nanodrop (美国Thermo Scientific公司),超净工作台(苏州净化设备有限公司),微型双光紫外灯(其林贝尔公司),SLK-O3000-S摇床(美国SCLLOGEX公司)。
2.2. DOPE-PDP的合成及分离鉴定
63 mg DOPE和25 mg SPDP溶解在4 ml无水二氯甲烷中,加入60 ul三乙胺,冲入氮气,置于暗室中反应5 h,反应用薄层色谱监测。展开剂为二氯甲烷:甲醇 = 5:1,反应结束后旋转蒸发二氯甲烷。反应产物用硅胶柱层析分离,洗脱相梯度为二氯甲烷:甲醇16:1,12.5:1。获得提纯后的DOPE-PDP。取少量DOPE-PDP用氘代氯仿溶解,采用质谱进行分析。
2.3. 纳米盘的制备
称取20 mg DMPC,1.3 mg DOPE-PDP,用氯仿溶解,称取10 mgApoA-I mimetic peptides 22A,用甲醇溶解,然后混合,50℃水浴旋转蒸发挥干溶剂,2 ml PBS (pH = 7.4)水化,采用50 W功率进行探头超声5 min,即得空白纳米盘。
将空白纳米盘与多肽混合,室温下摇床上100 rpm摇晃2 h,即得到多肽纳米盘。
2.4. 纳米盘的表征
取10 ul纳米盘溶液,用去离子水稀释至2 ml,取1 ml置于激光粒度测定仪,进行激光散射粒度测定;取1 ml多肽纳米盘,从中取100 ul作为多肽样品,采用超滤管进行离心,超滤管截留分子量为3000 Da,3500 rpm离心2 min,取超滤管下层溶液100 ul作为游离多肽样品,分别采用Nanodrop进行多肽浓度测定。
2.5. 细胞毒性
取对数生长期的乳腺癌细胞MDA-MB-231,胰酶消化,重悬,计数,稀释,使得细胞悬液浓度为3.5 × 104个/ml。取96孔板,将最外边一圈每个孔加入100 ul PBS防止边缘效应,然后其它孔中留5个孔加100 ul培养基作为空白对照,其余孔加入100 ul细胞悬液,置于细胞培养箱中过夜或者孵育12 h。用培养基将游离多肽和多肽纳米盘稀释成不同浓度。去掉旧培养基,加入含多肽培养基,孵育72 h。然后将培养基取出,换位含10% CCK-8的培养基,孵育2~3 h后采用酶标仪测定450 nm处吸光值。按以下公式计算细胞存活率:
[10]
2.6. 细胞迁移
取对数生长期的乳腺癌细胞MDA-MB-231,胰酶消化,重悬,计数,稀释,使得细胞悬液浓度为2 × 105个/ml。将Transwell小室放入24孔板,小室加入无血清培养基、多肽和细胞,24孔内加入750 ul含血清培养基。24 h后吸掉小室的培养基,PBS清洗2次,用4%多聚甲醛固定20 min,用PBS清洗2次,加入750 ul结晶紫染色20 min,PBS清洗2次,用棉签将小室内膜刮干净。最后将小室置于显微镜下观察。
2.7. 统计学方法
采用GraphPad Prism 5.0软件分析数据,实验数据均以x ± s表示。两组样本之间比较采用t检验,多组间采用单因素方差分析。P < 0.05时有统计学差异。
3. 实验结果
3.1. DOPE-PDP的分离与鉴定
由图1(A)可知,SPDP在洗脱液下达到前沿,DOPE还在原点,说明SPDP极性小,DOPE极性大,那么产物DOPE-PDP的点应该在SPDP和DOPE之间,由反应5 h后样品的图(Reaction mixture)可知,SPDP反应完全。经过柱层析分离纯化,得到的产物点样后只有一个点,说明样品提纯成功。由图1(B)可知,DOPE-PDP的分子量为940,与预期计算一致,说明产物即为DOPE-PDP。
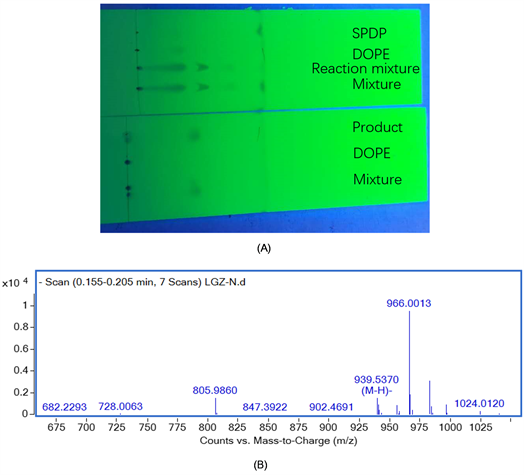
Figure 1. (A) TLC of DOPE-PDP reaction mixture; (B) Mass spectra of DOPE-PDP
图1. (A) DOPE-PDP反应液的薄层色谱图;(B) DOPE-PDP的质谱图
3.2. 纳米盘的表征
由图2可知,多肽纳米盘粒径均匀,粒径为16.36 ± 0.37 nm,PDI为0.387 ± 0.039。采用超滤管离心的方法分别求得多肽纳米盘中多肽浓度为0.270 ± 0.001 mg/ml,游离多肽浓度为0.052 ± 0.002 mg/ml,计算得到多肽的包封率为80.86% ± 0.77%,载药量为1.43% ± 0.01%。
3.3. 细胞毒性
由图3(A)可知,多肽对MDA-MB-231细胞没有显著的细胞杀伤作用,在多肽浓度达到50 ug/ml时细胞活性依然达到90%,在低浓度下(不大于0.61 ug/ml)多肽反而有显著促进乳腺癌细胞增殖的作用,因此在后续实验时需采用高浓度多肽。由图3(B)可知,空白纳米盘在低浓度时对MDA-MB-231细胞没有细胞杀伤作用,在高浓度时具有一定的细胞杀伤作用。空白纳米盘的IC50为262.6 ug/ml,即空白纳米盘浓度在262.6 ug/ml时会抑制50%乳腺癌细胞的增殖。当浓度高于该浓度时,细胞增殖收到显著的抑制。
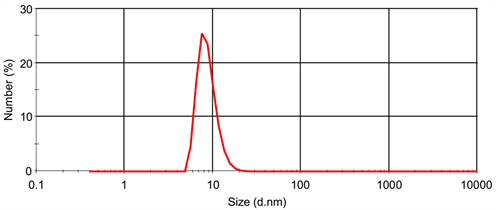
Figure 2. Particle size distribution of peptide nanodiscs determined by dynamic light scattering
图2. 通过动态光散射法测定的多肽纳米盘粒径分布
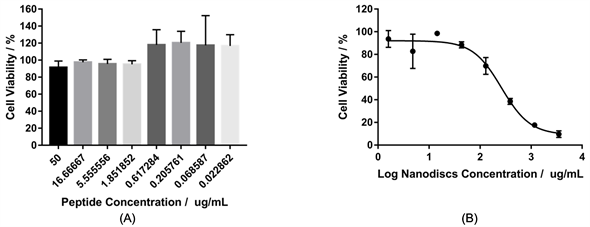
Figure 3. Cell viability of MDA-MB-231 cells incubated with different concentration peptide (A) or nanodiscs (B)
图3. 不同浓度多肽(A)或纳米盘(B)孵育的MDA-MB-231细胞活性
3.4. 细胞迁移
由图4可知,对照组细胞迁移数量多,而当多肽浓度为10 ug/ml时细胞迁移量显著减少,当多肽浓度为20 ug/ml时细胞迁移数量进一步减少,说明多肽能够显著抑制MDA-MB-231细胞的细胞迁移,在一定浓度范围多肽浓度越高,抑制作用越强。
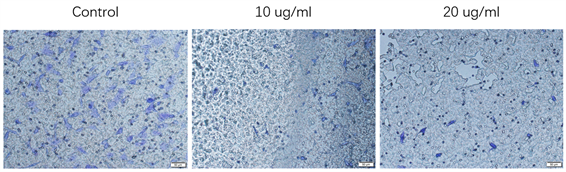
Figure 4. Migration of MDA-MB-231 cells incubated with different concentration peptide
图4. 不同浓度多肽孵育的MDA-MB-231细胞迁移
4. 结论
综上,本论文首先成功合成了DOPE-PDP,然后成功制备了多肽纳米盘,纳米粒径均匀,粒径为16.36 ± 0.37 nm,PDI为0.387 ± 0.039。经过纳米盘的分离纯化,计算得到多肽包封率达到80%。多肽即使浓度达到50 ug/ml,对MDA-MB-231细胞也没有细胞杀伤作用,空白纳米盘对MDA-MB-231细胞具有显著的细胞杀伤作用,空白纳米盘的IC50为262.6 ug/ml。虽然多肽对MDA-MB-231细胞没有细胞杀伤作用,但其在低浓度时还有促进MDA-MB-231细胞增殖的作用,机理有待进一步研究。此外,多肽显著抑制MDA-MB-231细胞的细胞迁移,随着浓度增大,抑制效果越显著。因此,本文成功构建了抑制乳腺癌细胞迁移的多肽纳米盘,为乳腺癌迁移的治疗提供新方法、新策略。
基金项目
本文由国家自然科学基金项目(30801441和81773278)、国家科技重大专项重大新药创制(2018ZX09J18110-004)、军队后勤科研重大项目(AWS14J011)支持。