1. 引言
膀胱癌(bladder cancer, BLCA)是泌尿生殖系统肿瘤中仅次于前列腺癌的诊断最多的恶性肿瘤,在世界上最常见的恶性肿瘤中排位第11位 [1]。2020年,全球约有57.3万例BLCA新确诊病例和21.3万例BLCA患者死亡 [2]。BLCA的主要病理组织学类型是尿路上皮癌(Urothelial carcinoma, UC),占所有膀胱癌的90%以上。根据膀胱壁的浸润深度,BLCA可分为非肌肉浸润性膀胱癌(NMIBC)和肌肉浸润性膀胱癌(MIBC)。超过70%的新诊断BLCA为NMIBC,复发率高,但死亡率低 [3]。然而,只有20%~25%的患者在最初诊断时被确定为MIBC,这是BLCA导致大多数死亡的原因 [4]。尽管接受了积极的治疗,一半的MIBC患者在2年内发生远处转移,60%的患者在5年内死亡 [5] [6]。目前,基于顺铂的化疗仍然是不能手术的局部晚期或转移性尿路上皮癌患者的标准一线治疗方法 [1]。不幸的是,几乎所有患者最终都会进展并死于BLCA [7]。考虑到BLCA的高突变负担,免疫治疗已成为晚期或转移性UC患者的替代治疗方法,特别是免疫检查点抑制剂(Immune cell checkpoint inhibitors, ICIs)。尽管靶向程序性细胞死亡-1 (PD-1)/程序性死亡配体-1 (PD-L1)轴的ICIs在UC的治疗中显示出有希望的结果 [8],但在UC患者中,ICI治疗的部分或完全缓解率仅为20%~30% [9]。因此,迫切需要找到能够预测临床转归、指导临床靶向治疗的可靠预后分子标记物,以改善BLCA的预后。
CDGSH铁硫结构域2 (CISD2)是CDGSH铁硫结构域蛋白家族成员之一,是一种编码小蛋白的进化保守的基因,其位于人类染色体4q24的区域内 [10] [11],它包含跨膜的结构域,CDGSH结构域和铁结合的保守氨基酸序列 [12]。由于CISD2在维持钙代谢、线粒体、氧化还原的完整性和功能中的作用,CISD2当初被认为是一种存活基因和维持长寿的基因 [13]。另外,B细胞淋巴瘤2 (Bcl-2)可以与其相互作用,调节自噬和钙离子稳态,以及调节细胞内铁和活性氧的水平,这也是肿瘤细胞增殖和疾病进展的重要因素 [14] [15] [16]。在国内外研究中该基因与肿瘤的发生、发展关系密切,只在宫颈癌,乳腺癌,原发性肝细胞癌,食道癌,胰腺癌和胃癌等组织中有不同程度的表达,但是该基因对膀胱癌的发生发展尚未见报道。因此,本研究拟采用生物信息学方法,通过公共数据库研究CISD2的mRNA表达情况,并将CISD2不同表达水平与肿瘤免疫微环境中免疫细胞浸润进行相关性分析,探讨基因CISD2与膀胱癌诊断的作用及其与膀胱癌预后生存的关系。
2. 资料方法
2.1. 数据来源
我们从TCGA 数据库(https://portal.gdc.cancer.gov/)公开生物信息学数据库获得膀胱癌(BLCA)样本基因表达信息及预后信息。TCGA提供了414个包含预后信息的BLCA样本和19个正常膀胱组织样本。
2.2. CISD2在BLCA和正常膀胱组织的mRNA表达情况
CISD2在BLCA和正常膀胱的mRNA表达谱通过TCGA数据库获得,使用R语言(3.6.3版本)进行分析比较目的基因表达情况及其与临床病理参数的相关性。
2.3. 膀胱癌病人标本收集
收集新鲜的膀胱癌病人的癌和癌旁组织标本分别放入冻存管中,液氮速冻后于−80℃冰箱保存。
2.4. qRT-PCR
根据说明书的操作步骤进行总RNA的提取(Takara RNAiso Plus kit)。之后,使用AG Biotechnology的RT-PCR试剂盒进行qRT-PCR。内参使用GAPDH (Sangon Biotech, B661104)。人CISD2的引物为: forward primer GTTCGCTAGGCTCACAGTTTC; reverse primer ACGTTTTAGAACGCCAACACC。
2.5. CISD2的生存预后分析
提取TCGA-BLCA数据集中所有膀胱肿瘤患者的生存数据,根据CISD2的mRNA表达量均值分为高低两组进行Kaplan-Meier生存预后分析,然后使用R语言的survminer和survival R包绘制生存曲线。
2.6. CISD2相关分子的富集分析
为进一步探究CISD2基因在膀胱癌发生发展中的潜在作用,我们对TCGA-BLCA数据进行单基因差异分析,根据CISD2的表达中位值分为高表达组和低表达组,使用R语言ggplot2包(3.3.3版本)、clusterProfiler包(3.14.3版本)进行GO/KEGG富集分析。利用String数据库和Cytoscape软件CISD2单基因差异分子进行PPI网络分析。
2.7. 免疫相关性分析
对TCGA中的每个膀胱癌样本,利用R语言的GSVA包(1.34.0版本)通过ssGSEA算法对免疫浸润细胞进行量化,采用Pearson/Spearman相关分析计算风险评分与CISD2的相关性,得到其Pearson/ Spearman相关系数(r)。
2.8. 统计学处理
R软件包“survival”和“survminer”进行Kaplan-Meier存分析。全部统计分析均采用Graphpad prism (8.0版本)进行,采用t检验或单因素方差分析。P < 0.05被认为差异具有统计学意义。
3. 结果
3.1. CISD2在BLCA中的表达情况
从TCGA数据库的研究中,与非癌组织相比,CISD2在BLCA中的表达升高(图1(A)和图1(B))。该结果表明CISD2可能在BLCA过程中起促进作用。
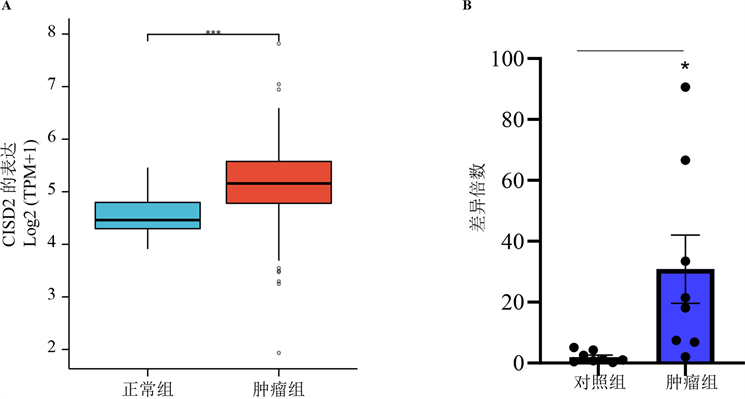 (A) 与对照组相比,CISD2在BLCA中的mRNA表达升高(TCGA BLCA中的RNA-seq数据)。其中,414个BLCA样本和19个正常膀胱组织样本。(B) qRT-PCR实验验证膀胱癌患者癌及癌旁组织中CISD2基因的表达水平(癌旁/癌组织:n = 8)。Error bars代表means ± SEM。与指定组相比,*P < 0.05,***p < 0.001。
(A) 与对照组相比,CISD2在BLCA中的mRNA表达升高(TCGA BLCA中的RNA-seq数据)。其中,414个BLCA样本和19个正常膀胱组织样本。(B) qRT-PCR实验验证膀胱癌患者癌及癌旁组织中CISD2基因的表达水平(癌旁/癌组织:n = 8)。Error bars代表means ± SEM。与指定组相比,*P < 0.05,***p < 0.001。
Figure 1. Expression level of CISD2 in BLCA
图1. CISD2在BLCA中的表达水平
3.2. BLCA患者中CISD2表达与临床病理参数的相关性
由于CISD2在BLCA中的作用尚不清楚,CISD2表达水平与临床病理特征的相关性研究可以帮助我们揭示CISD2在BLCA进展中的作用。结果表明,CISD2表达水平与TCGA-BLCA数据中年龄、性别、种族和 TNM 的阶段变化显著相关(图2(A)~(F))。因此,CISD2可能参与了促进BLCA疾病的进展。
3.3. CISD2表达在BLCA中的预后分析
为了了解CISD2表达在BLCA中的预后作用,我们进行了Kaplan-Meier生存分析。结果表明,与CISD2低表达组相比,BLCA患者高表达CISD2时预后更差(图3(A)~(C))。进一步,我们进行了BLCA患者的CISD2的ROC曲线分析,结果AUC > 0.8 (图3(D)),表明CISD2作为预测BLCA肿瘤进展的分子靶点具有一定的准确性。
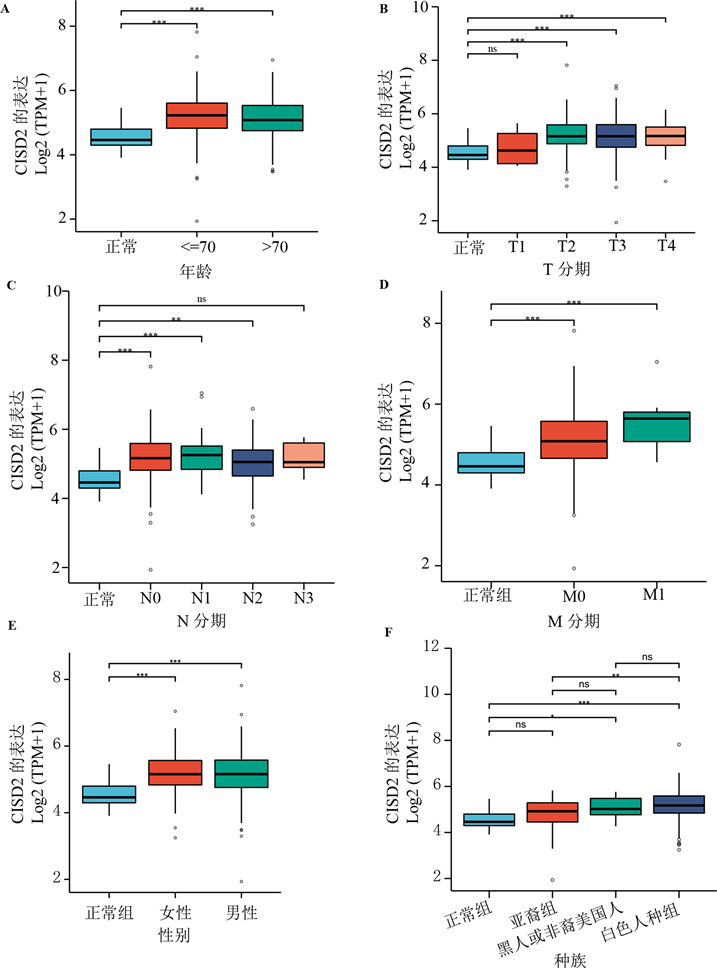 (A)~(F) CISD2在BLCA中的表达水平与年龄、TNM分期、性别及种族相关。Error bars代表means ± SEM。与指定组相比,*P < 0.05,**p < 0.01,***p < 0.001。
(A)~(F) CISD2在BLCA中的表达水平与年龄、TNM分期、性别及种族相关。Error bars代表means ± SEM。与指定组相比,*P < 0.05,**p < 0.01,***p < 0.001。
Figure 2. Analysis of correlation between CISD2 and clinicopathologic data subgroups
图2. CISD2与临床病理资料亚组的相关性分析
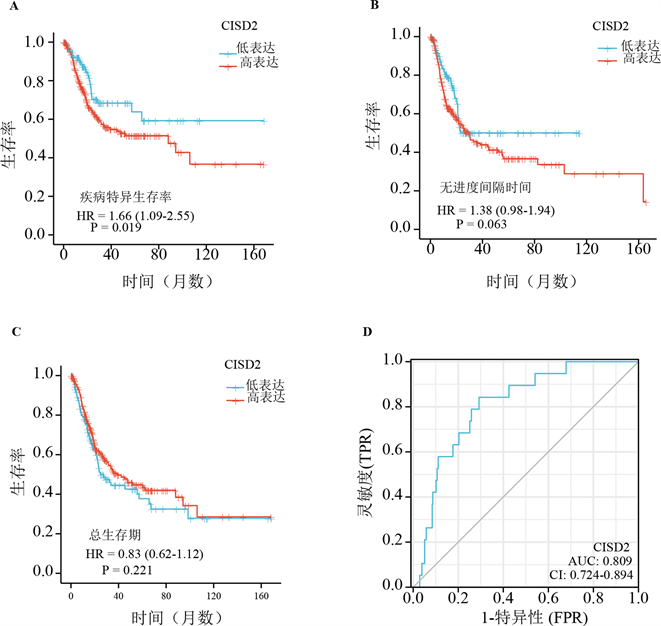 (A)~(C) CISD2表达水平与疾病生存特异生存率、无进展间隔时间、总生存期相关性分析(Kaplan-Meier曲线,n = 433)。(D) CISD2的ROC曲线分析。
(A)~(C) CISD2表达水平与疾病生存特异生存率、无进展间隔时间、总生存期相关性分析(Kaplan-Meier曲线,n = 433)。(D) CISD2的ROC曲线分析。
Figure 3. Prognostic analysis of CISD2 in BLCA
图3. CISD2在BLCA中的预后分析
3.4. CISD2基因功能富集分析
在TCGA-BLCA中,将CISD2按中位数表达值分为高表达组和低表达组,利用R语言DESeq2包分析这两组中的差异表达分子,之后将与CISD2高表达正相关的分子和负相关的分子分别进行GO/KEGG富集分析和PPI网络分析(图4和图5)。与CISD2高表达正相关的分子主要富集在成纤维细胞生长因子受体信号通路,提示CISD2基因可能通过上述通路发挥促进肿瘤发生发展的作用。
3.5. CISD2与免疫浸润水平之间的关联
我们通过R语言GSVA包分析探讨了CISD2表达是否会影响BLCA中的各种免疫细胞浸润水平。Pearson相关分析证实了CISD2表达与Th2 cells (r = 0.443, p < 0.001)、Th1 cells (r = 0.200, p < 0.001)、aDC (r = 0.183, p < 0.001)、NK CD56dm cells (r = 0.156, p = 0.001)、T helper cells (r = 0.144, p = 0.003)、Tgd (r = 0.151, p = 0.002)、Neutrophils (r = 0.104, p = 0.034)、Macrophages (r = 0.124, p = 0.011)等呈显著正相关关系;而与B cells (r = −0.103, p = 0.036)、mast cells (r = −0.130, p = 0.008)、NK CD56bright cells (r = −0.168, p < 0.001)、pDC (r = −0.238, p < 0.001)呈显著负相关关系(图6(A),图6(B))。Spearman相关性分析与Pearson相关分析结果基本一致。这些结果证实CISD2参与调节BLCA中的各种免疫细胞浸润。
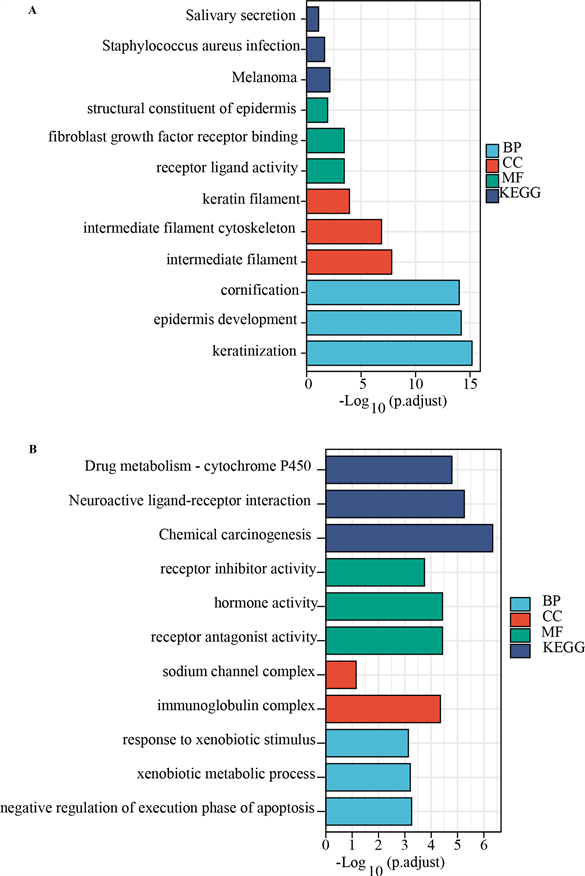 (A) 在TCGA-BLCA中与CISD2高表达正相关分子的GO/KEGG富集分析。(B) 在TCGA-BLCA中与CISD2高表达负相关分子的GO/KEGG富集分析。
(A) 在TCGA-BLCA中与CISD2高表达正相关分子的GO/KEGG富集分析。(B) 在TCGA-BLCA中与CISD2高表达负相关分子的GO/KEGG富集分析。
Figure 4. GO/KEGG enrichment analysis was conducted after CISD2 difference analysis in TCGA-BLCA
图4. TCGA-BLCA中CISD2差异分析后进行GO/KEGG富集分析
 (A) 在TCGA-BLCA中与CISD2高表达正相关分子的PPI网络分析。(B) 在TCGA-BLCA中与CISD2高表达负相关分子的PPI网络分析。
(A) 在TCGA-BLCA中与CISD2高表达正相关分子的PPI网络分析。(B) 在TCGA-BLCA中与CISD2高表达负相关分子的PPI网络分析。
Figure 5. PPI network analysis after CISD2 difference analysis in TCGA-BLCA
图5. TCGA-BLCA中CISD2差异分析后进行的PPI网络分析
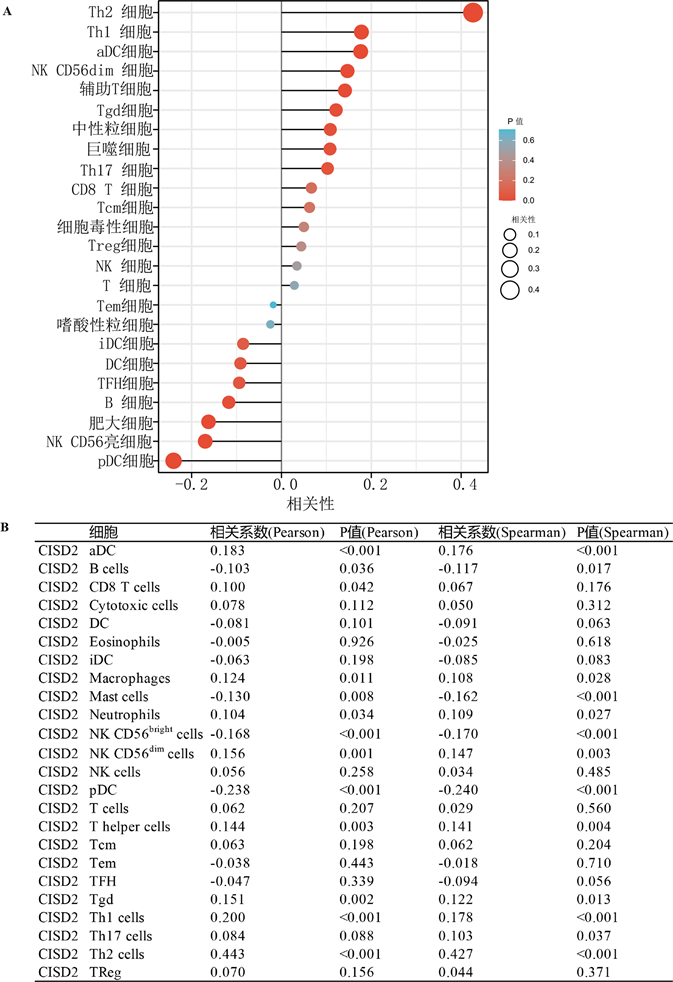 (A) (B) CISD2表达与肿瘤免疫细胞浸润水平分析。与指定组相比,*p < 0.05,**p < 0.01,***p < 0.001。
(A) (B) CISD2表达与肿瘤免疫细胞浸润水平分析。与指定组相比,*p < 0.05,**p < 0.01,***p < 0.001。
Figure 6. CISD2 expression was correlated with the levels of immunocyte infiltration in various tumors
图6. CISD2表达与多种肿瘤免疫细胞浸润水平相关
4. 讨论
膀胱癌(BLCA)是泌尿生殖系统肿瘤中仅次于前列腺癌的诊断最多的恶性肿瘤,在世界上最常见的恶性肿瘤中排位第11位 [1]。2020年,全球约有57.3万例BLCA新确诊病例和21.3万例BLCA患者死亡 [2]。因此,找到能够可靠的BLCA预后分子标记物,以改善BLCA的预后具有非常重要的临床意义。
CISD2在几种已知类型的人类癌症中都有异常表达。在早期宫颈癌、乳腺癌、原发性肝细胞癌、食道癌、胰腺癌和胃癌等肿瘤中,CISD2的表达水平显著升高,并且通常预后较差 [17] - [24]。过去的研究表明,CISD2被认为是早期宫颈癌患者转移和预后相关的新指标 [17];CISD2的表达增加会促进前列腺癌细胞的侵袭和迁移 [15];在胰腺癌中,CISD2 (NAF-1)过表达与晚期临床和T期、血管浸润、远处转移和肿瘤大小有关 [19]。过表达CISD2在人胃癌中具有预后价值,在对261例胃组织和患者肿瘤进行免疫组织化学分析,发现高CISD2表达与癌症的分期、分类、静脉和淋巴浸润转移等临床显著相关;过表达和抑制胃癌细胞系NAF-1的研究进一步表明,NAF-1水平与细胞增殖呈正相关 [19];且对196例HCC患者进行的CISD2表达和肝癌进展的临床病理分析表明,CISD2的表达可以用作生存的独立预后标志物,高NAF-1表达的患者比低CISD2表达的患者表现出较短的整体生存率和较高的复发率 [18];还发现CISD2沉默通过Wnt/β-catenin途径显著抑制EMT [19]。在国内外研究中CISD2与肿瘤的发生、发展关系密切,只在宫颈癌、乳腺癌、原发性肝细胞癌、食道癌、胰腺癌和胃癌等组织中有不同程度的表达,但是该基因对膀胱癌的发生发展尚未见报道。
在这项研究工作中,我们利用公共数据对CISD2进行了生物信息学分析。结果表明,BLCA中的CISD2 mRNA水平明显高于非癌性膀胱组织。并且CISD2的表达水平对原发肿瘤状态、淋巴结转移情况和肿瘤病理分期等临床参数有显著影响。另外,生存分析进一步表明CISD2表达影响BLCA患者总体生存率。因此,我们的结果表明,CISD2参与BLCA组织的病理进展,可作为潜在的预后生物标志物,CISD2参与BLCA肿瘤进展的机制值得进一步研究验证。
我们进一步分析了CISD2高表达组和CISD2低表达组中差异共表达分子的富集情况。结果,BLCA中与CISD2共表达的大部分基因,不论是正相关还是负相关,都与BLCA肿瘤进展有显著相关性。其中,与CISD2高表达正相关的分子主要富集在成纤维细胞生长因子受体信号通路。CISD2对于维持钙离子的稳态平衡起重要的作用,钙离子可促进成纤维细胞生长因子的表达,进而激活成纤维细胞生长因子受体信号通路,最终促进肿瘤的进展。CISD2-Ca2+-纤维细胞生长因子受体信号通路这一信号轴在膀胱癌进展中的作用值得未来进一步研究和探索。
免疫疗法在膀胱癌治疗过程中有着悠久的历史,随着卡介苗(BCG)的使用,免疫疗法在非肌层浸润性膀胱癌的治疗中发挥了重要作用。后来发现阻断免疫检查点可治疗多种肿瘤,包括膀胱癌等。免疫检查点抑制剂在晚期膀胱癌中的应用开启了晚期膀胱癌治疗的新纪元。但仍有一部分病人对免疫检查点抑制剂不起反应,因此,为了取得更好的疗效,寻找新的分子标记物直接或预测患者对免疫检查点抑制剂的响应率显得非常重要。多项研究发现免疫细胞浸润水平(比如CD4+ T细胞、CD8+ T细胞)与阻断免疫检查点的治疗疗效呈正相关。在我们的研究中发现TCGA-BLCA数据集中的CISD2表达水平与Th2 cells、Th1 cells、aDC、NK CD56dm cells、T helper cells、Tgd、Neutrophils、Macrophages等免疫细胞浸润水平呈正相关,而与B cells、mast cells、NK CD56bright cells、pDC呈显著负相关关系。这些结果表明CISD2的高表达可以通过提高免疫细胞的浸润水平来改变BLCA患者肿瘤的免疫微环境,从而有可能提高BLCA患者使用免疫检查点抑制剂进行治疗的效果和影响患者的预后。这一结果清楚地表明,CISD2对BLCA的肿瘤微环境中免疫细胞的浸润具有广泛的作用,值得在肿瘤免疫治疗领域进一步研究。
我们得出的结论是,CISD2可能是BLCA的潜在预后分子靶标。CISD2表达提高导致临床特征恶化(原发肿瘤范围、远处转移、肿瘤病理分期和预后)。CISD2已被证实参与调节多种免疫细胞的浸润。在这项研究中,我们发现CISD2的表达水平升高与肿瘤组织中各种肿瘤浸润免疫细胞(TIICs)的浸润水平升高明显相关。因此,在我们的临床工作中,我们可以尝试通过测量BLCA患者手术标本中CISD2的表达来评估患者的恶性程度,预测患者的预后,甚至更好地评估免疫微环境的状态,并开发针对CISD2的免疫治疗药物。我们强烈建议肿瘤免疫学领域的研究人员进一步研究CISD2在BLCA中的作用,逐步阐明CISD2在BLCA患者免疫微环境中的生物学功能和预后。
基金项目
山东省卫计委首批齐鲁卫生与健康领军人才项目(2019020217);南通市科技计划项目(JC2021018)。
NOTES
*通讯作者Email: wangke@qdu.edu.cn