1. 引言
生物医用金属材料由于优异的力学和耐腐蚀性能,被广泛应用于血液接触类介入器械的制造,如316 L SS等 [1] [2] 。然而,生物医用金属材料(如心血管支架)在植入过程中可能引起血管损伤以及由于材料表面的刺激,诱发血小板粘附聚集并活化,从而触发凝血级联反应并促进凝血,最终导致血栓在这类材料表面形成 [3] 。表面改性是提高生物医用金属材料血液相容性的重要手段,通过在材料表面固定生物活性分子来抑制促凝因子可以显著的降低表面血栓 [4] 。因此,抗凝血活性分子的选取和固定方法成为优化涂层抗凝血性能的关键。
在众多具备抗凝血活性的分子中,一氧化氮(NO)因其独特的作用于血小板的抗凝途径而受到广泛关注 [5] 。人体中NO供体(如GSNO)通过内源酶催化释放NO,增加血小板中环磷酸鸟苷(cGMP)水平而降低活化血小板所需的钙离子浓度 [6] ,从而显著抑制血小板的粘附与激活。因此,近年来有诸多研究报道了通过构建NO释放或催化释放型表面来提高生物材料的血液相容性 [7] [8] 。Elizabeth J. Brisbois等 [9] 通过将NO供体S-nitroso-N-acetylpenicillamine (SNAP)装载进Elast-eon E2As高分子层,实现了NO供体在高聚物内的长期存留,同时还具有良好的抗凝血性能。Zhilu Yang等 [10] 将3,3-diselenodipropionic acid (SeDPA)共价固定在等离子聚烯丙胺薄膜上,实现NO的长期稳定催化。此外,利用偶氮二醇烯鎓(Diaze niumdiolate, NONOate)来实现NO的装载与释放也得到了研究,高聚物中的仲氨基与NO在乙醇钠/乙醇溶液体系下与伯氨基反应生成偶氮二醇烯鎓(Diaze niumdiolate, NONOate)。作为NO供体的一种,一分子的偶氮二醇烯鎓在生理流体条件下质子化水解释放两个生物活性的NO分子。NONOate水解过程不需要特定的代谢物或氧化还原机制,因而可以方便的利用这类NO供体合成前药应用于医学领域,同样也适用于高分子涂层的改性。Melissa M. Reynolds等 [11] 将含仲氨基团的分子嵌段共聚在聚氨酯中,从而实现直接针对聚合物骨架的偶氮二醇烯鎓化。该二醇烯鎓化的聚氨酯在PBS条件中具有10 pmol∙cm−2∙s−1的NO初始释放速率并且持续6天还有可观察到的释放速率。
然而,这些NO释放的策略往往存在复杂的高分子涂层设计,涂层过厚以及对不同材料不具有普适性的问题,而NO催化释放的策略则又存在生理条件下催化量释放NO量不足以短期高效抗凝血等问题 [12] ,这些问题很大地限制了NO(催化)释放表面的普遍应用。因此,设计一款不依赖基底材料且具有高NO装载密度的超薄涂层对于血液接触器械在体内/半体内血液接触条件实现高效抗凝具有重要意义。
目前,基于等离子体自由基聚合(简称等离子聚合)技术在生物医用材料表面化学气相沉积高聚物的涂层得到了长足的发展 [13] 。分子单体在亚真空条件辉光放电,产生分子活性种。活性种着陆于材料表面或形成低聚体作用于材料表面,进一步聚合增长成为连续致密的涂层 [14] 。等离子聚合涂层不改变本体材料的结构和性质,在材料表面具有良好的结合力,同时还可以根据目的方便地引入不同的活性官能团 [15] ,为植入器械表面改性提供了有力支撑。
在此,本研究中通过等离子聚合技术在316 L SS表面构建了厚度小于100 nm的超薄等离子聚烯丙胺(PPAam)涂层,并利用NO在乙醇钠/乙醇溶液体系与该涂层中丰富的伯氨基反应生成偶氮二醇烯鎓,制备出了具有高NO装载量涂层(NO-PPAam)。我们使用了化学发光法实时检测了NO-PPAam的NO释放行为,并利用体外血小板粘附激活实验和半体内实验验证了该涂层抗凝血效果。
2. 实验部分
2.1. 实验材料
烯丙胺单体(纯度 ≥ 99.0%,Sigma);一氧化氮(纯度 ≥ 99.9%,武汉纽瑞德特种气体有限公司);甲醇、甲醇钠(纯度 ≥ 98.0%,成都市科隆化学品有限公司);CD62p抗体(GMP-140, Serotec Co.);HRP抗体(KPL Co.);新西兰大白兔(成都达硕实验动物有限公司)。
光谱型椭圆偏振仪购自美国J. A. Woollam公司;J Y-82接触角仪购自河北承德仪器厂;傅里叶红外光谱仪购自美国Thermo Fisher Scientific公司;NO分析仪购自美国GE analytical instruments公司;X-射线光电子能谱仪购自美国Thermo Electron公司;电子显微镜购自日本Jeol公司。
2.2. 等离子体聚烯丙胺涂层的制备
2.2.1. 等离子体聚烯丙胺制备
采用自制脉冲射频(13.56 MHz)等离子体聚合装置进行涂层沉积,实验装置如图1中A所示。
涂层制备工艺:将反应腔室真空抽至1 Pa,通入3.5 sccm流量的氩气(Ar),在功率为80 W下对反应腔室及样品表面进行Ar等离子体溅射清洗5 min。随后将反应腔室真空抽至1 Pa,通入3.5 sccm烯丙胺(Aam)单体和2.5 sccmAr。在功率为80 W,负偏压75 V,占空比为40% (ton = 20 ms, ton = 30 ms)条件下沉积60 min,获得厚度约为95 nm的PPAam涂层。
2.2.2. 偶氮二醇烯鎓功能化涂层制备
将等离子体聚合涂层表面浸没于0.5 M甲醇钠(NaOMe)/甲醇(MeOH)溶液,放置于密闭的不锈钢
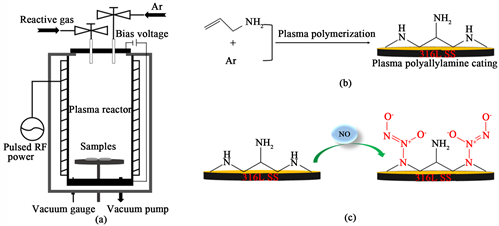
Figure 1. (a) Schematic diagram of the experimental setup; (b) Plasma polymerization of allylamine and argon to form polyallylamine; (c) Schematic diagram of NO modified plasma polyallylamine coating
图1. (a) 等离子体实验装置简图;(b) 烯丙胺和氩气通过等离子体聚合制备等离子体聚烯丙胺涂层;(c) 等离子体聚烯丙胺涂层与NO反应示意图
单体罐。向单体罐中通入20 psi N2 (g)三次以排除单体罐中剩余空气,随后通入NO (g)并在75 psi下反应3天。样品取出后经甲醇清洗以除去物理吸收的残余副产物,例如NaOMe或NO (g)。使用前保存在−20℃。
2.3. 材料学表征
2.3.1. 光谱型椭圆偏振仪(Spectral Ellipsometer)
采用光谱型椭圆偏振仪检测NONOate功能化前后PPAam涂层厚度变化。
2.3.2. 水接触角检测采用接触角仪(Water Contact Angle, WCA)
采用接触角仪检测316 L SS以及NONOate功能化修饰前后PPAam涂层表面的亲疏水性。
2.3.3. NO分析仪(Chemiluminescence NO Analyzer)
使用NOA 280 i NO化学发光NO分析仪检测PPAam和NO-PPAam涂层中NO的释放。在37℃下pH = 7.4的PBS中检测PPAam和NONOate功能化涂层的NO释放速率。涂层中释放的NO被N2输送到分析器,直到NO释放量为0 ppb∙cm−2∙sec−1停止检测。
2.3.4. 傅里叶变换红外光谱学(Fourier Transform Infrared Spectroscopy, FTIR)
采用傅立叶变换红外光谱仪检测NONOate功能化前后涂层的化学结构变化,设定测量范围为4000~400 cm−1。
2.3.5. X-射线光电子能谱仪(X-Ray Photoelectron Spectroscopy, XPS)
采用X射线光电子能谱测定样品的表面化学元素组成,激发光源为Al Kα (1486.6 eV),荷电位移校正C1s = 284.5 eV。
2.3.6. 扫描电子显微镜(Scanning Electron Microscope, SEM)
使用扫描电子显微镜观察表面血小板粘附形态和血栓情况等。
采用SPSS软件进行方差分析,检验水准α = 0.05。
2.4. 血液相容性评价
2.4.1. 血小板粘附及激活率
新鲜人静脉血与柠檬酸钠抗凝剂按照体积比9:1混合后,在1500 r/min下离心15 min收集得到富含血小板的血浆(PRP)。在316 L SS、PPAam、NO-PPAam涂层表面(10 × 10 mm2)滴加120 μL新鲜PRP后在37℃下孵育30 min,经生理盐水充分漂洗3次后,于2.5%的戊二醛溶液中固定12 h。脱水脱醇后,通过SEM对样品表面血小板形貌进行观察并统计血小板粘附数量。
血小板激活率由血小板GMP-140表达量反应,因此采用P-选择素(GMP-140)评价血小板激活率 [16] 。在316 L SS、PPAam、NO-PPAam表面分别滴加50 μL PRP在37℃下孵育2 h,经生理盐水充分漂洗。样品表面分别加入20 μL 1:100的CD62p抗体,37℃下继续孵育1 h。在样品表面滴加20 μL HRP标记的羊抗鼠多克隆抗体,于37℃下孵育1 h。充分漂洗表面并加入100 μL 3,3’,5,5’-四甲基联苯胺显色底液(TMB),反应10 min后加入50 μL H2SO4 (1 M)终止显色反应。样品表面吸取120 μL溶液至96孔板,置于酶标仪450 nm处读取吸光度值。
2.4.2. 动物半体内血液循环实验
动物实验中所有操作均按照动物实验规定进行。实验动物选用2.5~3.5 kg新西兰大白兔,裸316 L SS和PPAam作为对照样(n = 3),NO-PPAam (n = 3)作为实验样。试验在动物全身麻醉状态下进行,且不使用任何抗凝剂。将兔子的左颈动脉和颈静脉剥离,通过放置有样品的生物医用导管相连接兔颈动脉、颈静脉使血液流回心脏形成半体内血液循环。实验结束后,对血栓质量、血液流速及堵塞率等进行统计。经2.5%的戊二醛固定、逐级脱水脱醇及临界点干燥后,采用SEM对涂层表面进行观察。
3. 结果及分析
3.1. FTIR测试
通过自制脉冲射频(13.56 MHz)等离子体聚合装置将涂层制备到镀金石英片表面,利用FTIR对NO处理前后PPAam涂层化学结构变化进行检测分析。FTIR结果如图2所示,PPAam涂层红外光谱3350~3225 cm−1处N-H伸缩振动峰,3000~2894 cm−1 C-H伸缩振动峰,1650~1550 cm−1的-NH-振动峰以及1630 cm−1处N-H伸缩振动峰,表明PPAam涂层的成功制备,并保持有良好的烷氨结构。与PPAam相比,NO-PPAam的化学结构出现明显的变化。在NO-PPAam光谱中出现NONOate结构特有的吸收峰,如1480~1540 cm−1处出现的N-N特征峰,1385 cm−1处N-O振动峰以及1600~1650 cm−1 N=N伸缩振动峰 [17] 。这些典型的特征新峰出现,证明NO是以NONOate方式成功的固定在PPAam涂层当中。

Figure 2. FTIR spectra of the PPAam (Black) and NO-PPAam coating (Blue)
图2. PPAam (黑色)和NO-PPAam (蓝色)红外光谱图
3.2. XPS结果
N1s和O1s高分辨图谱显示,NONOate功能化前后的PPAam涂层表面化学组成和构成均具有显著性的改变。与PPAam的N1s高分辨合谱相比,NO-PPAam在402.5 eV处出现新峰,推测新峰主要归属于NONOate结构中的二氮烯鎓[−N(O)=NO−]结构,如图3(a)所示。同样的,NO-PPAam相比于PPAam的O1s高分辨谱,在535.2 eV处出现的新峰,推测也是归属于[−N(O)=NO−]中的[NO−]结构,如图3(b)所示。同红外结果一起,XPS分析表明NO在PPAam涂层中以NONOate形态成功固定。

Figure 3. N1s and O1s high-resolution spectra of PPAam (a) and NO-PPAam (b)
图3. PPAam和PPAam涂层N1s (a),O1s (b)高分辨率谱图
3.3. 涂层厚度及水接触角结果
316 L SS表面沉积PPAam涂层后,其表面颜色发生明显的变化,失去原有的金属光泽变为金黄色,如图4(a)所示。椭圆偏光检测结果显示316 L SS表面PPAam涂层厚度约为90 nm。通过颜色改变与涂层厚度检测结果,证明316 L SS表面成功的制备PPAam。NO处理过的PPAam (NO-PPAam)的颜色、厚度没有发生显著变化。
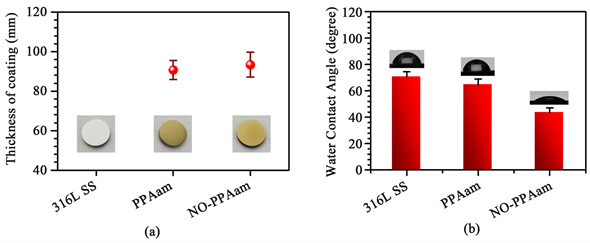
Figure 4. (a) The thickness of coatings (b) water contact angle of 316 L SS, PPAam and NO-PPAam coating
图4. (a) 316 L SS、PPAam和NO-PPAam涂层厚度和(b)水接触角
材料表面亲疏水性是影响生物相容性的重要因素之一 [18] ,表面官能团类型与表面的亲疏水性紧密相关,例如氨基、羧基等极性、可离化基团通常具有很高的亲水性,即极低的水接触角 [19] 。水接触角仪检测结果如图4(b)所示,相比于316 L SS,表面沉积PPAam涂层后,由于亲水性基团如胺基、腈基和亚胺基等基团存在,水接触角由70˚减小到63˚。NONOate功能化的NO-PPAam涂层的水接触角为43˚,其亲水性得到明显增加,这可能与涂层中NONOate易质子化水解的性质有关。
3.4. NO释放结果
采用NO分析仪检测NO处理前后的PPAam涂层(分别标记为PPAam与NO-PPAam) NO释放速率。NO释放结果如图5所示,PPAam(蓝色)涂层NO释放曲线结果表明涂层本身不具备NO释放能力。对NO-PPAam涂层NO释放曲线(红色)积分计算得到,在85 min内NO的释放总量达到41.5 nmol/cm2。NO释放结果证明了NO可以有效存储到PPAam中,并在数十分钟内得到高效释放。

Figure 5. NO release from PPAam (Blue) and NO-PPAam (Red) coating
图5. PPAam (蓝色)和NO-PPAam涂层(红色) NO释放量
3.5. 血小板粘附激活评价
根据血小板的激活程度不同,血小板粘附形态可以分为圆形、树枝状、部分铺展的树枝状、铺展和完全铺展等五个等级 [20] 。样品表面血小板粘附SEM结果如图6所示。316 L SS和PPAam表面血小板粘附数量较多、且都表现严重铺展激活形态。由于不锈钢表面带有正电荷而促进血小板的粘附激活 [21] ,PPAam涂层表面存在大量氨基,会诱发血小板的粘附激活,从而导致316 L SS、PPAam表面血小板出现大量黏附激活 [22] 。相比于316 L SS和PPAam,NO-PPAam表面仅粘附少量呈圆形状的血小板。表明NONOate功能化修饰的PPAam涂层显著性的抑制血小板粘附和激活。
血小板统计结果如图6(b)所示,316 L SS与PPAam表面血小板黏附数量并无较大差异,密度约为1.5 × 104个/平方毫米。NO-PPAam表面粘附血小板密度约为3 × 103个/平方毫米,相比于PPAam表面的粘附数量降低了5倍,有效的降低了血小板粘附。血小板的激活率如图6(c)所示。GMP-140是一种存在于血小板内膜上的蛋白,血小板活化后细胞膜翻转,暴露出GMP-140的结合位点,通过定量GMP-140可以确定血小板激活程度 [23] 。实验结果表明,NO-PPAam上GMP-140表达量仅为316 L SS和PPAam表面的22.3%,降低了4倍,具有显著性统计学差异。以上结果表明了NO-PPAam表面具有优异的抗血小板粘附与激活的性能。

Figure 6. (a) The morphology of platelets on the surfaces of 316 L SS, PPAam and NO-PPAam coating; (b) Number of platelets adhesions on surfaces; (c) Platelets activation rate on surfaces
图6. (a) 316 L SS、PPAam和NO-PPAam表面血小板的形貌;(b) 316 L SS、PPAam和NO-PPAam表面的血小板粘附数量;(c) 316 L SS、PPAam和NO-PPAam表面的血小板激活率
3.6. 半体内动物血液相容性评价
半体内动物血液循环实验因循环血液具有体外全血实验所不具备的血液稳态调节机制,血液成分最真实的接近了血液接触材料实际的使用情况,因而被采用来进行评价NONOate功能化前后PPAam涂层的血液相容性。图7(a)为动物半体内血液循环示意图。样品紧贴于医用导管内壁,如图7(b)所示。经过90 min半体内血液循环实验后,样品表面血栓情况如图7(c)所示,316 L SS和PPAam表面都明显形成血栓,而NO-PPAam涂层表面没有明显的血栓形成。对不同表面血栓重量进行统计分析,图7(d)中316 L SS和PPAam表面血栓质量分别25.2,22.3 mg/cm2,而NO-PPAam表面血栓量仅为1.52 mg/cm2,因此相比于316 L SS和PPAam,NO-PPAam表面血栓下降了14.5倍,显著地降低了血栓形成。利用SEM表征样品表面凝血情况,如图7(e)所示,316 L SS和PPAam样品表面出现大量纤维蛋白原网络,将大量红细胞网络于网状结构,形成典型的红血栓,而NO-PPAam样品表面仅出现一些蛋白粘附,表面并没有出现严重血小板粘附激活现象,抑制了纤维蛋白原网络结构的形成。动物半体内血液循环实验表明,NONOate功能化的PPAam可以赋予材料表面优异的抗血栓性能,显著性的提升材料表面的血液相容性。

Figure 7. (a) Schematic diagram of semi-external blood circulation in animals, red arrows indicate direction of blood flow driven by the heart; (b) Extracorporeal catheter photos after 90 minutes of blood circulation; (c) The thrombus weight of samples surface; (d) The samples thrombus of surface; (e) Thrombus SEM of samples surface
图7. (a) 动物半体内血液循环示意图(红色箭头表示血液的方向由心脏驱动的流动);(b) 血液循环90分钟后导管照片;(c) 样品表面血栓情况;(d) 血栓质量;(e) 样品表面扫描电镜图
4. 总结
在316 L SS成功制备了NO-PPAam改性涂层,利用生理条件释放NO,通过抑制血小板粘附与激活的途径,实现涂层优异的抗血栓性能,从而显著地改善材料表面的血液相容性。这种NONOate功能化修饰的PPAam涂层因具有不依赖基底材料、超薄、高NO装载量等特点,在血液接触类材料表面改性上具有广阔的应用前景。
致谢
这项工作由四川省科技厅应用基础项目(2017JY0297)支持。
NOTES
*通讯作者。