1. 引言
龙血素B (图1),化学名为4’-羟基-2,4,6-三甲氧基二氢查尔酮,是传统名贵中药材龙血竭的主要成分之一,是龙血竭质量标准中的重要指标 [1] 。龙血素B具有很好的市场前景,对其及其衍生物的合成方法和生物活性的研究是必要的。
龙血素B由于其丰富的药用价值,被广泛应用到各种药物中。龙血素B具有活血散瘀,镇痛止血,敛疮生肌的功效。适用于跌打损伤,淤血作痛,外伤出血等症状。龙血素B的制剂、药膏有黄金甲跌生肌膏,竭红跌打贴膏剂,龙血竭滴丸,龙血通胶囊,生肌化瘀膏,芳竭丸,龙血竭胶囊等。龙血素B的药效包括:1) 改善机体微循环,调节内分泌。活血化瘀,增加体内凝血因子,对出血患者有显著止血作用,在治疗中医血症方面具有双向调节作用,促进新陈代谢,加速淋巴回流;2) 调经理血,软坚散结,活血行气;3) 改善机体循环,调节机体新陈代谢、改善机体免疫功能等作用。临床上用于治疗外伤出血,心绞痛,心肌梗塞等 [2] 。
龙血素B在自然界中没有独立存在,它是传统名贵药材龙血竭的主要成分之一。龙血竭是龙血树属植物,主要分布在我国云南及东南亚国家。树皮被割破,便会流出殷红的汁液,像人体的鲜血,主要成份为龙血素B,微有清香,味淡微涩 [3] 。龙血竭应用历史悠久,市场需求量大,但由于龙血竭的产量低,来源单一,目前主要依靠植物体内代谢生成,以致于资源稀缺。随着需求量的增加,龙血树受到了严重的破坏,龙血素B的生成也越来越少。因此提高龙血素B的生成效率,寻找替代品的研究正逐渐成为该领域的研究热点。二氢查尔酮类化合物在龙血竭中含量最为丰富,龙血素B正属于其中一种,因此对龙血素B及其衍生物的合成和生物活性进行综述,可以对后续研究提供有用的参考价值。
2. 合成方法
2.1. 龙血素B的合成
目前国内对其化学合成研究已有相关报道,在2008年上海大学的雍克岚 [4] 在中国专利中公开了它的合成方法。其合成方法是(图2):先对羟基苯乙酮的苄醚化反应,然后再用相应的取代苯甲醛在强碱的催化下进行羟醛缩合反应制备得到相应的查尔酮,最后用钯碳作为催化剂在常压加氢气下还原得到龙血素B。
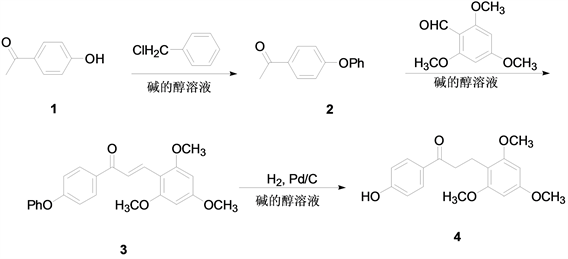
Figure 2. Synthetic route of dragon’s blood B
图2. 龙血素B的合成路线
2.2. 龙血素B的衍生物的合成
2.2.1. 查尔酮的合成方法
查尔酮类化合物是一些类黄酮植保素等的前体,也是合成龙血素B及其衍生物重要的中间体,自然分布广泛、药理活性多样。利用不同的催化体系,可以实现羟醛缩合构筑查耳酮类化合物是目前常用的合成方法,该方法操作简便、反应条件温和。
1) 金属催化法
2016 年,Mohammad Reza Sazegar 等研究人员 [5] 使用HAlMSN (Si/Al = 18.9)为催化剂,以苯乙酮衍生物和苯甲醛衍生物为原料,通过羟醛缩合反应合成了一系列查尔酮衍生物,即龙血素B衍生物的中间体(图3)。

Figure 3. Synthesis of chalcone derivatives using HAlMSN (Si/Al = 18.9) as catalyst
图3. HAlMSN (Si/Al = 18.9)为催化剂合成查尔酮衍生物
2) 二氧化硅与哌啶的偶合物催化法
2014年Kulsum Khan等研究人员 [6] 发表的使用二氧化硅与哌啶的偶合物对该反应进行催化合成查尔酮衍生物(图4)。

Figure 4. Catalytic synthesis of chalcone derivatives by the coupling of silica and piperidine
图4. 二氧化硅与哌啶的偶合物进行催化合成查尔酮衍生物
3) 碱催化法
2018年,本课题组 [7] 以NaOH为催化剂,乙醇:水 = 4:1为溶剂,常温下搅拌,即可实现Aldol缩合反应生成查尔酮的反应,在此基础上再通过FeCl3催化与TMSCl和TESH两个添加剂发生还原反应,可以得到二氢查尔酮衍生物及其二聚物(图5)。
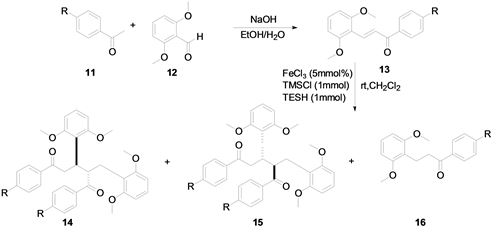
Figure 5. Synthesis of chalcone derivatives with NaOH as catalyst
图5. NaOH为催化剂合成查尔酮衍生物
陆文兴 [8] 等在使用KF-Al2O3作为催化剂的条件下,合成了多种查尔酮类化合物及其衍生物。该方法操作简便反应迅速简捷,后处理简单易行,最主要的特点是催化剂可以回收反复使用,大大降低了生产的成本,但反应用时较长收率也较低,合成方法如下(图6):
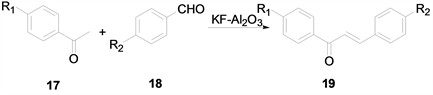
Figure 6. Synthesis of chalcones and their derivatives with KF-Al2O3 as catalyst
图6. KF-Al2O3为催化剂合成查尔酮类化合物及其衍生物
4) 聚乙二醇相转移催化法
在经典的强碱作为催化剂,醇作为溶剂的条件下进行羟醛缩合反应制备查尔酮,这类型的反应在得到产物的过程中常常也会产生一些副产物,从而加大了后处理及分离提纯的难度,同时也降低了反应的产率。2006年蒋新宇 [9] 等研究采用聚乙二醇作为反应的相转移催化剂,原料为苯乙酮和苯甲醛进行羟醛缩合反应制备查尔酮。该方法条件温和,对反应器腐蚀性小,对设备要求不高,产率可达80%之多。合成方法如下(图7):
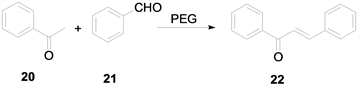
Figure 7. Polyethylene glycol phase transfer catalysis
图7. 聚乙二醇相转移催化法
5) 酸催化法
关丽萍 [10] 用间,乙二苯二酚为原料先合成2,4-二羟基苯乙酮,再用2,4-二羟基苯乙酮与取代苯甲醛为原料醇为溶剂,催化剂为硼酸,在110℃~120℃下反应6 h,制备查尔酮类衍生物,然后用柱层析分离得到查尔酮。为多酚羟基查尔酮类化合物的合成提供了较好的参考方法。合成方法如下(图8):

Figure 8. Catalytic preparation of chalcone derivatives with boric acid
图8. 硼酸催化法制查尔酮衍生物
T. Narender and K. Peddy [11] 用BF3-Et2O做催化剂,二氧六环做溶剂的条件下反应90 min,合成了一系列的查尔酮类化合物,其产率可以高达90%。该方法操作简单,反应耗时少,但其后处理要用到柱层析比较麻烦。其合成方法如下(图9):
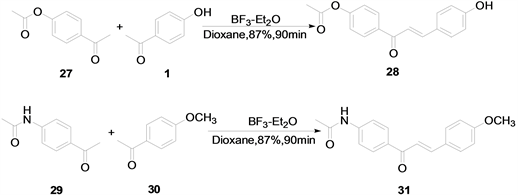
Figure 9. Chalcones synthesized by BF3-Et2O catalytic method
图9. BF3-Et2O催化法合成的查尔酮类化合物
6) KF-Al2O3催化微波合成法
微波辐射可以在较短时间内释放很高的能量使化合物的化学键迅速断裂从而发生化学反应。2007年曾波涛等 [12] 采用微波辐射,催化剂为KF-Al2O3,在无溶剂条件下进行查尔酮衍生物的合成工作,得到了8个查尔酮衍生物,产率高达95%。该方法不需要机械搅拌,反应迅速,并且提高了反应产率,但不足之处在于反应时只能微量进行,合成产物需要的量较大时则需多次重复进行。合成方法如下(图10):
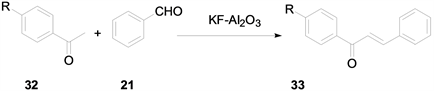
Figure 10. Synthesis of chalcone derivatives with KF-Al2O3 as catalyst under microwave irradiation
图10. 微波辐射,催化剂为KF-Al2O3合成查尔酮衍生物
7) 水滑石催化法
吴浩,叶红齐 [13] 等用离子液1,3-二丁基-2-甲基四氟硼酸咪唑盐作为反应溶剂,水滑石做催化剂进行查尔酮的绿色合成,产率高达98.5%。该法为绿色无污染合成法,并且反应时间短、操作简便、产率高,反应溶液1,3-二丁基-2-甲基四氟硼酸咪唑盐和催化剂水滑石均可循环使用,此法是一种新型的环境友好合成查尔酮的好方法。但不足之处在于离子液1,3-二丁基-2-甲基四氟硼酸咪唑盐价格较贵,生产成本高。合成方法如下(图11):

Figure 11. Green synthesis of chalcone using hydrotalcite as catalys
图11. 水滑石做催化剂进行查尔酮的绿色合成
2.2.2. 二氢查尔酮的制备
二氢查耳酮是将查耳酮的碳碳双键进行还原得到的产物,龙血素B及其衍生物是二氢查耳酮中的一类,可以通过钯碳,锌粉和氯化铵,黄酮葡萄糖的转化加氢还原等方法来制备。
1) 钯碳催化还原法
2011年赵晓龙等 [14] 还原查尔酮的α,β-不饱和酮的双键从而得到二氢查尔酮,其方法是:用10%的钯碳作为催化剂,乙酸乙酯为溶剂,氢气作为氢给予体。该方法在常温下进行,选择性高。但是以氢气作为氢源,对设备的要求较高。合成方法如下(图12):
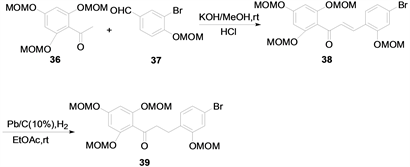
Figure 12. Catalytic hydroreduction of chalcone
图12. 催化加氢还原查尔酮法
2) 锌粉和氯化铵催化还原法
2005年,张永霞 [15] 报道了用锌粉和氯化铵在乙醇和水体系下选择还原查尔酮的碳碳双键,产率在85%~95%,合成方法如下(图13):
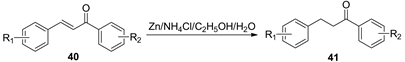
Figure 13. Selective reduction of chalcone by zinc powder and ammonium chloride in ethanol and water systems
图13. 锌粉和氯化铵在乙醇和水体系下选择还原查尔酮
3) 碱性催化加氢还原法
二氢查尔酮类化合物还可以通过黄酮葡萄糖的转化来制备 [16] ,在该方法中,分两步来进行第一步,在高浓度碱条件下先将黄烷酮葡萄糖转化为查尔酮类化合物;第二步,在氢气的条件下,将查尔酮的碳碳双键还原即可制得二氢查尔酮类衍生物。其反应如下(图14):

Figure 14. Preparation of dihydrochalcones by conversion hydrogenation of flavonoid glucose
图14. 通过黄酮葡萄糖的转化加氢来制备二氢查尔酮类化合物
3. 龙血素B的活性研究
3.1. 镇痛活性
龙血竭中所含化合物龙血素B具有一定的镇痛作用。刘向明课题组针对龙血竭的镇痛活性进行了较为深入的研究。其课题组成员从不同角度对龙血竭的镇痛活性进行测试,如应用膜片钳技术在急性分离的大鼠神经节细胞上对河豚毒素敏感型电压门控性钠通道电流的影响,证实龙血竭中化学成分龙血素B可能是龙血竭的镇痛作用的活性成分之一 [17] [18] [19] [20] [21] 。且通过实验研究得出剑叶龙血素B (6,4’-二羟基-7-甲氧基高异黄烷)以及龙血素B能够抑制辣椒素诱发的大鼠背根神经节细胞辣椒素受体通道电流的产生 [22] [23] 。刘向明等人将龙血竭中特有化合物联合进行镇痛活性测试,其通过将剑叶龙血素A与剑叶龙血素B、剑叶龙血素A与龙血素B、剑叶龙血素B与龙血素B在联合调制电刺激坐骨神经诱发脊髓背角广动力范围神经元放电频率时具有拮抗作用,而剑叶龙血素A、剑叶龙血素B和龙血素B在联合调制电刺激坐骨神经诱发的脊髓背角广动力范围神经元的放电频率时具有协同作用。同时发现,龙血素B的镇痛效果明显强于其他两者 [24] 。
3.2. 活血化瘀活性
龙血竭在活血化瘀方面也有显著的作用。2016年闫冬等研究人员发现龙血素B可以消除血栓,其课题组通过利用活性引导分离策略从龙血竭中发现存在纤溶酶原激活物抑制剂(Plasiminogen activator inhibitor-1, PAI-1)天然小分子抑制剂龙血素B,PAI-1的异常表达会引起体内凝血和抗凝血系统的紊乱,从而导致血栓类疾病的发生。通过体内,外实验发现了龙血素B对PAI-1的抑制活性,对肝纤维化的治疗作用以及对血栓的保护作用 [25] 。此外,该课题组还利用底物荧光发色法确定龙血素B对PAI-1具有的抑制作用 [26] 。邓家刚对龙血素B活性探索,发现其对大鼠血栓的形成有明显抑制作用;对急性血瘀模型大鼠有明显的活血作用;能明显延长小鼠凝血时间,且具有良好镇痛,作用表明龙血素B具有较好的抗血栓、抗血瘀、抗凝血等活血化瘀的药理活性 [27] 。2008年,张天宝等人从广西血竭的氯仿提取部位中分离得到龙血素B,并通过药理实验,发现其对体外ADP诱导的血小板聚集有一定的抑制作用 [28] 。除上述综述外,还发现龙血素B在抗凝血及改善血液循环方面也有显著的作用。程敏团队等人通过对不同产地龙血竭在血液和心血管方面的药效学比较及作用机制初探,得出龙血素A、B等对NE、KCl和PE诱导的大鼠胸主动环收缩作用具有显著的抑制作用 [29] 。
3.3. 敛疮生肌活性
龙血竭对伤口的愈合具有特殊作用,前辈们也对其进行了深入的研究,如何婷等在前人基础上研究龙血素B抑制疤痕形成机制时发现,其可通过ERK/JNK通路抑制疤痕形成 [30] 。白晓智等人研究龙血素B的活性时发现,其可抑制成纤维细胞增殖,同时通过TGF-β/Smad途径抑制细胞外基质沉积在增生性疤痕上 [31] 。
3.4. 抑制雌激素效应活性
1997年,Kazuolchikawa从树脂中分离的4’-羟基-2,4,6-三甲氧基二氢查尔酮即龙血素B化合物具有与3-氢-雌二醇竞争结合雌激素,起到抑制雌激素效应的作用 [32] 。
3.5. 抗炎,清除自由基,抗氧化活性
由于氧化应激是肝纤维化时肝细胞损伤的一个重要机制。彭伟等研究人员通过硫代硫酸胺诱导大鼠肝纤维化,通过灌胃实验观察到龙血素B可能是通过抗炎,清除自由基,抗氧化等作用来保护肝细胞,延缓肝纤维化进程 [33] 。李玉莲等研究人员通过利用龙血素B对大鼠肝星状细胞(HSC)进行处理,发现龙血素B可以抑制HSC活性及增值,并抑制细胞外基质(ECM)的合成、促进其降解,对肝纤维化有一定的防治作用 [34] 。
4. 总结及展望
基于龙血素B具有多种生物活性,同时也是龙血竭的质量控制的标准物质,具有很好的市场前景,因此对龙血素B衍生物的合成和生物活性的研究具有重要的意义。通过利用不同催化剂对芳香醛和芳香酮进行羟醛缩合反应,再经过还原得到二氢查尔酮是目前合成龙血素B衍生物的重要手段,同时对龙血素B的活性进行整理也对相关药物研发具有重要的参考价值。希望通过本文论述的合成方法和生物活性对后续龙血素B的研究提供科学的参考意义。
基金项目
国家自然科学基金(Nos. 21662046,21202142);云南省教育厅科学研究基金项目(2016ZZX129) ;云南民族大学化学与环境学院特区建设项目。
NOTES
*通讯作者。