摘要: 目的:观察恩度不同给药时相联合放疗对胃癌裸鼠移植瘤的抑制作用,并对其可能机制进行探讨。方法:建立MFC小鼠胃癌移植瘤模型,随机分成5组:对照组、RT1 + NS组、RT1 + ES组、RT7 + ES组、RT14 + ES组,分别于放疗期间采用生理盐水及恩度干预。于治疗的第8、15天各处死5只小鼠,取出肿瘤,观察并测量各组肿瘤体积变化,绘制肿瘤生长曲线,计算抑瘤率,采用免疫组化方法检测各组肿瘤组织中VEGF、HIF-1α及PCNA的表达情况。结果:RT1 + ES组及RT7 + ES组较其他组肿瘤生长慢、抑瘤率高,差异有统计学意义(P < 0.05);实验第8天和第15天,VEGF与PCNA蛋白的表达在恩度联合放疗组均有不同程度下降,尤以RT1 + ES组及RT7 + ES组PCNA表达下降最明显,差异有统计学意义(P < 0.05)。结论:恩度联合放疗可能通过调节VEGF、HIF-1α及PCNA的表达等机制,对胃癌裸小鼠发挥肿瘤抑制作用。在恩度第7天行放疗或第1天同步放疗,对胃癌裸鼠移植瘤抑制作用最强。
Abstract:
Objective: The aim of this study was to observe the inhibitory effect of endostar given at different times combined with radiotherapy on gastric cancer xenografts in nude mice, and to explore its possible mechanism. Methods: MFC mouse gastric cancer xenograft models were established and randomly divided into 5 groups: control group, RT1 + NS group, RT1 + ES group, RT7 + ES group, RT14 + ES group. Physiological saline and Endo intervention during radiotherapy, on the 8th and 15th day of treatment, 5 mice were sacrificed, tumors were taken out, tumor volume changes were observed and measured, tumor growth curves were drawn, tumor inhibition rate was calculated. VEGF, HIF-1α and PCNA were observed by Immunohistochemistry. Results: The tumor growth of RT1 + ES group and RT7 + ES group was slower and the tumor inhibition rate was higher (P < 0.05). On the 8th and 15th day of experiment, VEGF and the expression of PCNA protein decreased in different degrees in the combination of radiotherapy and Endostar, especially in the RT1 + ES group and the RT7 + ES group. The difference was statistically significant (P < 0.05). Conclusion: During the micro-vascular normalization window induced by Endostar, or Endostar and radiotherapy given at the same time, it is possible to exert tumor suppressive effects on nude mice with gastric cancer by regulating the mechanisms of VEGF, HIF-1α and PCNA expression.
1. 引言
胃癌是最常见的恶性肿瘤之一,在世界范围内居恶性肿瘤发病率的第四位,死亡率的第二位。我国胃癌发病率及死亡率均比较高,每年新发病例463,000例,占世界总发病例数的48% [1]。由于胃癌早期诊断率低,30%以上患者就诊时就已失去手术机会,手术、放化疗联合的综合治疗仍是胃癌的标准治疗方案。尽管手术方式、化疗药物及放疗精确度不断发展,但胃癌的5年生存率仍然只有30%~36% [2] [3]。近年来分子靶向治疗为我们提供了新的方向,重组人血管内皮抑素(恩度)作为我国自主研发的一种广谱抗血管生成药物,上市以来同放化疗联合提高了恶性肿瘤患者的生存率。但是恩度同放疗联合的时机问题目前研究较少,最佳的联合方式目前尚无定论。本文研究恩度不同给药时相联合放疗对胃癌移植瘤的疗效及其可能机制。现将结果报告如下。
2. 材料和方法
2.1. 材料
2.1.1. 实验细胞及动物
MFC小鼠胃癌细胞,购自青岛大学中心实验室;6~8周龄雄性昆明小鼠,体重:18~25 g,购自即墨医学动物实中心。在青岛大学动物实验中心饲养,SPF级饲养条件,室温:22℃~26℃,相对湿度为40%~60%,分笼饲养,每笼5只。
2.1.2. 实验材料
细胞培养基DMEM高糖培养基、澳洲源胎牛血清、青霉素/链霉素双抗、胰酶(Hyclone公司);二甲亚砜(美国Sigma公司);恩度(中国山东先声麦得津生物制药有限公司);HIF-1α兔抗小鼠多抗、VEGF兔抗小鼠多抗(北京博奥森生物技术有限公司)。
2.2. 方法
2.2.1. MFC小鼠胃癌细胞培养
将MFC悬浮细胞置于37˚,5% CO2恒温培养箱中培养,采用贴壁细胞培养法培养,细胞覆盖培养瓶80%~90%时进行细胞传代,2~3d传代一次。当细胞呈指数分裂时,用胰酶消化,PBS洗两次,制成细胞密度为1 × 107个/ml的单细胞悬液。
2.2.2. 小鼠皮下成瘤
用1 ml注射器于小鼠右腋下皮肤进针约5 mm后推入细胞悬液0.2 ml,约7天左右,小鼠右腋皮下出现米粒样小结节,质韧。用游标卡尺测量肿瘤长短径,约2周左右,肿瘤体积生长为大约200~300 mm3,质硬。小鼠成瘤率100%。
2.2.3. 实验分组及处理
制作50只荷瘤小鼠,当移植瘤面积约为200~300 mm3时,将小鼠随机分成5组。对照组:尾静脉注射NS 0.2 ml/d,连续14天;放疗 + 生理盐水(RT1 + NS)组:尾静脉注射NS 0.2 ml/d,连续14天,于第1天给予6 MV的X线600cGy局部照射1次;放疗 + 恩度(RT1 + ES)组:尾静脉注射恩度20 mg·kg−1·d−1,连续14天,于第1天给予6 MV的X线600cGy局部照射1次;放疗 + 恩度(RT7 + ES)组:尾静脉注射恩度20 mg·kg−1·d−1,连续14天,于第7天给予6 MV的X线600cGy局部照射1次;放疗 + 恩度(RT14 + ES)组:尾静脉注射恩度20 mg·kg−1·d−1,连续14天,于第14天给予6 MV的X线600cGy局部照射1次。SSD = 100 cm,深度(d) = 4 cm。分别在实验的第8天及第15天各处死5只小鼠。对50只小鼠完整剥离肿瘤并称取瘤重,将肿瘤标本立即放入4%甲醛溶液中固定。所有小鼠的处理均已获得青岛大学附属医院动物实验伦理委员会的批准。
2.3. 监测指标
1) 肿瘤生长情况及抑瘤率:每2日用游标卡尺测量小鼠皮下移植瘤的最长径(a)及最短径(b),按照公式:肿瘤体积V = 0.523 ab2 [4],计算小鼠皮下移植瘤的体积,取其平均值,绘制肿瘤生长曲线。按照公式:抑瘤率 = (对照组小鼠平均瘤重 − 实验组小鼠平均瘤重)/对照组小鼠平均瘤重,计算抑瘤率。
2) 肿瘤标本用4%甲醛溶液中固定后,进行脱水、透明、浸蜡、包埋及切片。用免疫组织化学SABC法检测小鼠肿瘤组织中VEGF、HIF-1α、PCNA表达情况。免疫组化结果判读:VEGF主要表达于肿瘤细胞胞浆,少部分表达于细胞膜,阳性表达呈棕黄色颗粒状;HIF-1α主要在细胞浆表达,少部分表达于细胞核,阳性表达为棕黄至棕褐色的颗粒;PCNA反应肿瘤细胞的增殖状态。按照公式:PCNA增殖指数(%) = PCNA阳性细胞数计数/细胞总数 × 100% [5],计算PCNA增殖指数。
2.4. 统计学方法
数据处理采用SPSS 19.0软件进行。数据表示采用均数 ± 标准差(x ± s)形式。进行统计分析前均进行正态性及方差齐性检验,组间资料比较用t检验,多组间比较采用单因素方差分析,不符合正态分布及方差齐性的资料,采用秩和检验。P < 0.05为差异有统计学意义。
3. 结果
3.1. 各组小鼠皮下移植瘤生长情况及抑瘤率
各组肿瘤均进行性增大,各实验处理组增长速度均小于对照组,差异有统计学意义(P < 0.05)。其中,恩度放疗同时组及恩度第7天行放疗组生长速度较其他两组缓慢,又以恩度第7天行放疗组生长速度最缓慢。实验结束时各组肿瘤体积均小于对照组(图1)。对照组与各实验处理组瘤重差异均有统计学意义(P < 0.05)。恩度第7天行放疗组抑瘤率最高,恩度放疗同时进行组次之,两组之间差异无明显统计学意义(P = 0.074),与其他组相比差异有统计学意义(P < 0.01)。恩度第14天行放疗组抑瘤率最低(表1)。

Table 1. Tumor weight and tumor suppression rate of mice in different treatment groups
表1. 不同处理组小鼠瘤重及抑瘤率
3.2. 各组VEGF、HIF-1α、PCNA表达情况
3.2.1. VEGF结果
免疫组化显示VEGF表达主要分布于细胞质,为棕黄色颗粒。恩度联合放疗各组VEGF表达均较对照组低,RT14 + ES组表达最低。见图2。
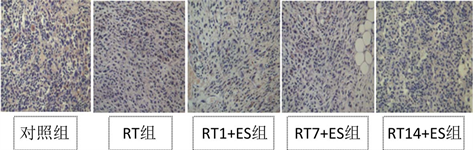
Figure 2. Expression of VEGF in each group (× 400)
图2. 各组VEGF表达情况(×400)
3.2.2. HIF-1α结果
在实验的第8天,恩度各组乏氧有不同程度改善,与对照组相比,单放疗组乏氧情况较对照组较重,差异均有统计学意义。实验结束时,各组乏氧情况较前均加重,RT7 + ES组乏氧较对照组有所改善(P < 0.000),余各组与对照组相比均无明显差异。见表2。
3.2.3. PCNA结果
PCNA反应肿瘤细胞的增殖状态。实验的第8天,各处理组PCNA表达较对照组明显降低,其中,放疗与恩度联合组最低,差异有统计学意义(P < 0.000)。治疗结束时,各组的PCNA表达与对照组相比仍旧明显降低,其中,恩度窗口期放疗及同步组降低最明显,差异有统计学意义(P < 0.000)。各处理组PCNA增殖指数见表2。

Table 2. Expression of VEGF, HIF-1α, and PCNA in different treatment groups
表2. 不同处理组VEGF、HIF-1α、PCNA的表达情况
4. 讨论
抗血管生成治疗主要通过阻断肿瘤中的血液供应,使肿瘤组织达到乏氧状态 [6]。目前的研究表明 [7] [8] [9] [10],抗血管生成治疗联合放射治疗具有协同作用。其机制可能为抗血管生成药物抑制内皮细胞的增殖,从而降低耗氧量,改善肿瘤微环境,提高放射治疗的敏感性 [11]。
恩度(重组人血管内皮抑素)由我国科学家自主研发而成,通过在天然的血管生成抑素N端添加9个氨基酸序列,使得半衰期延长,从而提高生物活性和药物稳定性。恩度通过抑制内皮细胞迁移,而抑制肿瘤血管的生成,阻断肿瘤的营养供给,从而抑制肿瘤增殖或转移。恩度改善紊乱的血管并使之正常化的时间,称为“肿瘤血管正常化时间窗”。在这期间恩度可通过改善局部肿瘤血液循环,降低肿瘤间质压力,改善局部氧分压 [11] [12]。因此,在“血管正常化时间窗”内恩度可增强对肿瘤的细胞毒作用。
VEGF是促进肿瘤血管生成的最重要因子,多种肿瘤细胞均可表达,并且参与肿瘤生长的整个过程,它可以诱导内皮细胞迁移、增殖和分化,调节血管的生成过程,其分泌和表达与乏氧密切相关,VEGF阳性表达及血清VEGF水平与患者的生存时间有相关性 [13],而HIF-1α主要反应细胞的乏氧情况。增殖细胞核抗原(prolife rating cell nuclear antigen, PCNA)是伴随细胞增殖的一种核蛋白,是DNA多聚酶δ的辅助因子,在DNA复制中起重要作用,是真核细胞DNA合成所必需的辅酶。它的表达与细胞周期相关,在细胞周期S期广泛表达,在细胞核内合成,并只存在于正常增殖细胞及肿瘤细胞的细胞核内。PCNA与细胞增殖状态密切相关,可作为反映肿瘤细胞增殖程度的指标。研究显示,胃癌组织中PCNA表达率增高,并且与胃癌组织的分化、淋巴结转移、浸润深度及分期有关 [14]。
本研究结果显示,恩度第7天行放疗组,在实验的第8天VEGF、HIF-1α表达最低,表明恩度血管正常化窗口期约在用药后第7天,而且恩度放疗联合具有协同作用。同时在恩度窗口期行放疗可以最大程度的使肿瘤微血管密度减低,周细胞覆盖率增加,基底膜完整,乏氧得到改善,此时行放疗可增加疗效,表现为肿瘤生长速度减慢,抑瘤率增加,PCNA降低。恩度放疗同时进行组与恩度窗口期放疗组取得了相似的疗效,原因可能为恩度降低放疗诱导产生的VEGF等促血管生成因子,同时使细胞处于G2/M期,从而提高放疗疗效。
5. 结论
综上所述,我们得出恩度窗口期放疗与恩度放疗同时进行可明显抑制肿瘤细胞生长,可能与下调VEGF、PCNA等的表达有关。本实验研究结果将为今后的抗血管生成药物不同用药时相联合放疗在胃癌中的应用提供实验依据,有助于进一步完善肿瘤治疗的临床解决方案。
利益冲突
所有作者均声明不存在利益冲突。