1. 前言
叶酸(folic acid,FA,蝶酰谷氨酸),别名维生素B9,水溶性B族维生素,为机体细胞生长和繁殖必须物质,在二氢叶酸还原酶和维生素B12的作用下,形成四氢叶酸(THFA),THFA与一碳单位(CH3、CH2、CH、CHO等)结合成四氢叶酸类辅酶,传递一碳单位,参与嘌呤和胸腺嘧啶的合成,进而合成DNA、RNA,参与氨基酸之间的相互转化、血红蛋白及重要的甲基化合物合成等 [1]。叶酸在人体内无法自动合成,叶酸补充剂或者是食补是获取叶酸的两个途径。叶酸在小白菜、扁豆、蘑菇、橘子、石榴、猕猴桃、胡桃、动物肝脏、黄豆等食物中含量较多。叶酸性质不稳定(微溶于水,对热、光、酸性溶液敏感),容易失去活性,所以人体要想单纯从食物中获得足够的叶酸是很难的,故还需从叶酸补充剂中获取 [2]。日常饮食中叶酸含量偏低,制作方式不合理,自身吸收不良等原因都可导致孕妇体内叶酸缺少。此外,胎儿生长发育,胎盘组织与子宫增长使母体叶酸通过胎盘转运给胎儿,致使母体自身叶酸需要量增加,高于非孕妇,从而使孕妇叶酸缺乏的风险增加 [3]。导致胎儿畸形的原因之一是母体叶酸缺乏 [4],因此孕妇补充叶酸是极其重要的。
天然叶酸在肝、肾、新鲜水果及绿色蔬菜中含量较多。合成的叶酸现多以四甲氧基丙醇和对氨基苯甲酰-L-谷氨酸为主要原料与三氨基嘧啶硫酸盐反应生成叶酸,合成叶酸性质稳定,容易吸收且人体利用度高 [5]。DNA的合成以及DNA的甲基化过程跟叶酸的代谢有关,因此当人体内缺乏叶酸时,会影响相关DNA合成,进而导致胚胎发育异常 [6]。叶酸参与体内多种重要代谢,合成形式具有很强的稳定性和活性。目前已有许多文献证明了叶酸缺乏会导致胎儿神经管缺陷(NTDs),补充叶酸能预防NTDs发生风险 [7]。《孕期妇女膳食指南》中建议:孕妇在整个妊娠期除每天吃绿叶蔬菜以外应口服叶酸补充剂400 μg/d [8]。孕早期补充叶酸对于孕妇来说是关键时期,而要在此时期如何合理的进行补充叶酸也是众多学者研究和探讨的方向之一。
亚甲基四氢叶酸还原酶MTHFR C677T、A1298C和蛋氨酸合成还原酶MTRR A66G三个位点是叶酸在体内代谢过程中的关键酶 [9]。MTHFR C677T位点(C > T)突变使得丙氨酸转变为缬氨酸,导致酶的活性发生改变,其中CT酶活性降至65%,TT降至30%;A1298C是MTHFR基因编码的另一个位点,该突变将谷氨酸转变为丙氨酸,杂合子(AC)的酶活性将降至83%,纯合子(CC)将降至61% [10]。MTRR是一种黄素蛋白相关的酶,能够维持甲硫氨酸合成酶的活性状态,对维持体内甲硫氨酸循环具有重要的调节作用,该酶编码基因的A66G多态性会导致异亮氨酸替代蛋氨酸,酶的活性大大降低,导致甲硫氨酸合成酶活性降低,研究表明MTRR的G等位基因与高同型半胱氨酸血症有关 [11]。目前关于基因组学的研究仍旧很热门,其中关于叶酸代谢基因型中研究最多也是最有价值的是MTHFR C677T。不同基因型的孕妇由于个体差异对叶酸的需求量不同,为此提出应对孕妇进行叶酸利用能力的基因检测,筛选叶酸利用能力的较差人群,根据每个人的遗传特点补充不同剂量的叶酸。
叶酸代谢与基因的多态性有关,不同的人所检测出的基因型不同,从而导致叶酸在人体内的血药浓度不同,服用后会出现预期疗效降低或无效的情况,此次研究通过检测妊娠期妇女叶酸代谢相关基因型,测评叶酸代谢能力,进而为孕期妇女个体化补充叶酸提供合理依据。
2. 资料与方法
2.1. 研究对象
本研究经相关伦理批准同意下进行。选取自2020年5月~2020年11月期间在云南省第三人民医院进行叶酸代谢基因检测的妊娠妇女共244例,孕周6~13周左右,平均年龄27.8 ± 3.6岁。纳入标准:妊娠女性,孕周6~13周,年龄18~35周岁,服用叶酸。排除标准:孕周小于6周或大于13周,年龄小于18岁或大于35周岁,未服用叶酸。
2.2. 基础数据
录入调查对象基本信息,内容包括:年龄、孕周等。
2.3. 研究方法
2.3.1. 检测样本
本实验检测样本为:2~3 ml静脉全血,用一次性EDTA抗凝紫帽真空管采集,采集后保存于4℃,保存时间小于等于24 h。
2.3.2. 检验方法学
数字荧光分子杂交(DFMH, Digital Fluorescence Molecule Hybridization)。
2.3.3. 检测试剂和仪器
试剂:核酸纯化试剂(北京华夏基因)、测序反应通用试剂盒(北京华夏基因)、1 × NH4Cl。
仪器:数字荧光检测仪(天隆基因TL998A)。
2.3.4. 检测步骤
加入1 mL 1 × NH4Cl预处理液对待测标本进行预处理。反复离心富集白细胞后,加入30 ul核酸纯化试剂,纯化核酸。取2 ul纯化后核酸加入测序反应通用试剂,上机检测。
2.3.5. 统计学方法
采用SPSS 17.0统计软件,对所得数据进行统计学处理,计量资料以(x ± s)表示,采用t检验;计数资料比较采用χ2检验,P < 0.05为差异有统计学意义。
2.4. MTHFR C677T基因检测推荐剂量
根据加拿大相关指南 [12] 和中国围受孕期增补叶酸预防神经管缺陷指南(2017),再结合我国上市叶酸药品的规格,推荐MTHFR C677T基因双突变的高危人群,妊娠前3个月开始补充叶酸1.0 mg∙d−1,产后至哺乳结束补充叶酸0.8 mg;MTHFR C677T基因位点单突变的中危人群,妊娠前3个月开始补充叶酸0.8 mg,产后至哺乳结束补充叶酸0.4 mg;MTHFR C677T基因未突变且低危人群,补充叶酸0.4 mg至哺乳期结束;若有出生缺陷史的在此基础上酌情增加叶酸剂量和补充维生素B12,同时应维持富含叶酸的健康饮食,并达到标准叶酸血药水平。
3. 结果
3.1. 叶酸基因检测结果统计情况
3.1.1. CC、CT、TT基因型荧光曲线图分析
(1) CC型曲线图,见图1:ch1通道曲线起峰的循环数大概在28左右,荧光值达8100左右,且循环数达到40左右时开始呈“S”型稳定。ch2通道曲线起峰循环数大概在30左右,荧光值达4000,且循环数达到50时开始呈现稳定趋势。如图所示,CC型ch1通道曲线高于ch2通道曲线且无相交现象。
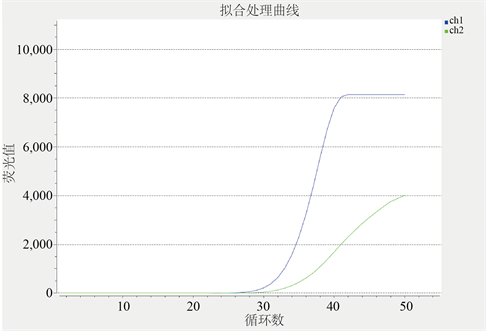
Figure 1. Fluorescence curve of CC type
图1. CC型荧光曲线图
(2) CT型曲线图,见图2:ch1通道曲线与ch2通道曲线起峰的循环数都在30左右,ch2通道曲线荧光值达8300左右,且循环数达到44左右时开始呈“S”型稳定。ch2通道曲线荧光值达6300,且循环数达到50时开始呈现稳定趋势。如图所示,CT型ch1通道曲线高于ch2通道曲线且有相交现象。
(3) TT型曲线图,见图3:ch1通道曲线与ch2通道曲线起峰的循环数都在30左右,ch1通道曲线荧光值达5000左右,且循环数达到50左右时开始稳定趋势。ch2通道曲线荧光值达5500,且循环数也是达到50时开始呈现稳定趋势。如图所示,TT型ch1通道曲线低于ch2通道曲线且无相交现象。
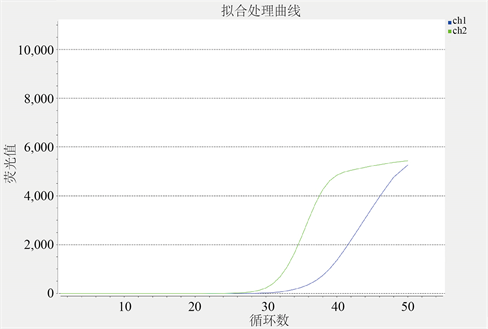
Figure 3. Fluorescence curve of TT type
图3. TT型荧光曲线图
3.1.2. MTHFR C677T基因型频率分布
在所纳入的244例妊娠早期妇女中,MTHFR C677T位点有109例CC型(44.7%);109例CT型(44.7%);26例TT型(10.7%)。MTHFR C677T基因突变型有135例(55.3%)。进行Hardy-Weinberg遗传平衡检验,P > 0.05,说明群体基因遗传平衡,证明样本具有本区域群体代表性,见表1。
3.1.3. 不同基因型妊娠早期妇女叶酸补充合理性情况
通过MTHFR C67R7T基因检测,可以知道被检者叶酸利用能力,从而根据风险高低建议更准确的补充剂量。根据MTHFR C677T基因检测基因型分为CC组、CT组、TT组,根据基因检测后的情况来推荐叶酸剂量,分析不同基因型妊娠早期妇女叶酸补充的合理性。244例妊娠早期妇女中,合理补充叶酸的有109例,所占比例为44.7%;CC组合理补充所占比例最高(62.4%);TT组不合理补充所占比例最高(96.2%),差异有统计学意义(P < 0.05),见表2。

Table 1. Comparison of MTHFR C677T genotype distribution [n (%)]
表1. MTHFR C677T基因型分布比较[n (%)]

Table 2. Comparison of rationality of folic acid supplementation in early pregnancy women with different MTHFR C667T genotypes [n (%)]
表2. MTHFR C667T不同基因型妊娠早期妇女叶酸补充合理性比较[n (%)]
3.2. 不同年龄段妊娠妇女MTHFR C677T基因分布情况
将收集到的数据分为3个年龄组,不同年龄组的基因型、等位基因分别进行卡方分析,结果P > 0.05。说明该地区不同年龄阶段妊娠妇女MTHFR C677T基因型和等位基因无明显差异,见表3。

Table 3. Comparison of MTHFR C677T genotype distribution and age (%)
表3. MTHFR C677T基因型分布与年龄的比较(%)
4. 讨论
叶酸缺乏在妇女中最为常见,尤其是孕妇由于在怀孕期间身体各项机能会发生变化,故对叶酸的需求量也比常人多。妊娠期叶酸缺乏会引起胎儿神经管缺陷(NTDs),这也是被众多学者所证实了的,同时也有研究指出妊娠期妇女补充叶酸可以预防NTDs的发生 [13]。NTDs是一种常见的新生儿先天畸形,一般发生在胚胎发育早期神经管未能正常闭合所致,多见无脑儿、脊柱裂等。有研究表明我国北方地区NTDs的发生率在世界上属于高发区 [14],NTDs严重影响了我国出生人口生命和健康问题,为此我们必须引起一定的重视。在再预防NTDs方面也有学者提到了用小剂量叶酸片(斯利安)可以得到非常好的效果 [15]。
MTHFR作为叶酸代谢和同型半胱氨酸(Hcy)通路中的关键代谢酶,维持了体内Hcy的正常代谢过程,若该过程受阻,会使Hcy在体内的浓度升高。之前有学者阐述了Hcy与肺癌、原发性肝癌、肠癌、胃癌、妇科肿瘤(乳腺癌、宫颈癌)、食管癌的发生有一定的关系 [16],但究其源头大部分还是跟叶酸摄入不足有关。目前已发现人类的MTHFR基因氨基酸序列存在多个突变位点,其中MTHFRC677T (C > T)是一种常见突变,突变后酶的活性发生改变,血浆Hcy的代谢障碍,导致HHcy血症和低叶酸血症。有研究表明血清Hcy的含量越高,血清叶酸的含量越低,胎盘重量和新生儿体重偏轻的风险越高,早产和前期子痫的发生率更高 [17]。除此以外,研究还发现,血浆Hcy升高会导致不良妊娠结局,如NTDs、唇腭裂、先天性心脏病、复发性流产及妊娠高血压等 [18]。同时HHcy还跟其它脑卒中、心血管疾病(冠心病)、高血压、2型糖尿病、神经系统疾病、慢性肾脏疾病、骨质疏松症密切相关 [19]。本研究中MTHFR C677T基因突变的比例占总人数的55.3%,说明了MTHFR C677T基因在妊娠妇女中突变率较高。此外研究显示MTHFR C677T基因纯合突变TT与妊娠不良结局(流产、死胎、早产、胎儿畸形及先天性出生缺陷等)存在相关性 [20]。研究表明MTHFR基因677位点T等位基因多态性可能与新生儿早产相关 [21],患者MTHFR C677T突变及血浆HCY水平的增高能够增加孕妇复发性流产的风险 [22],母体MTHFR C677T基因型加上叶酸补充过少可能会使先心病的风险增加 [23]。对于孕妇的影响,MTHFR C677T基因多态性还能够增加妊娠期高血压(PIH)的风险 [20],母体内叶酸水平与MTHFR C677T和A1298C基因型是产后抑郁发病的独立风险因素 [24]。MTHFR C677T基因型除了会对胎儿与母体造成伤害以外,还会对男性产生不育的影响 [25]。综上所述,妊娠妇女在服用叶酸前进行MTHFR C677T基因检测是十分必要的。
本研究显示妊娠早期妇女不合理补充叶酸的比例高达55.5%,MTHFR C677T基因纯合突变的妊娠妇女叶酸补充不合理率高达96.2%,其中以叶酸补充剂量不足为主。二胎政策放开,使得我国妇女的生育年龄普遍上升,35岁以上的孕妇(高龄孕妇)也逐渐增多,研究显示,高龄妊娠妇女的各种病症发生率高,除了会严重威胁到孕妇的身体健康,同时还会增加胎儿出生缺陷的发生率。因此,加强高龄妊娠妇女叶酸增补知识的宣传,提高孕期保健重要性的意识以及叶酸服用依从性是十分必要的。叶酸补充过少或过多都会产生不良的影响,叶酸缺少会引起胎儿出生缺陷(NTDs、CHD、唐氏综合征(DS)、唇/腭裂(CLP)),叶酸过量会使胎儿生长发育异常(哮喘、出生体质量等发育指标异常、导致后代行为学改变(如多动症、孤独症等)、导致后代代谢异常风险增高、导致后代出现胰岛素抵抗(IR)倾向) [26]。因此,如何利用检测孕妇叶酸代谢基因型来合理的补充叶酸就显得尤为重要,叶酸基因学检测也成为了众多学者研究的热点之一。
随着社会的发展进步,越来越多的孕妇增补叶酸的意识和依从性有所提高,但由于个体对叶酸的利用能力存在很大的差异,要具体如何做到合理的补充对于大部分人来说仍然是个问题,这就不得不依靠检测叶酸代谢基因型,根据基因型的不同为广大孕妇提供合理的个体化用药建议,根据孕妇自身情况合理补充叶酸,最终做到优生优育,提高国家的人口质量。