1. 引言
植物生长发育需要吸收大量含氮化合物,除铵态氮与硝态氮外,游离蛋白氨基酸(AAs)也是植物吸收氮的重要来源,尤其是在有机氮丰富的土壤中。氨基酸是蛋白质的重要组成部分,它也决定了谷物的大小、形状以及产量,且氨基酸还在植物氮代谢和信号转导中发挥着重要作用,比如,新老叶之间通过各种氨基酸转运体进行养分交换等 [1]。不同生态系统土壤溶液中各氨基酸的平均浓度一般在50 μM以下 [2] [3],然而植物(如拟南芥)叶片中游离氨基酸的含量约在<5 μM (色氨酸、络氨酸和异亮氨酸)和>1000 μM (谷氨酸)之间变化 [4] [5]。除了作为一种氮源来供应植物生长发育外,氨基酸在植物氮代谢、分布、信号转导和胁迫响应等方面也起着关键作用 [5] [6]。
目前利用分离植物组织等方法进行的生理学研究表明,植物中存在着广泛的底物特异性氨基酸转运体 [7] [8] [9]。AtAAP1/NAT2是从拟南芥cDNA文库中克隆出第一个植物氨基酸转运体,它具有广泛的底物特异性 [10] [11]。此后,在多种植物中发现了多种氨基酸转运体 [12]。通过序列比对分析发现,鉴定出的转运蛋白可总体分为两个家族:氨基酸、多胺、胆碱(APC, the amino acid/polyamine/choline)家族和氨基酸转运蛋白(ATF, the amino acid transporter)家族,这些转运蛋白在组织定位和底物特异性方面有着各自不同的特点 [13]。
拟南芥ATF家族共有46个成员,根据其序列同源性和转运特性,可以从其中划分出6个亚簇,包括AAPs (8个成员的氨基酸渗透蛋白)和LHTs (10个同源的赖氨酸/组氨酸转运蛋白) [14] [15]。在LHT家族中,研究主要集中在LHT1上,其最初通过酵母实验确定了赖氨酸和组氨酸的选择性转运体 [16]。在近年来的研究中报道了AtLHT1介导了中性和酸性氨基酸吸收进入根部,且具有高亲和力 [3] [17] [18]。Hirner等人 [18] 研究表明,突变AtLHT1基因(Atlht1)足以抑制植物生长,并且干扰氨基酸在拟南芥中的吸收和分布。AtLHTs家族具有广泛的底物特异性,组织特异性研究表明该家族基因在植物根、叶、花等器官中表达,不仅介导从土壤中吸收氨基酸,并且介导氨基酸在植物中的运输和分布 [18]。在作物中,尽管在水稻基因组中预测有6个LHT同源基因,但目前只有OsLHT1基因进行了一些研究 [19] [20] [21] [22],且其研究主要是利用创建LHT1突变体来反面证明该基因功能。本研究通过超表达OsLHT1基因,从正面来验证该基因的功能,并且选取几个水稻重要生长时期进行转录水平检测,为将来利用遗传育种方式提高作物产量和蛋白质含量等方面提供可靠的信息。
2. 材料与方法
2.1. 试验材料
本试验所用水稻种子品种为日本晴(WT, Oryza sativa L. cv. Nipponbare),拟南芥野生型WT (Wild type)为哥伦比亚生态型Col-0 (Arabidopsis thaliana L.),拟南芥纯合突变体Atlht1购买于NASC (Nottingham Arabidopsis Stock Centre)网站(http://arabidopsis.info),遗传背景为Col-0 (Arabidopsis thaliana L.),编号为 SALK-034566。
2.2. 主要试剂
RNA提取试剂盒Easyspin RNA Kit (购自艾德莱公司);第一链反转录试剂盒(Catalog# ZR108,购自庄盟生物);限制性内切酶BamH1 (购自NEB公司);金牌MIX高保真酶(购自擎科生物公司);胶回收试剂盒ZPN202-3 (购自庄盟生物)。
2.3. 试验方法
2.3.1. OsLHT1与AtLHT1之间蛋白序列比对
利用DNASTAR软件中Editseq对OsLHT1与AtLHT1的cDNA序列进行翻译,再用megalign对AtLHT1与OsLHT1蛋白序列进行比对。
2.3.2. 植物培养
水稻水培所需的培养液配方参照Wang等 [23] 的报道,营养液每2天换一次,培养在人工气候室中,温度设为28℃,湿度为70 %;拟南芥土培所使用的是营养土与蛭石3:1混合,在恒温温室中培养,温度设置为23℃。
2.3.3. 水稻各生育时期取样
本研究共选取水稻苗期(生长3周)和分蘖期(生长5周)的根部,旗叶,中叶和老叶五个生育时期和部位,其中,中叶和老叶分别指从旗叶倒数第3片和第6片叶子,在水稻生长约16周左右取样。取样时要迅速,把样品包裹在锡箔纸中标记好,迅速放入液氮中,存入−80℃冰箱,尽快做后续定量试验。
2.3.4. 植物RNA提取和定量PCR试验
在液氮条件下把植物样品研磨成粉末状,提取具体试验步骤严格按照Easyspin RNA Kit说明书进行。cDNA合成严格按照EX RT kit反转录试剂盒说明书在PCR仪上进行。使用Bio-Rad iCycler进行定量聚合酶链式反应(qpcr),反应体积为20 μL,反应程序设置为:95℃ 2 min,95℃ 15 s,56℃~60℃ 15~20 s,72℃ 20~30 s反应循环数为40。扩增产物经1.5%琼脂糖凝胶电泳检测。
2.3.5. 35s:: OsLHT1植物超表达载体构建
以表达量较高的水稻分蘖时期根部所提RNA反转录的cDNA为模板,用OsLHT1 up/down引物在pcr仪中扩增该片段,回收后连接至pEasyT-vector载体上,通过序列测定结果比对确保序列正确,并以此为模板,用带有BamH1碱基序列的OsLHT1 up/down引物进行片段扩增,回收后连接至pCAMBIA1302载体上,连接体系放置冰箱4℃过夜,并将该连接体系转化大肠杆菌感受态细胞TOP10,挑取单菌落进行菌落PCR验证,将PCR产物有单一明亮条带所对应的菌液培养过夜进行序列测定比对,确保正确连接至植物表达载体中后,提取质粒进行电击法农杆菌转化,农杆菌感受态所使用的的菌株是GV3101,挑取单一菌落 进行菌落PCR再次确保所挑单菌落正确,以保证后续拟南芥转基因试验顺利进行。
2.3.6. 拟南芥遗传转化及转基因植株的分子鉴定
拟南芥遗传转化所采用的是农杆菌侵染方法(蘸花法) [24]。转基因植株的分子鉴定我们采取三种方式逐步鉴定,pCAMBIA1302载体抗性为潮霉素,首先在带有50 μM潮霉素的拟南芥培养基上进行抗性筛选,然后将抗性筛选出的拟南芥移至土培中,待其生长2周后,减掉其1片叶子进行DNA提取,在基因组水平上检测是否插入了目的片段,最后再从RNA水平上测定该基因在转录水平上表达水平是否上调。
2.3.7. 拟南芥分枝数与果荚数统计
拟南芥野生型(WT)、突变体(atlht1)与转基因植株(atlht1 + 35s-OsLHT1)在土培条件下放置在恒温培养室中,每周浇水一次,待其生长成熟统计及果荚数和分枝数,转基因植株统计三个不同的独立转基因株系,每种植株统计至少15棵,进行统计学分析。
2.3.8. 引物序列信息
本研究所用引物名称及信息详见表1。
2.3.9. 数据统计分析
本研究利用IBM SPSS 19.0软件进行数据统计分析。在拟南芥野生型和转基因植株的果荚数、分枝数等数据采用单因素方差分析(ANOVA)。
3. 结果与分析
3.1. 水稻OsLHT1与拟南芥AtLHT1蛋白序列比对
通过水稻Aramemnon网站(http://aramemnon.uni-koeln.de/request.ep)预测的OsLHT1全长ORF (1344 bp),在DNASTAR中的Editseq软件进行序列翻译,通过Megalign与NCBI网站(https://www.ncbi.nlm.nih.gov/)对水稻OsLHT1与拟南芥AtLHT1序列进行蛋白序列比对(如图1),发现具有较高的同源性,相似度达78%。
3.2. OsLHT1在水稻不同生育时期基因表达分析
提取水稻苗期、分蘖期的根部,水稻生长约16周的新叶、中叶及老叶的RNA,反转录为cDNA,用Histone作为内参基因对各组织内的cDNA进行定量,结果显示,该基因在根部与地上部均表达,其中,在分蘖期的根部以及老叶表达最为强烈(如图2),推测该基因可能在从土壤中吸收氨基酸以及新老叶氨基酸转运等方面发挥着关键作用。

Figure 1. Sequence alignment between AtLHT1 and OsLHT1
图1. AtLHT1与OsLHT1蛋白序列比对
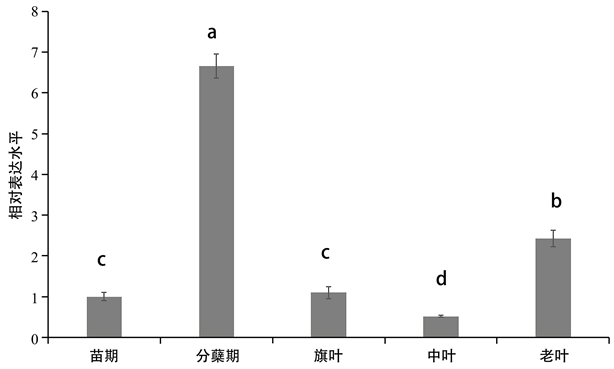
Figure 2. Relative expression levels of OsLHT1 in different growth stages and parts of rice
图2. OsLHT1在水稻不同生育时期和部位的相对表达水平
3.3. 35s:: OsLHT1植物超表达载体的构建与拟南芥异源过表达
本研究通过提取水稻分蘖期根部RNA并反转录为cDNA,以此为模板扩增OsLHT1片段,得到了1344 bp长度的正确片段(如图3(a)),通过该片段与pCAMBIA1302载体的BamH1/Bcl1同尾酶进行酶切与连接并转化,挑取单菌落验证(如图3(b)),菌落PCR获得单一条带,测序验证后确定了35s::OsLHT1超表达载体构建成功。通过点击法转化农杆菌GV3101,挑取单菌落培养并保存至−80℃,用于后续拟南芥转化试验。
 M:DNA Marker;M1:1 kb DNA Marker;M2~M3:1kb plus DNA Marker;1~3:以转基因获得三个独立的植株所提DNA为模板的OsLHT1 pcr产物;“-”代表负对照,以野生型为模板。字母表示统计学差异分析(P < 0.05,单因素方差分析one-way ANOVA)。M: DNA Marker; M1: 1 kb DNA Marker;M2-M3: 1kb plus DNA Marker; 1~3: OSLHT1 PCR products with DNA extracted from three independent transgenic lines as template; “-” represents the negative control, using the wild type as the template. Different letters indicate statistically significant differences (P < 0.05, one-way ANOVA).
M:DNA Marker;M1:1 kb DNA Marker;M2~M3:1kb plus DNA Marker;1~3:以转基因获得三个独立的植株所提DNA为模板的OsLHT1 pcr产物;“-”代表负对照,以野生型为模板。字母表示统计学差异分析(P < 0.05,单因素方差分析one-way ANOVA)。M: DNA Marker; M1: 1 kb DNA Marker;M2-M3: 1kb plus DNA Marker; 1~3: OSLHT1 PCR products with DNA extracted from three independent transgenic lines as template; “-” represents the negative control, using the wild type as the template. Different letters indicate statistically significant differences (P < 0.05, one-way ANOVA).
Figure 3. Relative expression levels of OsLHT1 in different growth stages and parts of rice
图3. 转基因株系鉴定
通过农杆菌蘸花法将35s::OsLHT1转入拟南芥突变体Atlht1中,通过抗性筛选(图3(c))、DNA水平验证(图3(d))和转录水平验证(图3(e)),获得了3个独立的且过表达OsLHT1的转基因株系(编号1,2,3号)。
3.4. 超表达OsLHT1的拟南芥Atlht1突变体的表型鉴定
本研究通过将3个独立的转基因株系繁育为T2代,用于表型鉴定。通过表型观察实验,发现atlht1 + 35s::OsLHT1的3个独立转基因株系表型大致相同,在拟南芥生长后期比未经转化的突变体atlht1分枝数及果荚数明显增多(如图4),并且发现野生型和过表达株系在抽薹后开花期明显比突变体Atlht1长。
 字母表示统计学差异分析(P < 0.05,单因素方差分析one-way ANOVA)。Different letters indicate statistically significant differences (P < 0.05, one-way ANOVA).
字母表示统计学差异分析(P < 0.05,单因素方差分析one-way ANOVA)。Different letters indicate statistically significant differences (P < 0.05, one-way ANOVA).
Figure 4. Phenotype identification of transgenic plants
图4. 转基因植株表型鉴定
4. 讨论
AtLHT1在拟南芥的根部及地上部(叶片)均有较强的表达水平,Wolfgang Koch [18] 等人在2006年报道AtLHT1是在维管系统之外的叶细胞表达的氨基酸转运蛋白,所以该转运蛋白除了负责根部在土壤中吸收氨基酸,还可能参与叶细胞对氨基酸的摄取过程。而该转运蛋白突变体(Atlht1)在生长过程中表现出矮小、早衰等症状,更从反面证明了AtLHT1具有氨基酸吸收与转运的重要功能。水稻OsLHT1同AtLHT1相似,不仅表现在蛋白质序列有着高度的同源性,在植物根部和地上部都具有较高的表达水平,还表现在它们都具有较为广泛的底物特异性 [18] [20] [21]。通过本研究,发现OsLHT1异源超表达可以互补拟南芥突变体Atlht1的表型,虽然OsLHT1近几年来通过创建Oslht1突变体从反面论证了该转运体的吸收与转运功能,但是通过建立超表达株系从正面论证该基因功能未见报道,目前仅报道OsLHT1在酵母系统和蛙卵细胞中似乎转运多种氨基酸,如谷氨酸、天冬氨酸等,但是在单细胞生物中并不能准确反映在植物体中的生物功能。本研究通过异源表达OsLHT1且互补了拟南芥atlht1突变体表型,从正面探究了水稻OsLHT1在植物生长发育过程中的可能性作用,拟南芥果荚数与分枝数相较于未转化的Atlht1突变体显著增多,可互补突变体Atlht1的生长。转录水平定量分析结果表显示,OsLHT1在根部与地上部均有表达,在老叶中表达最为强烈,推测该基因可能参与到了从老叶到新叶的养分转运过程,这与Guo [22] 等人测定的野生型与突变体Oslht1中旗叶与老叶总N量结果也相符合。本研究通过在拟南芥异源表达水稻氨基酸转运蛋白OsLHT1,初步探究出OsLHT1异源表达可恢复拟南芥突变体Atlht1生长矮小、产量低等表型,为在水稻中超表达是否提高氮素利用效率、提高产量和品质提供了可靠的信息。
基金项目
国家自然科学基金,项目编号31270881,题目“谷氨酸受体基因参与拟南芥根系生长响应外源氨基酸的分子功能研究”;教育部博士学科点基金,项目编号20134320110015,题目“水稻脲酶辅助蛋白基因UreD突变影响植物氮代谢及再利用的分子生理解析”。
NOTES
*通讯作者。