1. 引言
肿瘤是目前公认的威胁人类生命健康的一大类疾病,癌症已成为全球最主要的致死原因之一,肺癌是临床中比较常见的恶性肿瘤,近几十年来,以快速增长的趋势成为我国人口中确诊率和死亡率最高的恶性肿瘤 [1] [2]。因此,肺癌的治疗显得非常重要,虽然有手术治疗、放疗、化疗、靶向治疗、免疫治疗等综合治疗手段,并且治疗也取得一定效果,但在我国肺癌5年生存率仍低于15% [3],所以探索研究新的肺癌治疗方法很有临床意义。光动力疗法(photodynamic therapy, PDT)是近些年来兴起的一种治疗肿瘤的微创技术,是一种经过临床认可的、具有良好临床应用前景的治疗方法,以其创伤性小 [4]、靶向性准、毒性低微 [5] 和相对成本低等优点脱颖而出,且在各种肿瘤的治疗方法中显现出了很大的优势,已被逐渐应用于呼吸道恶性肿瘤的治疗中,这一新型的创伤小的治疗方法正引起人们的广泛关注和研究,成为肿瘤治疗领域的一个新方向。本实验通过构建小鼠肺腺癌转移瘤模型探究光动力治疗对肿瘤细胞的杀伤效应,为临床光动力学治疗提供理论依据。
2. 材料与方法
2.1. 材料
1) 实验动物雌性BALB/c裸鼠24只,5~6周龄,体质量14~16 g,SPF级,购自北京维通利华实验动物技术有限公司。实验过程中动物的使用符合动物伦理委员会的要求。饲养环境温度26℃~28℃,湿度40%~60%,湿度控制在40%~60%,并予以12 h明–暗循环照明;裸鼠所需的饮用水、饲料、垫料以及其他用具都经过高压蒸汽灭菌处理;鼠笼每周清洁。
2) 实验用细胞株人肺腺癌A549细胞株,购自美国菌种保藏中心
3) 主要试剂RPMI-1640培养基以色列BI公司
HE染色试剂盒 北京索莱宝科技有限公司
TUNEL试剂盒 瑞士罗氏(Roche)公司
DAB显色试剂盒 北京索莱宝科技有限公司
4) 仪器LED-IB光动力治疗仪,武汉亚格光电技术有限公司产。
5) 光敏剂血卟啉衍生物,购于北京索莱宝科技有限公司,用含10%胎牛血清和1%青链双抗的RPMI-1640完全培养液稀释至所需浓度,现配现用。
2.2. 方法
1) 肺癌动物模型的建立:在无菌条件下收集肺癌A549细胞株,置于培养基中进行培养。在细胞对数期生长期收集细胞,加入PBS重悬细胞,根据细胞计数结果,调整加入的PBS量,使之稀释,维持最终细胞浓度在1~2 × 107个/ml,每200 ul细胞悬液装入1.5 ml小离心管内,取0.2 ml细胞悬液注射于裸鼠肩胛骨处,接种完成后的皮下可以看到细胞悬液聚集形成的包,用手触摸有波动感,重复以上操作,直到24只裸鼠全部处理完毕。裸鼠在接种肿瘤细胞后,大约经过5~7天的潜伏期,可见皮下有移植瘤出现,呈圆形或椭圆形结节,用游标卡尺测量瘤体大小,其长径均在4~5 mm之间,表明裸鼠肺癌模型造模成功,成瘤率100% (24/24)。每隔3天测量一次瘤体长径与短径,绘制生长曲线图。以公式肿瘤体积(V) = 1/2 × ab2计算体积,其中a代表瘤体长径(cm),b代表短径(cm),待体积达0.150~0.200 cm3时进行分组 [6]。
2) 分组将24只荷瘤裸鼠随机分成4组,每组6只:空白对照组,即不做任何处理;单纯光敏剂组,只给以光敏剂而无激光照射;单纯光照组,不注射光敏剂只给以630 nm激光照射;光动力治疗组,即注射光敏剂后630 nm激光照射。光动力治疗采用低剂量多次照射的方式,即按照10 mg/kg剂量在瘤体内直接注射光敏剂,从肿瘤的三个方向分三点式注射尽量让其均匀分布,避光4小时后,每只裸鼠注100微升10%的水合氯醛,大约2~3分钟裸鼠进入麻醉状态,然后用630 nm激光照射,功率密度80 mw/cm2,光圈直径5 cm,照射10分钟。光动力治疗时,精确摆位,仅暴露裸鼠肿瘤部分,其余部分用黑布覆盖,以防止裸鼠正常皮肤受到辐射,肿瘤部位全部包含在光斑内。每2天照射一次,共3次。
3) 实验观察:通过颈椎脱臼法处死裸鼠,剥取肿瘤标本,完整取出瘤体,分别测量瘤体质量体积变化,标本部分剪切成小块置于4%多聚甲醛溶液中固定24小时后用于HE及TUNEL染色,对抑瘤率、瘤体组织病理学进行分析对比,观察瘤体内肿瘤细胞增殖活性和凋亡情况。
a) 肿瘤大体形态及体积变化的观察以游标卡尺测量并详细记录治疗前和治疗后小鼠皮下移植瘤的长径(a)、宽径(b)及高(c),计算肿瘤体积(V) = 1/2 × ab2。
b) 抑瘤率测算 治疗后14天,每组随机抽取5只荷瘤裸鼠,颈椎脱臼术处死荷瘤小鼠,完整剥离肿瘤组织,电子天平称取瘤重并记录数据,计算抑瘤率:
体积生长抑制率 = (1 − 实验组平均体积/对照组平均体积) × 100%。
c) 肿瘤组织病理检测剥离出的小鼠肿瘤组织,切取厚度不超过5 mm的组织切片经10%福尔马林溶液固定24 h,常规石蜡包埋、切片,做HE染色,以中性塑胶封片,光镜下观察病理切片,通过细胞坏死情况评价瘤体组织的损伤程度。
d) 肿瘤组织细胞凋亡水平检测检测肿瘤细胞凋亡情况,取各组肿瘤组织石蜡切片,二甲苯脱蜡(二甲苯I 10 min、二甲苯II 5 min),然后由高浓度到低浓度乙醇漂洗,再由PBS冲洗2次后晾干,滴加蛋白酶K工作液(100 μg/ml) 37℃下孵育30 min,再次冲洗后晾干,切片上滴加50 μl TUNEL工作液(含平衡液98 μl、TdT 1 μl、生物素标记的dUTP 1 μl),为防止样本干燥和确保反应液分布均匀在反应液区域盖上塑料盖玻片使标本于37℃避光1 h,PBS液洗涤,DAB显色,400倍光镜下观察和控制反应时间,镜下背景出现浅棕色时用蒸馏水冲洗终止显色,苏木素复染数秒后用自来水水洗返蓝,再经梯度乙醇脱水、二甲苯透明后利用中性树胶封片,晾干的切片方可在显微镜下观察凋亡细胞或者采集图像,显微镜下组织切片上棕褐色棕色或棕黄色为凋亡细胞,随机选择5个视野,计算细胞凋亡率。
e) 荧光定量PCR各组取适量肿瘤组织加入1 ml Trizol充分研磨行总RNA提取。测定浓度后,参照反转录试剂盒说明书经去除基因组DNA反应和反转录反应将提取的总RNA反转录为模板cDNA,用于SYBER Green法荧光定量PCR,以β-actin作为内参,检测Bax、Bcl-2的mRNA相对表达情况。引物由北京睿博兴科生物技术有限公司合成。通过CT值计算各组Bax、Bcl-2mRNA的相对表达量,相对表达量用2−ΔΔ Ct表示。
f) Western blot取适量肿瘤组织剪碎,按照试剂盒说明书操作加入RIPA裂解液提取各组裸鼠肿瘤组织内总蛋白,采用BCA法测定蛋白浓度。于聚丙烯酰胺凝胶电泳(5%浓缩胶,12.5%及10%分离胶)进行蛋白分离,加样后电泳,转至0.45 um PVDE膜,封闭后PBST洗膜并分别孵育一抗4˚过夜,选用GAPDH用作内参。次日,PBST洗膜后加入二抗室温孵育1 h,再次洗膜后ECL 发光法显色,使用Fusion Fx凝胶成像系统采集图像。结果用image-J图像分析系统测定各条带的灰度值,以目的条带与内参条带平均灰度值的比值作为目的蛋白的相对表达量。
2.3. 统计学方法
用SPSS23.0统计软件进行统计学分析,绘图采用GraphPad Prism 5软件,每组实验重复3次,实验数据均以均数 ± 标准差(x ± s)表示,多组组间数据总体比较用单因素方差分析法,组间两两比较采用LSD-t检验进行分析;P ≤ 0.05提示差异具有统计学意义。
3. 结果
1) 肿瘤的体积生长情况观察及肿瘤抑制率
接种后约5~7天,所有裸鼠接种部位均出现5~7 mm圆形或椭圆形等不规则形状的结节,瘤体触摸偏硬,证明造模成功。随后肿瘤逐渐增大,各组裸鼠肿瘤体积随时间呈不同程度的增长趋势,后期空白组、单纯光敏剂组、单纯光照组肿瘤生长速度较之前相比无明显改变,肿瘤生长明显,而治疗组裸鼠肿瘤生长速度明显变慢,生长抑制作用显著,裸鼠运动、进食、反应力和之前相比无明显改变。光动力治疗前及治疗后5天各组裸鼠生长无显著差异,治疗后第7天开始治疗组肿瘤体积与空白组、单纯光敏剂组和单纯光照组相比较明显减小,差异具有统计学意义(P < 0.05),而空白组、单纯光敏剂组、单纯光照组肿瘤生长无明显差异,治疗前后各组裸鼠肿瘤体积生长变化如表1所示,肿瘤生长曲线如图1所示:

Table 1. Changes of tumor volume in nude mice before and after treatment
表1. 治疗前后各组裸鼠肿瘤体积生长变化(mm3) (x ± s)
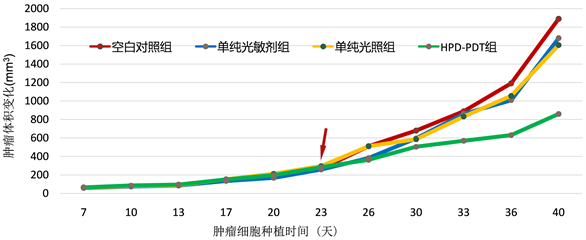 注:箭头表示PDT治疗的时间点。
注:箭头表示PDT治疗的时间点。
Figure 1. Effect of HPD-PDT on the volume of subcutaneous transplanted tumor in nude mice
图1. HPD-PDT对裸鼠皮下移植瘤体积的影响
2) HE染色结果
肿瘤组织经HE染色后,细胞核呈蓝色,胞浆及间质呈红色,显微镜下观察切片,四组切片内均可见肺癌细胞,肿瘤细胞形成大小、形态不一的巢团状、条索状、腺样结构,血管扩张、充血、出血,部分腺腔内可见粉染的物质,排列紧密整齐,核大深染,病理性核分裂象多见间质较为疏松,染色偏粉色。与其它三组相比较,光动力治疗组肿瘤细胞数量明显减少,细胞排列紊乱,极性消失,且细胞核固缩、染色质淡染坏死,分裂像多见(见图2)。
3) TUNEL染色结果
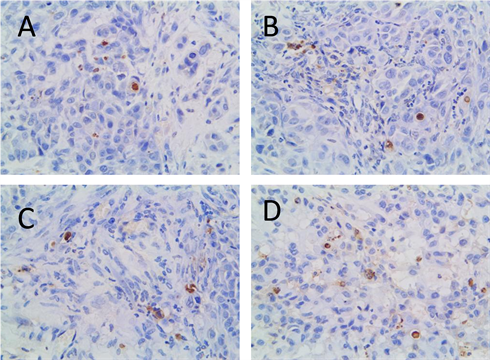
各组裸鼠移植瘤组织切片内均可见凋亡细胞,凋亡细胞散在于瘤细胞之间,胞浆减少,核内可见棕黄色颗粒物质,呈核碎裂、核固缩或核溶解现象。与其它三组相比较,光动力治疗组棕褐色的凋亡阳性细胞明显增多,凋亡现象最为明显(见图3)。每组TUNEL切片选取5个阳性细胞数量最多的高倍视野计算凋亡指数,即凋亡细胞占视野中所有细胞的百分比。对照组、单纯光敏剂组、单纯光照组和PDT组的细胞凋亡指数分别为5%、6.2%、6.9%和30.2%。PDT组明显高于对照组、单纯光敏剂组和单纯光照组(P < 0.05),差异具有统计学意义。
 A. 空白对照组;B. 单纯光敏剂组;C.单纯光照组;D.HPD-PDT组
A. 空白对照组;B. 单纯光敏剂组;C.单纯光照组;D.HPD-PDT组
Figure 2. HE staining was used to observe the morphological structure of tumor tissue (×400)
图2. HE染色观察各组肿瘤组织形态结构(×400)
 A. 空白对照组;B. 单纯光敏剂组;C.单纯光照组;D.HPD-PDT组
A. 空白对照组;B. 单纯光敏剂组;C.单纯光照组;D.HPD-PDT组
Figure 3. TUNEL staining was used to observe apoptosis of each group (× 400)
图3. TUNEL染色观察各组细胞凋亡情况(×400)
4) PCR法检测裸鼠移植瘤组织内Bax、Bcl-2 mRNA表达水平
与空白组、单纯光敏剂组、单纯光照组相比较,HPD-PD组Bcl-2 mRNA相对表达量显著下降,与其他三组相比较,差异均具有统计学意义(P < 0.05);Bax mRNA相对表达量显著上升,差异具有统计学意义(P < 0.05);而其它三组Bax、Bcl-2 mRNA 表达水平均无统计学差异,具体表达水平如表2、图4:

Table 2. Relative expression of Bcl-2 and Bax 2−△△CT in nude mice xenografts (x ± s)
表2. 各组裸鼠移植瘤组织内Bcl-2、BAX 2−△△CT相对表达量(x ± s)
 A. 空白对照组;B. 单纯光敏剂组;C. 单纯光照组;D. HPD-PDT组(P < 0.05)
A. 空白对照组;B. 单纯光敏剂组;C. 单纯光照组;D. HPD-PDT组(P < 0.05)
Figure 4. Relative expression levels of Bax and bcl-2 mRNA after PDT treatment
图4. PDT治疗后Bax、Bcl-2的mRNA相对表达水平
5) Western blot检测裸鼠移植瘤组织内Bax、Bcl-2的蛋白表达变化与空白组、单纯光敏剂组、单纯光照组相比较,HPD-PDT组Bax蛋白相对表达量显著上升,差异具有统计学意义(P < 0.05);Bcl-2蛋白相对表达量显著下降,与其他三组相比较,差异均具有统计学意义(P < 0.05);而其它三组Bax、Bcl-2蛋白表达水平均无统计学差异,结果如下(见图5、图6)。
 A. 空白对照组;B. 单纯光敏剂组;C. 单纯光照组;D. HPD-PDT组
A. 空白对照组;B. 单纯光敏剂组;C. 单纯光照组;D. HPD-PDT组
Figure 5. Protein development results of Bax and Bcl-2 proteins
图5. Bax、Bcl-2蛋白显影结果
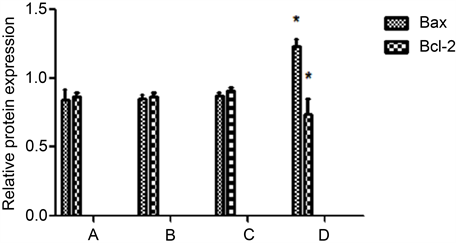 A. 空白对照组;B. 单纯光敏剂组;C. 单纯光照组;D. HPD-PDT组
A. 空白对照组;B. 单纯光敏剂组;C. 单纯光照组;D. HPD-PDT组
Figure 6. Relative protein expression of Bax and Bcl-2
图6. Bax、Bcl-2蛋白相对表达量
4. 讨论
光动力疗法(photodynamic therapy, PDT)对于多种肿瘤都有很好的治疗效果,随着肺脏介入医学的发展,光动力治疗的优势逐渐突出,因其具有微创、可重复、低成本、低免疫原性、局部高选择性等优点 [7] 被逐渐应用于呼吸系统恶性肿瘤的治疗中。临床各项研究表明,光动力疗法的临床优势在于破坏肿瘤组织的同时能够最大限度地保护正常组织不受破坏,PDT对人体几乎无损伤或轻微损伤后易于恢复,也可协同其他传统的治疗方式提高疗效并减少副作用,并具有实施简便、微创、可反复实施等优点,所以PDT被越来越多地认为是治疗多种癌症的非侵入性治疗方法,其选择性杀瘤作用在现有的各种肿瘤微创治疗手段中属于最强的 [8] [9]。有研究表明PDT可直接杀伤癌细胞、促进细胞凋亡,并可调节荷瘤小鼠的免疫功能 [10],并且能激活机体的免疫反应,损伤肿瘤组织脉管系统,抑制新生血管,从而达到治疗肿瘤的目的 [11]。光动力疗法也可启动机体免疫系统杀伤肿瘤细胞,诱导肿瘤细胞凋亡而起到治疗作用 [12] [13]。所以细胞凋亡被认为是PDT杀伤肿瘤过程中的重要机制,一般来说,细胞凋亡有两种途径,死亡受体途径和细胞应激途径,这两条通路都与Caspase-3的激活密切相关,因此Caspase-3是细胞凋亡的关键酶 [14] [15]。B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2)家族蛋白主要有两类,一是抗凋亡蛋白Bcl-2,二是Bcl-2相关X蛋白(Bcl-2 Associated X Protein, Bax),二者均在细胞凋亡的调节中起重要作用 [16]。Bcl-2家族蛋白可以改变线粒体膜通透性,调节转运孔开放从而影响线粒体的跨膜电位,而线粒体跨膜电位的崩塌开启了细胞凋亡的第一步并且意味着细胞凋亡的不可逆发生 [17]。正常情况下,Bax与Bcl-2通过形成同源或异源二聚体来调节细胞凋亡,但当某些因素导致Bax高表达或Bcl-2低表达所致其比值上升,则会导致细胞凋亡的发生 [18]。本实验中结果显示光动力疗法治疗后第8天时对于荷瘤小鼠的肿瘤组织具有抑制作用,单纯光敏剂或单纯激光照射对肿瘤组织无明显杀伤作用,根据HE染色结果的分析显示,光动力疗法治疗组肿瘤细胞坏死,明显降低肺癌细胞存活率,TUNEL染色结果治疗组凋亡细胞明显增多,凋亡指数较对照组明显升高,HPD-PDT处理后裸鼠肺腺癌移植瘤组织中Bax表达水平升高,Bcl-2表达水平降低致Bax/Bcl-2比值增高,从而促进了移植瘤的凋亡发生,进一步证实通过诱导肿瘤细胞凋亡从而实现了HPD-PDT治疗的抗肿瘤作用。
作为新兴的肿瘤治疗方法,光动力治疗对肿瘤细胞的杀伤效应具备传统治疗方法所无法企及的优势,在临床上治疗肺癌也得到了广泛的应用并取得一定的成效,已被列入肿瘤治疗的五大基本方法之一,但是光动力疗法的治疗范围以及治疗稳定性仍然不足,治疗效果没有明显的优势,而且光动力治疗不够方便,不能大范围普及,这是我们亟待解决的问题。本文在抑制体积变化和组织病理学上观察到光动力治疗能显著抑制瘤体生长,促进细胞凋亡,从而确定了光动力疗法对肿瘤细胞的杀伤效应,其机制与通过上调Bax下调Bcl-2基因表达从而促进组织细胞凋亡,达到抑制移植瘤生长的目的,但确切的信号转导通路有待进一步研究,这将为临床PDT的治疗提供更有力的证据。目前PDT的治疗尚处于研究阶段,缺乏规范的治疗方案,因此还需要进一步加强基础及临床研究,明确其对疾病的疗效,随着PDT的广泛开展,对其研究逐步深入,相信未来光动力疗法在肿瘤的治疗领域会有着更为广阔的应用前景。
基金项目
青岛市黄岛区科技局项目(2014-1-77)。
NOTES
*通讯作者。