1. 引言
与人类疾病相关的脲支原体属可划分为2个种,14个基因型 [1] [2],在人体分离到的主要是细小脲支原体和解脲脲支原体。解脲支原体(Ureaplasma urealyticum, UU)是属于柔膜体纲支原体目一种的原核微生物,缺乏细胞壁,体积处在细菌和病毒之间 [3]。解脲支原体在形态上呈高度多形性,在含低浓度琼脂的固体培养基上培养可出现典型的“荷包蛋样”菌落。其细胞膜上的糖脂与膜蛋白结合,构成解脲支原体的主要抗原成分,该抗原在人体可引起体液免疫。目前,解脲支原体是可在无生命体培养基中生长、繁殖的最小微生物,它既可以独立存在,也可以寄生。目前有研究认为解脲支原体与不孕有关,解脲支原体引起不孕的途径有多种,如影响排卵、精子质量、受精卵着床等。
解脲支原体是女性宫颈寄居最常见的微生物之一,具有一定的致病性。按照不同的生物表型和基因特征可以将解脲支原体划分为生物一群和生物二群两种生物亚群 [4],生物一群即Parvo生物群,包括1、3、6、14四种血清型,生物二群即T960生物群,包括2、4、5、7~13十种血清型 [5]。有研究显示,解脲支原体在无临床症状的女性中的检出以生物一群为主 [6],而在患有阴道炎的女性中,生物二群的检出率为43%,显著高于其在无阴道炎的女性中的检出率,后者为5% [7]。但也有研究认为生物一群中血清型1、3型的致病性强于其他血清型。
2. 材料与方法
2.1. 样品材料
本实验中所用的解脲支原体样本均来源于中国典型培养物保藏中心。
2.2. 实验器材和设备
PCR仪,德国Biometra公司;小型旋转混合仪,上海新芝;生物安全柜,ESCO公司;倒置荧光显微镜,宁波舜宇仪器。
2.3. UU基因组提取
取200 μL解脲支原体样本,100℃加热10 min,冷却后12000 rpm离心3 min,收集上清。
2.4. PCR引物
解脲支原体Mba抗原基因含1200多个碱基,N端1/3是保守区,C端2/3是可变区。N端在同一生物群各血清型和同一血清型各变异株中长度一致,而C端的大小可变。根据此特征设计引物,根据片段大小鉴定样品的生物群及血清型。生物分群特异性引物UMS-125F、UMS-226R,该PCR产物:生物一群404 bp,生物二群448 bp;生物一群血清型特异性引物如下:血清型1引物:UMS1F、UMS1/6R,扩增产物399 bp;血清型3引物:UMS3F、UMS3/14R,扩增产物397 bp;血清型6引物:UMS6A、UMS1/6R,扩增产物369 bp;血清型14引物:UMS14F、UMS3/14R,扩增产物400 bp。引物序列信息如表1所示:

Table 1. PCR primer sequences used in this study
表1. 本研究中所用PCR引物序列
2.5. PCR反应条件
将每份样品的DNA先经UMS-125F、UMS-226R这对引物扩增,若样品为生物一群,则再分别用UMS1F、UMS1/6R;UMS3F、UMS3/14R;UMS6A、UMS1/6R;UMS14、UMS3/14R这四对引物扩增,PCR程序为95℃ 5 min→55℃ 30 s→72℃ 1 min,共计32轮循环扩增。50 μL的PCR工作体系:Taq聚合酶25 μL、5’→3’引物2 μL、3’→5’引物2 μL、样品DNA 2 μL。
2.6. 琼脂糖凝胶电泳
将2 g琼脂糖粉末和100 mL的1×TAE缓冲液置于锥形瓶,将锥形瓶置于微波炉内加热3~5 min,随后取出冷却2 min,用枪头吸取2.5 μL Gel-Red染料加至琼脂糖溶液中,轻微摇晃混匀。将梳子插进制胶板,将混匀的琼脂糖溶液倒入,室温静置30 min,待溶液冷却凝固。充分凝固后将梳子轻轻垂直拔出,将制胶板置入电泳槽中,在电泳槽中加入1×TAE缓冲液直至没过凝胶表面2 cm。取5 μL PCR产物,加1 μL的6×loading试剂,用移液枪轻轻吹打混匀,小心加入点样孔。打开电源开关,调节电压,可看到溴酚蓝条带移动位置,待其移动到适当位置时关闭电源,将制胶板从电泳槽取出。打开紫外灯和凝胶成像系统,将制胶板放置于台面,轻轻移去制胶板,观察并记录跑胶情况。
3. 结果
3.1. 生物群引物鉴定结果
如图1所示,将样品1、2、3、4、5、6、7、8、9、10、11的DNA用生物分群特异性引物UMS-125F、UMS-226R进行PCR扩增,所得PCR产物经2%琼脂糖凝胶电泳,结果表明,样品1、11为生物一群,样品2~10为生物二群。
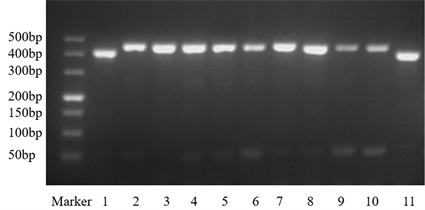
Figure 1. Biota identification of UU samples
图1. UU样品的生物群鉴定
3.2. 生物一群引物鉴定结果
如图2所示,将样品1、11的DNA分别经生物一群的1、3、6、14血清型特异性引物PCR扩增,所得PCR产物经2%琼脂糖凝胶电泳,结果表明,样品1为血清型1型,样品11为血清型14型。
 (a)
(a) 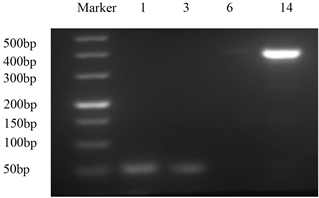 (b)(a) 将样品1的DNA分别经生物一群的1、3、6、14血清型特异性引物PCR扩增,所得PCR产物经2%琼脂糖凝胶电泳经2%的琼脂糖凝胶电泳检测;(b) 将样品1的DNA分别经生物一群的1、3、6、14血清型特异性引物PCR扩增,所得PCR产物经2%琼脂糖凝胶电泳经2%的琼脂糖凝胶电泳检测
(b)(a) 将样品1的DNA分别经生物一群的1、3、6、14血清型特异性引物PCR扩增,所得PCR产物经2%琼脂糖凝胶电泳经2%的琼脂糖凝胶电泳检测;(b) 将样品1的DNA分别经生物一群的1、3、6、14血清型特异性引物PCR扩增,所得PCR产物经2%琼脂糖凝胶电泳经2%的琼脂糖凝胶电泳检测
Figure 2. Serotype identification of UU samples 1 and 14
图2. UU样品1、14的血清型鉴定
4. 讨论
解脲支原体是人类泌尿生殖道中一类常见的共生微生物,在无临床症状表现的性成熟女性生殖道中也能检出。1954年Shepard首次从非淋菌性尿道炎患者的尿道中分离得到解脲支原体 [8]。近年来,解脲支原体的检出率逐渐上升,作为一种条件致病菌,当机体的免疫能力和内环境改变时,定植于黏膜表面促进释放出蛋白水解酶、过氧化物、各种磷脂酶等多种毒性代谢产物,可以导致机体损伤和炎症反应的发生 [9]。如其分解尿素产生的过氧化氢,能够提高生殖道的pH值,导致女性生殖道内的正常的弱酸性环境被破坏,增加了宿主被其他病原微生物感染的风险。
有大量文献报道,解脲支原体是非淋病性泌尿生殖系统炎症的主要病原体,与女性的多种疾病有关,解脲支原体感染能够引起输卵管积水、粘连,致使输卵管阻塞进而导致女性输卵管性不孕,解脲支原体还能引起非淋病性尿道炎、非特异性尿道炎、绒毛膜羊膜炎、生殖道感染、胎膜早破、早产儿呼吸窘迫综合症以及其他疾病等 [10]。虽然大多数解脲支原体感染是无症状的,但是这些感染会增加流产、早产和死产等不良妊娠结果的风险。
近年来对男性不育的关注增高,有研究发现解脲支原体的感染会增加男性不育的风险,解脲支原体致使男性不育的途径有多种,例如其可干扰精子的发生、影响精子的活力等。有研究者发现解脲支原体在不育男性精液中的检出率位48%,明显高于其在可生育男性精液中的检出率,后者为25%,这表明解脲支原体的感染可能威胁了男性的生殖健康。Wang等研究者发现,解脲支原体的感染与精液pH值的降低、精液密度降低密切相关 [11];Moretti等研究者发现解脲支原体的感染可致使不育男性的精子质量降低 [12]。
解脲支原体包括2个生物亚群,对解脲支原体进行分群分型的依据主要是其表面抗原即MBA (多带抗原) [13]。MBA也是机体识别解脲支原体不同生物群及血清型的主要外膜抗原,在不同生物群和血清型种MBA的长度不同,因此不同生物群、血清型的解脲支原体表现的致病力有所差别。
影响解脲支原体致病性的因素有许多种。有研究结果显示它的致病性与生物亚群密切相关,如血清型1、3、4、8可引起女性生殖道炎症,血清型4与早产、流产、胎膜早破等关系密切,血清型3、4是引起不孕症的原因之一;生物二群的解脲支原体与男性不育的关系更为密切,有研究显示,被生物二群的UU感染后,精子的总活力明显降低,这可能与解脲支原体可诱导机体产生精子抗体,导致精子凝集,阻抑了精子的运动,且在电镜下观察,解脲支原体分别附着在精子的头尾部位,致使镜子头部出现折角及尾部卷尾,精子膜破损,增加畸形精子的占比 [14]。生物二群的解脲支原体还能降低精子的浓度,这可能与谷草转氨酶有关 [15]。也有研究表明,解脲支原体作为一种条件致病菌,当其浓度达到一定值时会导致人体免疫系统的失衡。有研究者在小鼠中接种不同浓度的血清型3型的解脲支原体,发现UU3在宫颈管的阳性检出率随接种浓度的增高而增高;除此之外,还有多种因素会影响解脲支原体的致病性,如宿主的性伴数、菌群失调、宿主免疫力等,如解脲支原体在尚无性生活史的女性生殖道和宫颈中的检出率明显低于其在性生活频率高的女性生殖道和宫颈中的检出率,且性乱行为可增加解脲支原体的传播,并使其感染复杂化。
检测解脲支原体的方法有多种,实验室最常用的方法是分离培养法,将其在液体培养基中扩增,再接种于琼脂糖固体培养基上培养,用低倍镜显微镜观察,可观察到有微小的“油煎蛋”样菌落,但是这种方法容易出现假阴性,且不能分群、分型。随着分子生物学的发展,PCR检测逐渐成为新的检测主流方法,且根据编码MBA的核酸序列设计不同血清型引物对其进行分群、分型检测,具有特异性高、耗时短的优点。血清学检测也是一种实验室常用的检测解脲支原体的方法,常用的血清型检测方法主要为间接免疫荧光染色检查法、酶联免疫吸附试验,具有很高的灵敏度和特异性。
目前针对解脲支原体感染的治疗方案仍以抗生素为主,临床上较常应用的药物主要有四环素类、大环内酯类及喹诺酮类,其中以四环素类药物为首选 [16]。本实验中对分离株进行分群分型,可对后续的药敏研究奠定基础。
参考文献
NOTES
*通讯作者。