1. 引言
真鲷虹彩病毒病(Red Sea Bream Iridovirus Disease, RSIVD)是引起海水养殖鱼类的重要疾病,1990年在日本四国岛的人工养殖真鲷中首次暴发 [1]。随后在东亚,东南亚等国家开始盛行 [1]。RSIVD病原为真鲷虹彩病毒(Red Sea Bream Iridovirus, RSIV),隶属于虹彩病毒科(Iridoviridae),细胞肿大病毒属(Megalocytivirus)。病毒粒子为二十面体结构,核衣壳直径120~130 nm,具有囊膜 [2]。RSIVD是世界动物卫生组织(OIE)成员国必需申报和水产品国际贸易中监测的鱼类重要疾病之一。由虹彩病毒感染导致的水生动物疾病已成为世界水产养殖业的严重问题。近年来,随着我国水生动物贸易总量的增加,该病已经传入国内,并在沿海局部地区流行开来,我国由真鲷虹彩病毒所引起的海水养殖鱼类疾病正日益加剧,引发多种经济名贵鱼,如:大黄鱼、石斑鱼、鳜鱼、牙鲆鱼、美国红鱼等大规模死亡,据统计,每年RSIVD 给我国水产养殖业造成数十亿元的经济损失 [3]。
鉴于真鲷虹彩病毒给水产养殖业带来的无法估量的严重危害及巨大经济损失,因此非常有必要建立一种准确、快速、灵敏的检测方法对其进行监控,从而保证水产养殖业的健康发展。
目前报道的真鲷虹彩病毒检测方法主要有:细胞培养法、常规PCR法,多重PCR法、实时荧光定量PCR法、环介导等温扩增(LAMP)法等 [4],这些方法在快速、灵敏、高通量的检测方面存在一定的不足之处。我国出入境检验检疫行业标准中规定,对RSIV的检测一般采用常规PCR方法,但是该方法不能完全满足检验检疫通关对病原检测周期短、业务量大的要求,同时该方法灵敏度有限,对病毒感染初期的水生动物病害的监测存在一定程度的漏检。
近年来,实时荧光定量PCR (Real-time PCR)技术以其简单快速、灵敏度高和成本低廉等优点,被广泛应用于水生动物病毒的分析及检测等领域。本研究采用SYBR Green I荧光定量PCR方法,以RSIV基因保守片段为靶序列,设计特异性引物,建立针对RSIV的快速、敏感、特异的检测方法,对病毒进行早期精准检测与诊断,从而为我国进出口水生动物国际贸易的发展提供必要的技术保障。
2. 材料与方法
2.1. 毒株、试剂与仪器
RSIV (真鲷虹彩病毒)、IPNV (传染性胰脏坏死病毒)、IHNV (传染性造血器官坏死病毒)、SVCV (鲤春病毒血症病毒)及VHSV (病毒性出血性败血症病毒)由本实验室分离保存。
SYBR® Premix Ex TaqTM (Tli RNaseH Plus)试剂盒、DEPC水等购于大连宝生物工程公司。
ABI 7300荧光PCR仪:美国ABI公司;移液器:德国Eppendorf;ABI 9700定性基因扩增仪美国ABI公司;凝胶成像系统美国UVP公司;DYY-7C电泳仪北京市六一仪器厂。
2.2. 引物的设计与合成
选择RSIV特异保守的laminin-like protein基因片段为目标序列,分别设计SYBR Green I荧光定量PCR引物及特异性PCR引物,引物序列如下:
SYBR Green I荧光定量PCR引物序列为:
RSIV-P1:5'-TGCCACAGTCAGCAACACAA-3'
RSIV-P2:5'-GCACCAACACATCTCCTATCTCAA-3'
特异性PCR引物序列为:
RSIV-F:5'-CTCAAACACTCTGGCTCATC-3'
RSIV-R:5'-GCACCAACACATCTCCTATC-3'
该特异性PCR引物扩增区域包含了SYBR Green I荧光定量PCR引物的扩增区域,扩增目标DNA片段长度为570 bp,用于制备阳性质粒作为标准品。
上述引物均由宝生物大连有限公司合成。
2.3. 病毒核酸的提取
参照宝生物公司生产的病毒基因组DNA/RNA 提取试剂盒说明书,对RSIV、IPNV、IHNV、SVCV及VHSV提取核酸后置−70℃保存备用。
2.4. RSIV标准品的制备
为了得到可定量和稳定的RSIV阳性模板,需要将扩增的RSIV目的片段(570 bp)克隆到质粒中。具体为:将RSIV核酸进行常规PCR扩增,得到570 bp的扩增产物。从琼脂糖凝胶中回收扩增产物。将回收产物连接到pMD-18-T载体上,转化在大肠杆菌DH5α中,筛选阳性克隆,提取质粒DNA,命名为重组质粒pMD18-T-RSIV,即RSIV标准品。通过核酸分析仪测定质粒的OD260、OD280及其质粒DNA浓度。
2.5. SYBR GREEN I反应体系
以RSIV标准品为模板,将其在ABI 7300荧光PCR仪中进行SYBR Green I扩增。本实验采用的反应体系为:10 μL SYBR® Premix Ex Taq,0.4 μL ROX Reference Dye,0.4 μL上游引物,0.4 μL下游引物,2 μL模板,加6.8 μL DEPC水将反应总体积补齐至20 μL。反应程序为:首先95℃预变性30 s;然后进行95℃变性5 s,60℃退火31 s,并在此步采集荧光信号,40个循环。
2.6. SYBR GREEN I反应条件优化
为了验证模板与引物的结合效率,将重组质粒进行10倍浓度稀释,保证其在该反应体系中 ≤ 100 ng,达到最佳的反应配比。同时设立引物浓度梯度为200~600 nmol/L,以100 nmol/L为单位递增用于确定反应的最佳引物浓度。
2.7. 灵敏度试验
使用全波长紫外可见光分析系统,对提取到的RSIV标准品原液进行浓度测定,结果为4 × 104 pg。并将其进行10倍浓度系列稀释,稀释的浓度分别为:4 × 103 pg、4 × 102 pg、4 × 101 pg、4 × 100 pg、4 × 10−1 pg、4 × 10−2 pg,4 × 10−3 pg。参照已优化好引物浓度的SYBR Green I荧光定量PCR反应体系进行反应,从而确定该方法的检测灵敏度。同时用传统的PCR方法将质粒进行扩增后,将产物用1%琼脂糖凝胶电泳进行观察,电泳结果作为普通PCR的灵敏度,比较2种方法的检测灵敏度。
2.8. 特异性试验
分别将IPNV、IHNV、SVCV、VHSV的cDNA及RSIV标准品为模板,按照优化好的SYBR Green I荧光定量PCR条件进行扩增反应。对其扩增结果进行鉴定,验证该方法是否与其他水生动物病毒存在非特异性交叉反应。
2.9. 重复性实验
在同一次试验中,对6个不同稀释度的阳性质粒进行SYBR Green I荧光定量PCR反应,每个浓度样品做2个重复。记录每次测定的CT值,验证该方法的重复性。
3. 结果与讨论
3.1. 引物浓度的优化结果
从图1中可以看出,当引物浓度为200 nmol/L时,荧光扩增曲线比较圆滑且“S”型较为明显,产生的引物二聚体相对较少,当引物浓度逐渐增加时,反应产生的引物二聚体也随之增加,但是荧光信号并不随着浓度的增加而具有明显的增加,所以综合这两方面的考虑,选择引物浓度为200 nmol/L作为最佳引物浓度。
 1) 200 nmol/L;2) 300 nmol/L;3) 400 nmol/L;4) 500 nmol/L;5) 600 nmol/L
1) 200 nmol/L;2) 300 nmol/L;3) 400 nmol/L;4) 500 nmol/L;5) 600 nmol/L
Figure 1. The influence and optimized result of different concentrations of primers on RSIV-SYBR Green I
图1. 引物浓度对RSIV-SYBR Green I的影响和优化结果
3.2. 灵敏度的测定
将浓度为4 × 104 pg的RSIV标准品原液进行连续10倍梯度系列稀释,构成7个稀释样品,每体系加2 μL模板,按照已优化好的反应条件进行定量PCR反应,得到了标准品模板的SYBR Green I扩增曲线,如图2所示。在实际检测中,以CT值为30为界限,结果显示,模板浓度为4 × 10−2 pg (10−6)的病毒核酸最后出现“S”型扩增曲线,表明该SYBR Green I实时荧光PCR对该RSIV病毒的检测限为0.04 pg,从琼脂糖凝胶电泳(图3)结果显示,普通PCR的检测限为0.4 pg (10−5),比SYBR Green I实时定量PCR的灵敏度低10倍。
 1) 10−1;2) 10−2;3) 10−3;4) 10−4;5) 10−5;6) 10−6;7) 10−7;8) 阴性对照
1) 10−1;2) 10−2;3) 10−3;4) 10−4;5) 10−5;6) 10−6;7) 10−7;8) 阴性对照
Figure 2. Sensitivity of SYBR Green I PCR for detecting RSIV
图2. RSIV SYBR Green I PCR灵敏度检测结果
 M:Maker DL2000;1) 100;2) 10−1;3) 10−2;4) 10−3;5) 10−4;6) 10−5
M:Maker DL2000;1) 100;2) 10−1;3) 10−2;4) 10−3;5) 10−4;6) 10−5
Figure 3. Primer sensitivity electrophoresis of PCR
图3. PCR引物灵敏度电泳图
3.3. 特异性测定
采用针对真鲷虹彩病毒设计的SYBR Green IPCR引物对IPNV、IHNV、SVCV、VHSV四种病毒的cDNA,在相同的反应条件下,进行SYBR Green IPCR检测,如图4所示。在实际检测中,阳性判定标准为30个循环内出现荧光信号。从图中可以看出真鲷虹彩病毒出现了“S”型特异性扩增曲线,其它四种病毒及阴性对照在30个循环左右略微出现了小的扩增曲线,分析其原因,可能是由于SYBR Green I与双链DNA采取的是非特异性结合的方式,使得其能够与模板内所有的dsDNA进行结合,这种结合方式导致的结果可能会产生非特异性扩增、引物二聚体等,这都会形成类似本实验中稍微翘尾情况出现,但这不影响对实验结果的判定。
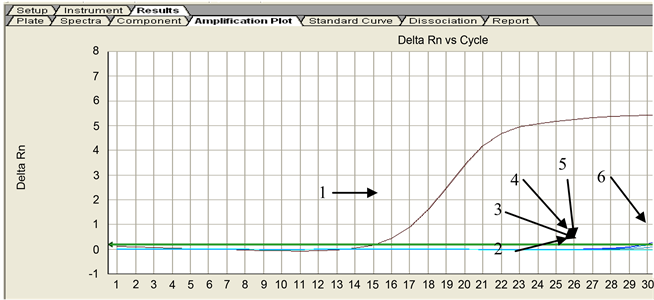 1) RSIV;2) IHNV;3) IPNV;4) SVCV;5) VHSV;6) 阴性对照
1) RSIV;2) IHNV;3) IPNV;4) SVCV;5) VHSV;6) 阴性对照
Figure 4. Specificity of SYBR Green I PCR for detecting RSIV
图4. RSIV SYBR Green I PCR特异性检测结果
3.4. 重复性测定
该重复性试验结果显示,对6个稀释度进行实验,每个稀释度样品的2个平行反应均获得的相应的扩增曲线,能够基本重合(图5)。以上结果表明,本实验所建立的真鲷虹彩病毒SYBR Green I PCR检测方法的重复性较好,基本上可以满足预期的实验效果。
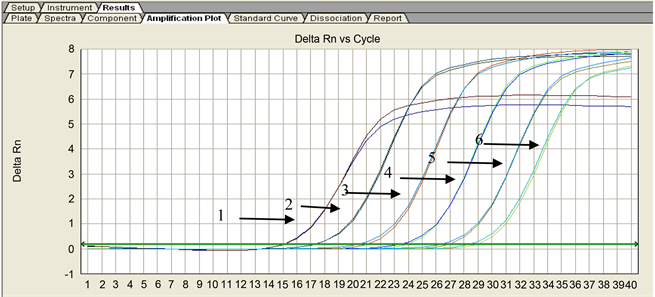 1) 10−1;2) 10−2;3) 10−3;4) 10−4;5) 10−5;6) 10−6
1) 10−1;2) 10−2;3) 10−3;4) 10−4;5) 10−5;6) 10−6
Figure 5. Replicate of SYBR Green I PCR for detecting RSIV
图5. RSIV SYBR Green I PCR重复性检测结果
4. 讨论与结论
真鲷虹彩病毒的防治,目前尚无特效的方法,只有建立快速灵敏的检测方法,对病毒进行早期的诊断,并对养殖环境中的病毒进行监测,才能保持水产养殖业健康发展。
对目前报道的RSIV的检测方法来说,各个方法都有各自的优缺点。电镜观察技术中其样品的制备过程太复杂。细胞培养方法耗时较长,还需要其它方法对阳性结果进行确认。PCR方法灵敏度较低且耗费时间较长。LAMP方法虽然检测的灵敏度高,但是该方法特别容易污染,所以需要研究出一个简单快速、灵敏度高和特异性强的方法来满足检验检疫快速通关的需求。
SYBR Green I方法不需要设计和合成昂贵的探针,操作简便,成本也比较低,在很多行业中均得到了普遍的适用。另外,由于SYBR Green I法无需进行电泳检测、不使用溴化乙锭,充分保障了试验人员的安全,而且在检出时间上,从核酸的提取到反应完成只需要约1.5 h的时间,最多可一次性检测96个样品,大大缩短了样品检测的时间,适合大量样品的快速检测。
本研究建立的RSIV SYBR Green I PCR检测方法具有很强的可实用性。在反应过程中,只需加入上下游引物、模板、DEPC水便可进行反应。在实验中值得注意的是,质粒阳性标准品的制备也是建立SYBR Green I PCR方法的关键环节,标准品的制备保障了验证分析RSIV SYBR Green I PCR检测方法时的稳定性及可靠性。本研究采用自身构建重组质粒作为阳性标准品,最低可以检测到0.04 pg模板量,比用PCR检测灵敏度高出10倍。特异性试验结果显示,该方法对IPNV、IHNV、SVCV、VHSV等其他水生动物病原均无扩增反应,特异性良好,是一种比较实用的鉴别诊断检测方法。重复性试验表明了研究构建的检测方法具有良好的重复性,适用于跨境检疫和动物防疫监督部门对进出口鱼类RSIV的检测和监测,为水产品病原诊断及防控提供了重要的技术手段,对于加强口岸检疫、控制和消灭鱼类疾病将发挥巨大作用。
基金项目
海关总署科研项目(2020HK143)、辽宁省自然科学基金项目(20180551285)。
NOTES
*通讯作者。