1. 引言
肝细胞肝癌(hepatocellular carcinoma, HCC)是世界上最常见的恶性肿瘤之一 [1],其5年生存率小于15%,是我国第二大死因 [2]。微血管侵犯 [3] (microvascular invasion, MVI)指在显微镜下于内皮细胞衬覆的脉管腔内见到癌细胞巢团。既往研究结果 [4] [5] 表明,MVI的存在会明显增加HCC患者术后复发的风险,导致远期生存率显著降低,可作为HCC预后评估的独立诊断因子之一,对于预测存在MVI的HCC患者,可以采用扩大手术切除范围,或消融区域更大的治疗方法 [6]。肝脏CT检查(平扫、三期增强)在临床术前应用广泛,能清晰显示病灶的大小、形态、数目、密度、边缘、血供、出血坏死等情况,已有部分研究 [7] 基于影像征象建立了HCC患者发生MVI的相关列线图预测模型,但联合一般临床资料及影像征象的预测模型有待进一步深入研究。因此,本研究旨在结合HCC患者临床指标及增强CT影像征象,拟筛选出与MVI相关的独立危险因素并构建列线图模型达到术前精准预测是否存在MVI。
2. 资料与方法
2.1. 临床资料
搜集2017年5月至2021年3月期间在我院行肝癌根治术,术后病理证实为HCC的符合纳入、排除标准的患者共160例,其中MVI阳性90例,MVI阴性70例。男134例,女26例,年龄28~85岁,平均年龄(58.04 ± 11.17)岁,乙肝病史133例,有肝硬化病史109例,肝功能Child-Pugh分级:A级108例,B级52例。收集分析的一般临床资料包括年龄、性别及术前1周内检测的甲胎蛋白(AFP)水平(参考值设为400 ng/mL)、血常规、肝肾功能检查及凝血功能指标。
2.2. 纳入标准和排除标准
纳入标准:1) 患者均经手术治疗,并经病理学确诊为HCC;2) 有完整的术前一般临床资料及CT扫描影像资料;3) CT检查与手术间隔时间小于一周。
排除标准:1) 术前有抗肿瘤治疗史;2) 存在其他恶性肿瘤病史。
2.3. CT扫描方法
使用Philips Brilliancei CT 256机器进行扫描。扫描范围上包全膈顶下至双肾下极。在获取前后位定位像后进行腹部平扫,经肘静脉泵注非离子型对比剂碘海醇300 mg/ml,注射方案:1.2~1.5 ml/kg,2.5~3.0 ml/s。扫描方案:监测腹主动脉阈值达150 HU后自动触发增强扫描,分别于8 s、45 s、100 s行动脉期、门静脉期及延迟期扫描。扫描参数:管电压:120 KVp,自动mAs,分别重建层厚为5 mm、1 mm及层间距为5 mm、1 mm的图像。
2.4. CT图像分析
由两名经验丰富的影像诊断医师在不知病理及临床实验室指标的情况下分别对CT图像的肿瘤最大径、肿瘤形态、肿瘤生长方式、包膜、出血坏死、低密度环、病灶周围强化、瘤内动脉显影及病灶强化方式等征象进行分析评估。当存在多发病灶时,选择其中最大者进行分析;由于有研究 [7] 认为影像医师在评估MVI相关征象时一致性较差,故本研究使用协商后的数据进行分析评估。
影像征象定义:1) 肿瘤形态:按照肿瘤边缘是否为光滑弧状,分为规则、不规则;2) 肿瘤生长方式:按照病灶是否突出肝脏轮廓,分为突出肝脏轮廓、不突出肝脏轮廓;3) 肿瘤包膜:动脉期围绕肿瘤边缘的低密度环和门静脉期高密度环,按照包膜情况分为有完整包膜、包膜局部不完整及无包膜3组;4) 瘤内出血坏死:平扫时瘤内出现低密度坏死区或高密度出血区,增强后不强化,分为有瘤内出血坏死和无瘤内出血坏死;5) 低密度环征:动脉晚期或门静脉期肿瘤周围出现的低密度环,部分或完全地将肿瘤包围,分为有低密度环征和无低密度环征;6) 瘤内动脉显影:动脉期肿瘤内持续存在的动脉血管强化表现,分为有瘤内动脉显影和无瘤内动脉显影;7) 病灶周围强化:动脉晚期或者门脉早期病灶周围出现的片状强化,分为有病灶周围强化和无病灶周围强化;8) 肿瘤强化方式:按照是否具有“快进快出”的强化方式,分为典型强化方式和非典型强化方式。
2.5. 病理学分析
由我院经验丰富病理科医师根据原发性肝癌规范化病理诊断指南(2015版) [3] 相关内容合理选择取材部位及数量,对所有患者的病理切片进行镜下检查,判定有无MVI。
2.6. 统计学分析
统计学分析及作图使用R软件(版本4.0.4,https://www.r-project.org/),采用独立样本的t检验分析计量资料;采用卡方(χ2)检验分析分类变量;危险因素的筛选采用先单因素Logistic回归(P < 0.1认为差异具有统计学意义)后多因素Logistic回归分析(P < 0.05认为差异具有统计学意义)。根据筛选的危险因素构建Nomogram评分模型。运用拟合优度检验验证模型的有效性,并采用Bootstrap自抽样法内部验证模型的预测效果,利用校准曲线展示模型的预测能力。
3. 结果
1) 影响HCC患者MVI的临床及CT影像特征的单因素见表1。本研究中共160例HCC患者,MVI阳性组90例(图1),MVI阴性组70例(图2)。MVI阳性组与阴性组之间的实验室检查中仅AFP差异具有统计学意义(P < 0.05);余实验室检查(ALT、TB、CB、ALB、SCR、PLT、PT)及肝功能分级均无统计学意义(P > 0.05);在MVI阳性组中影像特征倾向于更大的直径、肿瘤形态不规则、突出肝脏轮廓、存在低密度环征、病灶周围强化、瘤内动脉显影及更多的病灶。

Table 1. Univariate Logistic regression analysis of MVI clinical and CT imaging features in HCC patients
表1. 影响HCC患者MVI的临床及CT影像特征的单因素Logistic回归分析
 (a)
(a) 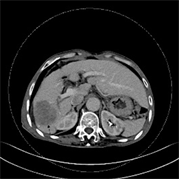 (b)
(b) 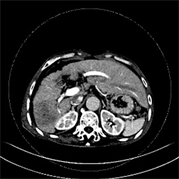 (c)
(c) 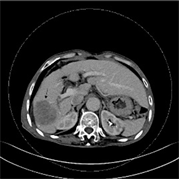 (d)
(d)
Figure 1. (a)~(d) Male, 73 years old, moderately differentiated HCC, MVI(−). (a)~(d) Single lesion with regular shape (arrow); (b)~(d) Atypical “fast-in, fast-out” reinforcement
图1. (a)~(d) 男,73岁,中分化HCC,MVI(−)。(a)~(d) 单发病灶,形态规则(箭);(b)~(d) 非典型“快进快出”式强化
 (a)
(a)  (b)
(b)  (c)
(c) 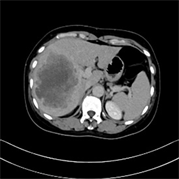 (d)
(d)
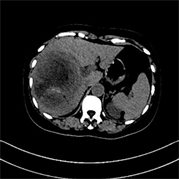
Figure 2. (a)~(d) Female, 57 years old, moderately to poorly differentiated HCC. (a) Irregular lesion with hemorrhagic necrotic area (arrow); (b) Focal intratumoral artery (arrow); (c) Low-density ring (arrow) around the lesion; (a)~(d) Lesions showed typical “fast in, fast out” enhancement
图2. (a)~(d) 女,57岁,中–低分化HCC。(a) 病灶形态不规则,出血坏死区(箭);(b) 病灶瘤内动脉(箭);(c) 病灶周围低密度环(箭);(a)~(d) 病灶呈典型“快进快出”式强化
2) 将单因素分析有统计学意义的因素(P < 0.1)纳入多因素回归分析,影响HCC患者MVI的临床及CT影像特征的多因素Logistic回归结果见表2。

Table 2. Multivariate Logistic regression analysis of MVI clinical and CT imaging features in HCC patients
表2. 影响HCC患者MVI的临床及CT影像特征的多因素Logistic回归分析
3) 因为多数研究 [1] [8] [9] 中认为肿瘤直径是MVI的独立危险因素,故本研究也将其纳入模型中构建的Nomogram模型见图3。拟合优度检验表明模型的拟合情况较好(χ2 = 3.432,自由度为8,P > 0.05)。Bootstrap自抽样法内部验证结果C-index = 0.7025,校正C-index = 0.683。

Figure 3. Rosette model of microvascular invasion in hepatocellular carcinoma. The score of each factor was obtained according to the upper scale corresponding to the factor, and the total score was obtained by adding the scores of each factor. The corresponding probability of MVI in HCC patients could be obtained from the total score downward
图3. 肝细胞肝癌微血管侵犯的列线图模型。根据每个因素对应至上方标尺得到该因素的得分,通过对各项因素得分的相加获得总分,从总分向下对应,可得到HCC患者相对应的发生MVI的概率
4) 肝细胞肝癌微血管侵犯的列线图评分模型的校准曲线见图4。Brier评分为0.217,95%CI:0.193~0.242,Brier评分越接近0表明模型的预测能力越好。
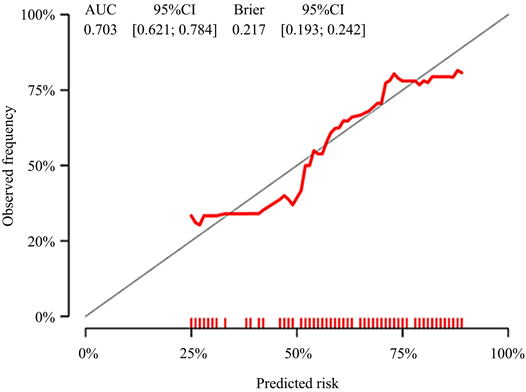
Figure 4. Calibration curve of the rosette scoring model for microvascular invasion of hepatocellular carcinoma. The closer the curve is to the standard curve, the better the prediction ability of the rosette is
图4. 肝细胞肝癌微血管侵犯的列线图评分模型的校准曲线,曲线越贴近标准曲线,说明列线图的预测能力越好
4. 讨论
肝癌存在MVI是HCC患者术后复发和转移的独立预后因素 [1]。然而,MVI是病理诊断,术前预测肝癌是否存在微血管侵犯可以帮助临床医师选择个体化的治疗方案,改善患者的预后。因此,本研究旨在研究分析术前HCC患者的临床资料及影像特征,拟筛选出与MVI相关的独立危险因素并构建可供临床参考的预测MVI的列线图模型。
在本研究结果中一般临床病史无统计学意义,部分研究中 [10] [11] [12] 临床病史亦无意义,可能由于临床病史可能反映患者的全身情况,而影像征象更能反映肿瘤的真实性。本研究单因素分析中,实验室检查仅AFP > 400 ng/mL具有统计学意义,影像征象中肿瘤直径、肿瘤形态不规则、病灶突出肝脏轮廓、存在低密度环征、病灶周围强化、瘤内动脉显影及更多的病灶有统计学意义(P < 0.05),在多因素回归分析中,肿瘤形态不规则及低密度环征是独立危险因素,肿瘤直径并不是其危险因素,但多数研究 [1] [7] [8] 表明直径在预测MVI中有重要意义,是一个不可忽略的因素,肿瘤越大、异质性越强,潜在恶性程度越高,故也将该因素纳入该模型中,最终模型纳入肿瘤直径、肿瘤形态及低密度环征三个特征。
Chou等 [8] 的研究中单结节外生长型和连续多结节型的HCC发生肝内微小转移的风险明显更高,由于在影像上不易区分具体类型,在一定程度上降低了临床适用性,故本研究将肿瘤形态简化为规则和不规则两种,结果与其基本一致。伏旭等 [13]、Shirabe [14] 等研究结果都表明形态不规则的肝癌更易发生MVI及转移。可能由于MVI阳性的肝癌侵袭性更强、各向同性更差,更易侵犯周围组织结构,肿瘤形态表现为不规则。
Segal等 [15] 基于基因组学与影像特征的研究发现瘤内动脉显影及低密度环征(RVI)与MVI高度相关,Lee等 [16] 的研究证实瘤周存在低密度环发生MVI的风险提高5.184倍,本研究结果相仿(OR值为2.432)。低密度环征的具体机制尚未明确,这可能是由于肿瘤肿胀性生长,导致邻近肿瘤边缘的肝组织纤维化和受压,形成低密度环征。
列线图模型直接利用图形推算出某变量的取值,准确预测某结果事件发生的概率,能将 Logistic 回归结果可视化,直观的用于个体危险因素的预测,具有较好的临床适用性。本研究结合Logistic回归分析筛选预测因子并成功建立了预测MVI的模型。该模型包含3个预测因子,拟合优度检验表明模型的拟合情况较好(X2 = 3.67,自由度为8,P > 0.05)。Bootstrap自抽样法内部验证的校正C-index = 0.683,表明结果具有一定可信度及临床应用价值。
但本研究仍有不足:1) 属于单中心回顾性研究,有待于多中心研究及进一步增加样本量及外部验证来证实其准确性;2) 本研究中未纳入与HCC特异性较强的AFP-3、GGT等实验室指标,后续有待进一步深入研究。
5. 总结
综上所述,由肿瘤直径、肿瘤形态及低密度环征三个CT影像征象构建的列线图模型在一定程度上可以预测HCC患者是否存在MVI,对HCC患者的临床治疗决策有一定的指导作用。
NOTES
*通讯作者。