1. 引言
苯甲醛是重要的化工原料,可应用于印染、医药、食品、香料等行业 [1] [2]。目前工业制备苯甲醛的主要方法为甲苯氯化水解法 [3],所得苯甲醛中常含有含氯副产物 [4],很难应用于医药、食品等领域。使用H2O2作为绿色氧化剂选择性氧化苯甲醇 [5] [6] [7] 是制备无氯苯甲醛的一条潜在工艺路线(如反应式(1)所示),但由于缺乏性能优良、成本低廉的催化剂,从而制约了该工艺路线的实际应用。
 (1)
(1)
由于Fe3O4具有磁性且不溶于大多数常见溶剂,可通过外加磁场分离回收和循环利用,常作为载体制备磁性催化剂。近年来有文献报道了Fe3O4可以作为催化剂催化H2O2氧化苯甲醇反应,如Chen等 [8] 使用两步法合成约173 nm的Fe3O4微球,并将其用于催化H2O2选择性氧化苯甲醇的反应,转化率达到53.5%,选择性达到84.9%,可以循环使用7次而不失活性;Xiao等 [9] 合成了环氧氯丙烷改性Fe3O4微球,将得到的催化剂用于催化H2O2选择性氧化苯甲醇的反应,转化率达到36.6%,选择性达到93.5%,使用后的催化剂经NaBH4还原和环氧氯丙烷改性再生后,可以循环使用5次而没有明显的活性损失。
铝是地壳中丰度最高的金属元素,与含贵金属的Fe3O4基催化材料相比,铝改性Fe3O4基催化材料毫无疑问更加经济易得。此外,利用铝–铁协同效应提高Fe3O4的催化性能也曾被报道,如Xiong等 [10] 使用溶剂热法合成了异丙醇铝改性Fe3O4微球,对H2O2选择性氧化苯甲醇的催化性能比空白Fe3O4微球有明显改善(苯甲醛产率:5.6% vs. 43.7%),还原再生后可以循环使用5次。该文通过比较不同铝源对铝改性Fe3O4微球催化性能的影响,发现异丙醇铝为最佳铝源,而以无机铝盐为铝源合成的样品催化性能均不佳。本文利用铝铁的协同效应,以常见廉价易得的无机铝盐取代成本较高的异丙醇铝(以2022年3月8日阿拉丁报价为例,500 g分析纯的九水合硝酸铝和异丙醇铝的报价分别为39元和84元),在保持催化性能的前提下尽量降低铝改性Fe3O4微球的合成成本。本文首先筛选了合适的无机铝源,然后探究了催化剂中的铝添加量和制备工艺对催化性能的影响,最后探索了催化剂的再生循环工艺。
2. 实验部分
2.1. 实验试剂
除Al2(SO4)3∙18H2O购自天津博迪外,其它药品(包括六水合氯化铁、九水合硝酸铝、六水合氯化铝、无水乙酸钠、硫代硫酸钠、乙醇、乙酸乙酯、过氧化氢(30%)、乙二醇和苯甲醇)均购自国药试剂。所有药品均为分析纯试剂。
2.2. 样品的制备
本文铝改性Fe3O4微球记为Fe3O4-Ax-n,Ax代表不同无机铝源(即AC、AS和AN分别表示氯化铝、硫酸铝和硝酸铝),n为铝添加量。以制备Fe3O4-AS-1.0为例,典型的合成步骤为:往60 mL PTFE内衬中依次加入9 mL乙二醇和3.6490 g (13.5 mmol) FeCl3∙6H2O,50℃水浴搅拌至完全溶解,然后加入0.3332 g (0.5 mmol)经过研磨的Al2(SO4)3∙18H2O继续搅拌30 min,再加入3.6010 g (44.0 mmol) NaOAc继续搅拌30 min,最后封装至不锈钢反应釜放入198℃烘箱反应14 h。待反应结束后用冷水骤冷降温得到黑色磁性固体,依次用20 mL EtOH (30℃)、2 × 20 mL去离子水(50℃)、20 mL EtOH (30℃)洗涤,最后磁性分离转移至表面皿,过夜干燥后得到的黑色磁性固体即为Fe3O4-AS-1.0。
以上述合成步骤为基础,本文也考察了改变单一工艺参数(如铝源类型、铝盐颗粒大小、铝添加量、加入顺序)对所得Fe3O4-Ax-n微球的物化性质及催化性能的影响。
2.3. 样品的表征
样品的晶型结构采用X射线粉末衍射仪(XRD)测定(Bruker公司,型号D8),X射线为Cu靶Kα射线,管电压30 kV,管电流20 mA,扫描范围5˚~80˚,扫描速度为0.1˚/s。催化剂尺寸及形貌采用扫描电镜(SEM)进行分析(JEOL公司,型号JSM-5510LV)。样品的元素种类与含量采用能谱仪(EDS)测定(美国阿美泰克公司,型号FALCON60)。
2.4. 苯甲醇选择性氧化实验
在50 mL两口烧瓶中依次加入0.20 g催化剂、8 mL去离子水以及4 mL (40 mmol)苯甲醇,在100℃下搅拌(900 rpm)均匀后,逐滴加入4 mL H2O2 (30%)回流反应30 min后,继续滴加4 mL H2O2 (30%)于100℃回流反应60 min。反应结束后的产物经乙酸乙酯(10 mL)萃取和饱和Na2S2O3水溶液(2 × 10 mL)洗涤后,进行气相色谱分析(进样口温度为250℃,柱箱温度为200℃,FID检测器温度为300℃,AE.FFAP (30 m × 0.32 mm × 0.5 mm)毛细管色谱柱,检测时间为30 min),分别根据式(2)-式(4)来计算苯甲醇(BzOH)的转化率、苯甲醛(BzH)的选择性和产率,其中n0,BzOH和ΔnBzOH分别为BzOH的初始物质的量和转化物质的量,nBzH为生成BzH的物质的量。
(2)
(3)
(4)
2.5. 催化剂再生和循环使用
催化剂的再生:将催化反应后的Fe3O4-AS-1.0经10 mL无水乙醇和10 mL去离子水洗涤过后,连带搅拌子移至60 mL PTFE内衬中,然后加入9 mL乙二醇和0.1112 g (0.17 mmol)经过研磨的Al2(SO4)3∙18H2O搅拌30 min,最后封装至不锈钢反应釜放入198℃烘箱反应14 h。待反应结束后得到黑色磁性固体,依次用5 mL EtOH (30℃)、5 mL去离子水(30℃)洗涤,最后磁性分离转移至表面皿后干燥得到黑色磁性固体。
催化剂的循环使用:再生后的催化剂依照2.4节苯甲醇选择性氧化实验进行循环使用。
3. 结果与讨论
3.1. 不同无机铝源对Fe3O4-Ax-1.0催化性能的影响
三种不同无机铝盐改性Fe3O4催化H2O2选择性氧化苯甲醇制备苯甲醛的结果见表1,对应的有机相的气相色谱分析结果见图1。由表1可以看出,只要添加了铝改性剂,无论铝盐中的阴离子类型,都会使得Fe3O4对苯甲醇的催化氧化性能有较大提高,表明了加入无机铝后确实能促进Fe3O4活化H2O2氧化苯甲醇,与文献 [10] 中观察到的铝铁协同效应一致。通过比较不同无机铝源制备的铝改性Fe3O4的催化性能,发现以Al2(SO4)3∙18H2O为铝源制备的Fe3O4-AS-1.0样品催化性能最好(Fe3O4-AS-1.0 > Fe3O4-AC-1.0 > Fe3O4-AN-1.0),以Fe3O4-AS-1.0作催化剂时苯甲醛的产率为41.2%,故而在后续实验中使用Al2(SO4)3∙18H2O作为铝改性剂进一步研究。

Table 1. Comparison of catalytic properties of Fe3O4-AX-1.0 (Ax = AC, AN and AS)
表1. Fe3O4-Ax-1.0 (Ax = AC, AN和AS)的催化性能对比
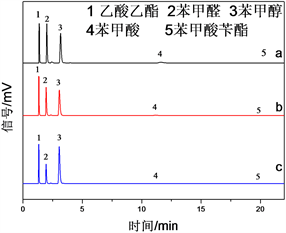
Figure 1. Gas chromatograms of organic phases after selective oxidation of benzyl alcohol with H2O2 over Fe3O4-Ax-1.0. Ax is AS (a), AN (b) and AC (c)
图1. Fe3O4-Ax-1.0活化H2O2选择性氧化苯甲醇后有机相的气相色谱图。Ax分别为AS (a),AN (b)和AC (c)
3.2. 不同铝添加量对Fe3O4-AS-n (n = 0, 1.0, 1.5, 2.0, 3.0)催化性能的影响
由图2可以看出,以硫酸铝为铝源,在n = 0~1.0范围内随着铝添加量增加,苯甲醛的选择性基本没有变化,但苯甲醇的转化率显著提升。继续提高铝添加量(n = 1.0~3.0),对苯甲醇的转化率和苯甲醛的选择性都没有明显改变(CBzOH为43.7%~47.5%,SBzH为84.2%~87.1%),原因可能是在铝添加量为1.0 mmol时,Fe3O4微球上铝负载量已经达到了饱和,因此继续增加铝添加量不能进一步提高铝的负载量或改进样品的催化性能。而在加入了大量铝源后(n = 3.0),发现制得的Fe3O4-AS-3.0样品的磁性明显减弱,且在苯甲醇氧化反应过程中发生暴沸现象,反应结束后回收到的固体极少,说明Fe3O4-AS-3.0样品在反应过程中被大量损耗,原因可能是过多铝源在催化剂表面生成了铝氧化物,使Fe3O4-AS-3.0微球磁性变差;同时表面铝氧化物在100℃下容易与H2O2发生反应,导致Fe3O4-AS-3.0的稳定性变差。
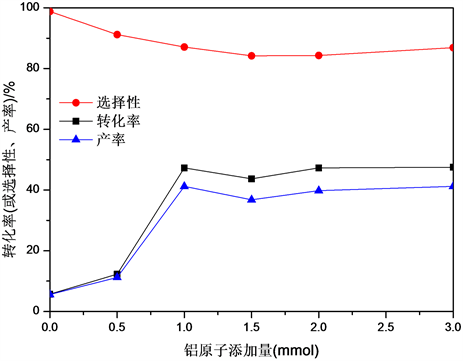
Figure 2. Effect of aluminum content on the catalytic performance of Fe3O4-AS-n
图2. 不同铝添加量对Fe3O4-AS-n催化性能的影响
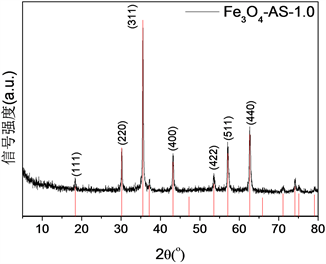
Figure 3. XRD pattern of Fe3O4-AS-1.0. Shown at the bottom is standard XRD pattern of Fe3O4 (PDF #65-3107)
图3. Fe3O4-AS-1.0的XRD图谱。下方柱形图为Fe3O4的标准XRD谱(PDF #65-3107)
3.3. Fe3O4-AS-1.0微球的表征
由XRD (见图3)可看出各个特征峰均与Fe3O4标准卡片PDF#65-3107的特征峰相吻合,7个主要特征峰(111)、(220)、(311)、(400)、(422)、(511)和(440)对应的2θ角分别为18.3˚、30.1˚、35.5˚、43.1˚、53.5˚、57.0˚和62.6˚。该XRD图谱表明Fe3O4-AS-1.0具有立方反尖晶石结构,结晶度高且无杂质相。由SEM (图4(a))可以看出Fe3O4-AS-1.0颗粒形貌均为球形,但是粒径分布较宽,有一定团聚。经过测量SEM图中100个颗粒的直径尺寸,计算得到Fe3O4-AS-1.0颗粒的平均粒径为0.55 ± 0.12 μm (图4(b))。通过EDS测量了Fe3O4-AS-1.0颗粒的元素组成及含量(图4(c)和表2),样品主要含有Fe、O、Al和C等元素,Fe/Al原子比为7.4。在样品的两个不同区域检测到铝含量分别为3.10 wt%和4.44 wt%,铝平均含量为3.77 wt%;在样品中检测到碳元素含量为3.83 wt%,可能是因为溶剂热反应中所使用的乙二醇及其衍生物吸附在颗粒表面造成的。

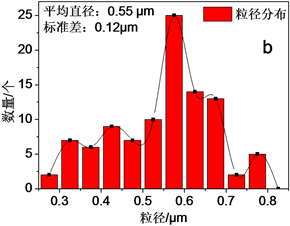
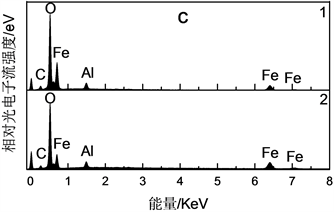
Figure 4. SEM (a), particle size distribution (b) and EDS (c) of Fe3O4-AS-1.0
图4. Fe3O4-AS-1.0的SEM图(a)、粒径分布图(b)与EDS图(c)

Table 2. Elemental composition of Fe3O4-AS-1.0 measured by EDS (weight percentage content)
表2. EDS测定Fe3O4-AS-1.0的元素组成(质量百分含量)
3.4. 其它工艺参数(如铝源研磨、加入顺序)对催化剂的制备及性能影响
在早期重复制备Fe3O4-AS-1.0时,发现在黑色的铝改性Fe3O4颗粒中,有时会有白色颗粒混在其中(图5(b)),这种白色固体杂质无法用去离子水或无水乙醇洗脱,根据所使用的原料推断白色固体杂质应为铝氧化物。该白色固体杂质在所制备的铝改性Fe3O4样品中时有时无,可能与所使用的原料Al2(SO4)3∙18H2O颗粒大小不一有关(如图5(a)所示)。在制备Fe3O4的反应体系中乙酸钠水解会产生OH−,引发Fe3+聚合沉降 [9],此时整个体系变得粘稠,使得加入的Al2(SO4)3∙18H2O更难于搅拌均匀并溶解于乙二醇中。

Figure 5. (a) Al2(SO4)3∙18H2O white particles; (b) Fe3O4-AS-1.0 samples were occasionally mixed with white particles
图5. (a) Al2(SO4)3∙18H2O白色颗粒;(b) Fe3O4-AS-1.0样品中偶尔混有白色颗粒
我们在50℃时考察了研磨对Al2(SO4)3∙18H2O颗粒在乙二醇中的溶解情况的影响,发现0.3332 g经研磨的Al2(SO4)3∙18H2O颗粒在搅拌12 min内已完全溶解于9 mL乙二醇中,而未研磨过的对照组在搅拌30 min后,仍能观察到部分较大的Al2(SO4)3∙18H2O颗粒未能溶于乙二醇中。上述溶解实验表明,在每次制备Fe3O4-AS-1.0时,由于未研磨的Al2(SO4)3∙18H2O在乙二醇中的溶解状态不同,使得部分未溶解的Al2(SO4)3∙18H2O颗粒形成团聚体,这些团聚的Al2(SO4)3∙18H2O颗粒由于其粒径过大不能掺杂到Fe3O4中,而形成铝氧化物杂质,故而可以观察到所制备的样品中偶尔有白色固体颗粒混入,使得Fe3O4-AS-1.0的重复性不佳。
根据文献报道,加入乙酸钠作为碱源沉降铁离子是乙二醇法合成Fe3O4的必要步骤 [11] [12] [13],本实验室前期已就碱源的种类与用量对乙二醇法合成Fe3O4的影响做过考察 [14],故而在本论文中对该因素没有进一步探究。为了改进合成Fe3O4-AS-1.0的重复性,我们分别考察了投料顺序与铝源的预处理两个单因素对产物性能的影响,相应的对比样品分别为:1) Fe3O4-AS-1.0a:将无水乙酸钠先于研磨过的Al2(SO4)3∙18H2O加入乙二醇中;2) Fe3O4-AS-1.0b:使用没有研磨的Al2(SO4)3∙18H2O做铝源。对比图6(a)和图6(c)表明在加入乙酸钠前加入Al2(SO4)3∙18H2O,可以显著提高铝改性Fe3O4颗粒的催化性能和重现性,如分三批制备的不同Fe3O4-AS-1.0样品催化目标反应苯甲醇的转化率为45.5% ± 0.9%,苯甲醛的选择性为85.5% ± 0.6% (图6(c));而三批Fe3O4-AS-1.0a样品催化目标反应的转化率和选择性分别为34.7% ± 5.8%和87.8% ± 5.3% (图6(a))。在加入Al2(SO4)3∙18H2O前加入乙酸钠,铁盐已经发生了部分水解和聚合,形成了较大团聚体,不利于后续加入的铝源改性掺杂,从而影响Fe3O4-AS-1.0a的催化性能和重现性。类似地,对比图6(b)和图6(c)表明由于不同大小Al2(SO4)3∙18H2O颗粒在乙二醇中的溶解性相差较大,使用未研磨过的Al2(SO4)3∙18H2O盐作为铝源不利于提升铝改性Fe3O4颗粒的催化性能和重现性,如两批Fe3O4-AS-1.0b样品催化目标反应的转化率和选择性分别为40.3% ± 2.5%和82.2% ± 1.5% (图6(b))。通过上述工艺优化,我们最终得到了制备Fe3O4-AS-1.0的重复性好的合成工艺,核心是首先将FeCl3∙6H2O和经过研磨的Al2(SO4)3∙18H2O溶解在乙二醇中,然后加入碱源NaOAc并搅拌均匀,最后在198℃反应14 h后即可得到重复性较好的Fe3O4-AS-1.0微球(详见第2.2节)。
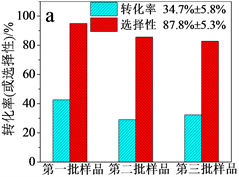
Figure 6. Reproducibility of Fe3O4-AS-1.0 samples prepared according to different processes (a) Fe3O4-AS-1.0a; (b) Fe3O4- AS-1.0b and (c) Fe3O4-AS-1.0
图6. 不同工艺制备的Fe3O4-AS-1.0样品催化苯甲醇选择性氧化的再现性实验 (a) Fe3O4-AS-1.0a;(b) Fe3O4-AS-1.0b和 (c) Fe3O4-AS-1.0
3.5. Fe3O4-AS-1.0微球的再生和循环使用性能
文献 [15] [16] [17] 报道Fe2+为活化H2O2的活性位点,且在Fenton反应中涉及Fe2+与Fe3+的循环(如式5和式6)。
(5)
(6)
本文采用乙二醇还原补铝法再生Fe3O4-AS-1.0催化剂。在乙二醇还原补铝操作过程中(见实验方法2.5节),乙二醇在198℃时可以作为还原剂 [18] [19],将Fe3O4-AS-1.0颗粒表面部分Fe3+还原成Fe2+;同时铝盐(如Al2(SO4)3∙18H2O)通过与Fe3O4-AS-1.0颗粒的表面羟基相互作用(如脱水缩合等过程)而沉积或嫁接在颗粒表面,补充了表面流失的铝。由图7可看出,使用乙二醇还原补铝法可以有效再生Fe3O4-AS-1.0催化剂。经该方法再生后的催化剂可以循环使用5次而保持原有催化性能(苯甲醇的转化率44.2%~50.3%,苯甲醛的选择性80.0%~85.9%)。通过Fe3O4-AS-1.0的再生循环实验,也再次表明了铝–铁协同效应可以提升空白Fe3O4微球的催化性能。
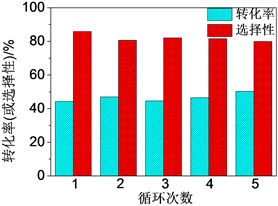
Figure 7. Recycling performance of Fe3O4-AS-1.0 after regeneration
图7. 再生后Fe3O4-AS-1.0的循环使用性能
分别对新制备的Fe3O4-AS-1.0 (见3.3)、反应后的Fe3O4-AS-1.0和乙二醇还原补铝法再生的Fe3O4-AS-1.0进行SEM表征(见图8),发现新鲜催化剂的颗粒形貌经反应后并没有明显改变,仍然维持球状,未发现明显的结构被破坏迹象,说明反应后Fe3O4-AS-1.0的失活并不是结构破坏所造成的。类似地,Fe3O4-AS-1.0颗粒的微球形貌经过再生处理后也没有明显变化。

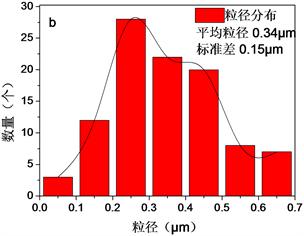

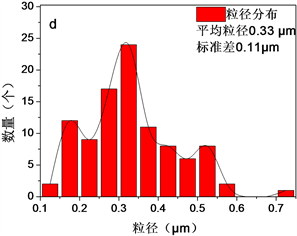
Figure 8. SEM and particle size distribution of Fe3O4-AS-1.0 particles. (a) and (b) After reaction; (c) and (d) After regeneration
图8. Fe3O4-AS-1.0颗粒的SEM及对应的粒径分布图。(a)、(b) 反应后;(c)、(d) 再生后
分别对使用过的和经过再生后的Fe3O4-AS-1.0进行EDS表征(图9和表3),发现再生后铝含量明显提高。Fe3O4-AS-1.0经催化反应后铝含量为2.33 wt% (对应Fe/Al原子比为14.5),而再生后铝含量提高至4.14 wt% (对应Fe/Al原子比为7.4,与反应前Fe3O4-AS-1.0的Fe/Al原子比相同)。经过乙二醇还原补铝再生后Fe3O4-AS-1.0的活性与新制Fe3O4-AS-1.0相当(见图7),而仅通过NaBH4还原再生(将反应后的Fe3O4-AS-1.0颗粒和10 mL NaBH4 (0.3M)溶液在40℃下反应30 min),Fe3O4-AS-1.0的活性仅恢复至BzOH转化率15.1% (与空白Fe3O4微球上BzOH转化率5.7%稍高),由此表明Fe3O4-AS-1.0的失活不仅与表面Fe2+的氧化有关,更与反应过程中表面铝流失有关。通过乙二醇还原补铝法再生Fe3O4-AS-1.0,不仅可以促进表面Fe2+的再生,而且铝盐(如Al2(SO4)3∙18H2O)通过与颗粒表面羟基相互作用(如吸附和脱水等过程),可沉积或嫁接在颗粒表面,补充了表面流失铝,使得催化剂再生。

Table 3. Elemental composition of Fe3O4-AS-1.0 samples measured by EDS
表3. EDS测量不同Fe3O4-AS-1.0样品的元素组成
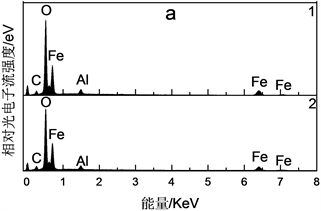
Figure 9. EDS spectra of different Fe3O4-AS-1.0 samples (a) After reaction; (b) After regeneration
图9. 不同Fe3O4-AS-1.0样品的EDS图谱。(a) 催化反应后;(b) 再生后
4. 结论
1) 以常见廉价的无机铝盐为铝源,使用溶剂热法在乙二醇中成功合成了铝原位改性Fe3O4磁性微球,并将其应用于活化H2O2选择性氧化苯甲醇制备高质量无氯苯甲醛,结果表明铝改性可以明显提高Fe3O4微球的催化活性。通过筛选无机铝源的类型、添加量及加料顺序,发现以Al2(SO4)3∙18H2O为铝源、铝含量为3.77 wt% (对应Fe/Al比为7.4)、在加入碱源前加入铝源为工艺制备的铝改性Fe3O4微球(记为Fe3O4-AS-1.0)的催化性能和重现性均最好,苯甲醇的转化率和苯甲醛的产率分别为47.3%和41.2% (在空白Fe3O4微球上的对应值分别为5.7%和5.6%)。
2) 经过乙二醇还原补铝再生后,Fe3O4-AS-1.0磁性微球至少可以循环使用5次,催化性能没有明显损失(苯甲醇的转化率为44.2%~50.3%,苯甲醛的选择性80.0%~85.9%),表明Fe3O4-AS-1.0失活与表面铝流失与Fe2+氧化密切相关。
NOTES
*通讯作者。