1. 引言
随着能源危机和环境问题的日益严重,人们越来越迫切寻找可持续的能源来作为传统化石燃料的替代品。氢气由于其较高的能量密度和绿色环保的特点,被认为是一种很有前途清洁能源 [1] [2] [3]。在众多的制氢方法中,电催化分解水因为其成本低、能量转换率高的特点,广泛受到了人们的关注 [4]。通常来说,水分解包括两个半反应,分别是析氧反应(OER)和析氢反应(HER) [5]。到目前为止,贵金属铱(Ir)基电催化剂和铂(Pt)基电催化剂分别是OER和HER电催化剂的基准 [6] [7]。但是Ir和Pt的高成本和稀缺性大大限制了它们在碱性水分解中的广泛应用 [8] [9]。
钴(Co)基电催化剂因为其储量大,性能良好,价格低廉等特点,已经被当成了水分解常用的催化剂。许多研究将Co基复合物作为OER或者HER的催化剂,这些催化剂的实际应用需要将其生长在电极材料上 [10]。然而,这种复合物的合成问题仍然是一项具有挑战性的任务。此外,这类催化剂通常存在过电势过大或者是稳定性较低的问题 [11]。因此,近年来的研究热点主要集中在Co基氢氧化物催化剂的开发上 [12] [13]。层状氢氧化物是替代贵金属催化剂的理想材料之一。通过引入具有中等电负性的Ru,Au等元素,可以进一步提高层状氢氧化物的OER性能,并在OER过程中作为电子的储存区来提供和接收电子 [14] [15]。
层状材料因其独特的性能和潜在的应用价值而受到广泛关注。人们普遍认为层状材料可以通过特殊的卷曲机制形成管状结构。各种层状材料,如碳纳米管、氮化硼、过渡金属化合硫化物等,都可以卷曲形成管状结构 [16] [17]。尤其值得一提的是,研究人员还发现了内部中空的锥形或角形结构,例如碳和氮化硼 [18] [19] [20]。由于独特的锥状特性,纳米锥可能具有特殊的电子、机械和场发射特性。然而,除了碳纳米管和氮化硼体系之外,很少有层状材料卷曲形成的锥形结构的报道。所以,锥状结构对层状氢氧化物来说是个新颖而独特的结构。
本实验采用共沉淀法制备了钌掺杂的氢氧化钴纳米锥(CoRu氢氧化物纳米锥)。通过调节RuCl3的添加量,制备不同Ru掺入量的CoRu氢氧化物纳米锥。随着Ru掺入量的增大,纳米锥的形貌会被破坏。在保持形貌的前提下,Ru的添加量最大为10%,同时也得到了最好的OER性能,在10 mA·cm−2电流密度下,过电势仅为260 mV。对于HER性能,Ru的掺入量起主要作用,添加量为30%时达到最好的HER性能。在10 mA·cm−2电流密度下,Ru的掺入可以使过电势从516 mV降低为230 mV。
2. 实验部分
2.1. 材料和试剂
六水合氯化钴(CoCl2·6H2O,AR,国药集团化学试剂有限公司)、十二烷基硫酸钠(SDS,AR,日本和光纯药株式会社)、尿素(Urea,AR,日本和光纯药株式会社)、水合氯化钌(RuCl3·xH2O,AR,阿拉丁试剂有限公司)、萘酚溶液(nafion D-521,5% wt%,阿法埃莎化学有限公司)、碳纸(东丽)、氢氧化钾(KOH,AR,国药集团股份有限公司)、无水乙醇(湖南汇虹试剂有限公司)。所有的化学品都是直接使用,没有进一步纯化,去离子水由实验室超纯水机生产。
2.2. 钴钌氢氧化物纳米锥的制备
本文用共沉淀法一步合成不同Ru含量的CoRu氢氧化物纳米锥。将总量为2.5 mmol的氯化钴(CoCl2·6H2O)和氯化钌(RuCl3·xH2O)、6.25 mmol十二烷基硫酸钠(SDS)和17.5 mmol尿素(Urea)加入三口烧瓶中,加入250 mL去离子水溶解。控制氯化钌的加入比例分别为5%,10%,20%和30%,探究掺入量对氢氧化物纳米锥形貌和性能的影响。将溶解反应物后的烧瓶放入油浴锅中,在氮气保护的状态下,在110℃加热并搅拌8小时。得到的产物离心后用乙醇和去离子水清洗数次,在60℃烘箱里干燥8小时,即得到CoRu氢氧化物纳米锥粉末。
2.3. 材料的结构表征
样品的结构和组成用X射线衍射仪(XRD)表征。用Cu Kα源(λ = 1.54178 Å)的X射线衍射仪(Rigaku Miniflex 600),在40 kV/15 mA条件下采集样品的XRD图谱。XRD的扫描范围为2˚到80˚,扫描速率为2˚/min。扫描电子显微镜(SEM, Tescan Mira3)用于表征样品的形貌特征,将样品粉末分散在无水乙醇中,超声10分钟使样品更好的分散,之后滴在硅片上,烘干后贴在导电胶上,再经过喷铂处理增加导电性,以便观察形貌。在FEI Tecnai G2 F20透射电子显微镜上,在200 kV加速电压下进行了形貌、高分辨 (HRTEM)、选区电子衍射(SAED)和高角度环形暗场能量色散X射线能谱(HAADF-STEM-EDS)分析。制样方法也是将样品粉末分散在无水乙醇中,超声后滴在铜网上,最后直接放入透射电子显微镜中抽真空测试。样品的表面价态信息是用Thermo Scientific K-Alpha光谱仪采集X射线光电子能谱(XPS)信号。所有测试得到的能谱都经过了在284.8 eV处的C1s峰矫正。
2.4. 电化学性能测试
本文中所有电化学测试均在CHI 760E电化学工作站进行。电解液为1.0 M KOH水溶液(pH值约为13.5)。OER和HER测试均在三电极体系中进行,其中石墨棒作为对电极,Hg/HgO电极作为参比电极,负载催化剂面积为1 × 1 cm2的碳纸作为工作电极。工作电极制备方法是将5 mg催化剂分散在1000μL水和乙醇的混合溶液中(体积比1:1),加入10 μL的5 wt% Nafion溶液。将催化剂油墨超声处理30 min后,在室温下剧烈搅拌6 ~ 12 h,形成均匀的油墨。将制备好的催化剂油墨取100 μL滴在面积为1 × 1 cm2的碳纸上,在60℃干燥后即得到工作电极,工作电极上催化剂的量约为0.5 mg·cm−2。所有电位均相对于可逆氢电极(RHE)进行校准,其公式如(1)所示:
(1)
首先采用循环伏安法(CV)预处理来激活工作电极。线性扫描伏安测试(LSV)在5 mV·s−1的扫描速率下进行,并且采用95%的iR补偿校正。根据LSV曲线可以得到对应的过电位(η),其中OER和HER过电位分别用公式(2)和(3)得到:
(2)
(3)
塔菲尔(Tafel)斜率是从相应的极化曲线(过电位(η)与电流密度对数(log|j|)的关系曲线)获得的,如公式(4)所示:
(4)
其中的斜率b即表示塔菲尔斜率。电化学阻抗谱(EIS)的频率范围为105 Hz至0.1 Hz,振幅为5 mV,OER测试电压是在0.65 V (vs. Hg/HgO)。电化学活性面积(ECSA)是通过在扫描速度为20、40、60、80、100 mV·s−1下的CV测试得到,扫描电压范围选取的原则是没有法拉第电流的区间。OER测试中电压范围为0.2 V至0.25 V (vs. Hg/HgO)。通过绘制不同扫描速率的中点处充放电电流密度曲线(Δj = ja − jc, ja和jc分别为电压区间终点处阳极和阴极的电流密度),拟合出曲线的斜率,斜率为双层电容Cdl的两倍,以此估算出Cdl,这可以用来表示ECSA。
3. 结果与讨论
3.1. 材料的形貌与结构表征

Figure 1. XRD patterns of CoRu hydroxide nanomaterials with different Ru additions
图1. 不同Ru添加量的CoRu氢氧化物纳米材料的XRD图谱
首先,用XRD测试表征合成材料的组成与结构特征,得到的不同Ru含量的CoRu氢氧化物纳米锥的XRD图谱如图1所示。当没有Ru加入时,XRD的结构为典型的具有八面体与四面体配位的α相氢氧化钴纳米锥。XRD图谱中一系列的(00l)衍射峰,表明了氢氧化物纳米锥是沿着c轴优先取向的层状结构 [21]。其中(001)峰是氢氧化物纳米锥的层间峰,氢氧化钴纳米锥的层间峰对应的层间距为2.4 nm,结合之前的研究可以得出该氢氧化物纳米锥为DS−插层的纳米结构 [17]。随着Ru的掺入,可以看到(001)衍射峰向低角度移动,表明层间距逐渐扩大,这是因为Ru原子的半径比Co原子大,导致CoRu氢氧化物纳米锥的层间距大于单Co氢氧化物纳米锥。同时,Ru掺入后XRD的衍射峰基本形状没有变化,表明Ru掺入了氢氧化物纳米锥的晶格中。当Ru的添加量为5%和10%时,层状氢氧化物纳米锥的结构可以很好地保持,但是当添加量增加为20%时,锥状结构被破坏。当Ru的添加量为30%时,纳米锥的结构被完全破坏,材料转变为无定形态,表明Ru的掺入是对形核和结晶有一定影响。
制备的CoRu氢氧化物纳米锥的形貌结构用扫描电子显微镜(SEM)进行表征。图2是不同Ru添加量的CoRu氢氧化物纳米材料的SEM图。不加入Ru时,氢氧化钴纳米锥是形貌均一的、内部中空的纳米锥结构。当Ru的添加量为5%时,纳米锥的形貌还可以很好的保持,当添加量为10%时,纳米锥的形貌基本上还可以保持。但是当添加量继续增加到20%时,如图2(d)所示,纳米锥的形貌很难维持。当Ru的添加量为30%时,纳米锥的形貌完全被破坏。SEM的测试结果与XRD的结果一致,表明了Ru的掺入对形貌和结构都有一定的影响,当添加量太多时,锥的形貌和结构不能保持。然而,Ru的添加并不能完全掺入晶格中,根据SEM的能量色散X射线光谱(EDS)可以测得各元素的含量,其结果如表1所示。当Ru的添加量为5%时,实际掺入量只有0.2%,说明Ru只是微量掺入。同样地,当Ru的添加量为10%时,Ru的实际含量为1.5%,添加量增加到20%和30%时,形貌不能保持,反而实际含量大大增高。表明Ru的掺入量过大,破坏了纳米锥的微观结构,所以不能保持纳米锥的形貌,Ru和Co共同沉淀生成CoRu氢氧化物。

Figure 2. SEM of CoRu hydroxide nanomaterials with different Ru additions (a) 0 Ru; (b) 5% Ru; (c) 10% Ru; (d) 20% Ru; (e) 30% Ru
图2. 不同Ru添加量的CoRu氢氧化物纳米材料的扫描图(a) 0 Ru;(b) 5% Ru;(c) 10% Ru;(d) 20% Ru;(e) 30% Ru

Table 1. EDS results of CoRu hydroxide nanomaterials with different Ru additions
表1. 不同Ru添加量的CoRu氢氧化物纳米材料的EDS能谱结果
图3(a)为Co-10%Ru氢氧化物纳米锥的透射电子显微镜(TEM)图片。可以清晰的看出,制备的氢氧化物纳米锥是内部中空的锥状结构。纳米锥的底部直径约为2 μm,长度可达6 μm,与SEM结果相符合。从图3(a)中圈出的部分进行高分辨透射电子显微镜(HRTEM)测试,如图3(b)所示,可以清晰的看到层状结构,层间距测量为2.56 nm,与XRD结果一致。图3(c)中的选区电子衍射(SAED)图像可以被标记为晶格常数为0.31 nm的六方晶系平面内或者[001]晶带轴的衍射圆环。图3(d)是单个氢氧化物纳米锥的高角环形暗场像–扫描透射电子显微镜(HAADF-STEM)图像和对应的元素分布图,它清楚地显示了Co、Ru、O和S的均分分布,其中S的存在是因为DS−离子的插层,进一步表明了Ru掺入到了氢氧化钴纳米锥的晶格中。
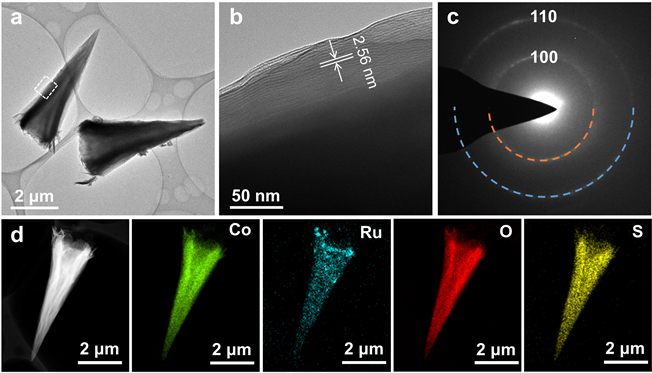
Figure 3. (a) TEM; (b) HRTEM; (c) SAED images; (d) HAADF-STEM and corresponding mapping spectrum images of Co-10% Ru hydroxide nanocones
图3. Co-10% Ru氢氧化物纳米锥的 (a) TEM;(b) HRTEM;(c) SAED图像;(d) HAADF-STEM及其对应的元素能谱图像
3.2. 元素价态分析
为了深入了解CoRu氢氧化物纳米锥的表面化学组成和价态,进行了X射线光电子能谱(XPS)测试,其结果如图4所示。图4(a)是XPS的全谱图,从图中可以看到Co 2p、O 1s、Ru 3p、Ru 3d和C 1s的峰,其中C 1s的峰来自于对照的环境碳的特征峰。Ru的特征峰不明显,是因为Ru含量低于5%,在测试时不易于被检测到。对于Co-10% Ru氢氧化物纳米锥,在Co 2p1/2和Co 2p3/2的结合能分别为797.12 eV和781.36 eV的两个峰是Co2+的特征峰,同时伴随两个显著的振荡卫星峰(785.37 eV和802.93 eV),和文献报道的Co2+相符合 [22] [23]。另外,根据图4(c)中的Ru 3p高分辨光谱发现,Ru 3p图谱中位于464.42 eV和486.32 eV的峰分别是Ru 3p3/2和Ru 3p1/2轨道的特征峰,属于Ru3+物种,表明CoRu氢氧化物纳米锥中Ru处于+3价的氧化态 [24] [25]。图4(d)显示了Co-10% Ru氢氧化物纳米锥的O 1s光谱,有两个特征峰。其中位于531.67 eV处的特征峰属于M-O-H (M表示金属原子Co和Ru,O代表氧原子,H代表氢原子),位于533.6 eV处的特征峰属于M-O-M,这是由于表面氧化产生了晶格氧 [26] [27] [28]。

Figure 4. XPS spectra of Co-10% Ru hydroxide nanocones (a) survey spectrum; (b) Co 2p; (c) Ru 3p; (d) O 1s
图4. Co-10% Ru氢氧化物纳米锥的XPS谱图(a)全谱;(b) Co 2p;(c) Ru 3p;(d) O 1s
3.3. 析氧性能测试
在1 M KOH中,用三电极体系对制备的氢氧化物催化剂的OER活性进行了测试。工作电极采用工作面积为1 × 1 cm2的碳纸(催化剂负载量为0.5 mg),参比电极为氧化汞电极,对电极为碳棒。图5(a)是在5 mV·s−1的扫描速度下,不同Ru掺入量的氢氧化物纳米材料的极化曲线。由曲线可知,氢氧化钴纳米锥的性能最差,在10 mA·cm−2的电流密度下,电极电势为1.589 V。随着Ru掺入量的增加,OER性能逐渐提高,10% Ru添加量的氢氧化钴纳米锥性能最好,在10 mA·cm−2的电流密度下,电极电势只有1.49 V。然而,随着Ru添加量的继续增加,OER性能反而下降。由图5(b)可知,Co-10% Ru氢氧化物纳米锥过电势最低,为260 mV,优于Co-5% Ru氢氧化物纳米锥(279 mV),Co-20% Ru氢氧化物(337 mV),Co-30% Ru氢氧化物(310 mV),其中氢氧化钴纳米锥的性能最差,过电势达到了359 mV。因此,Ru的掺入有利于OER性能的提高。然而,掺入量过大破坏了纳米锥的形貌时,OER性能反而下降,表明锥状形貌对OER性能优决定性影响。塔菲尔斜率是评价电催化性能的重要动力学参数,塔菲尔斜率越低,则电催化速率随电位的增加越快。如图5(c)所示,Co-10% Ru氢氧化物纳米锥是一种高效的OER电催化剂,塔菲尔斜率仅为68.16 mV·dec−1,而氢氧化钴纳米锥、Co-5% Ru氢氧化物纳米锥、Co-20% Ru氢氧化物和Co-30% Ru氢氧化物分别为73.41、87.73、92.48和98 mV·dec−1。此外,Co-10% Ru氢氧化物纳米锥还具有优异的持久性,在10 mA·cm−2下进行计时电位(CP)测试,如图5(d)所示,25小时后,性能仅只有微弱的衰减,表明了Co-10% Ru氢氧化物纳米锥性能的稳定。

Figure 5. OER performance of hydroxide: (a) LSV curve; (b) comparison of overpotential at 10 mA·cm−2; (c) tafel slope; (d) CP curve of Co-10% Ru hydroxide nanocones at 10 mA·cm−2
图5. 氢氧化物的OER性能:(a) LSV曲线;(b) 10 mA·cm−2电流密度下的过电势比较;(c) 塔菲尔斜率;(d) 10 mA·cm−2电流密度下Co-10% Ru氢氧化物纳米锥的计时电位曲线
采用电化学阻抗谱(EIS)技术研究了电子转移效率。图6(a)为测试得到的EIS阻抗谱图,利用图6(b)中的等效电路图进行拟合各部分阻值。其中Rs表示溶液电阻,属于电解液内阻;Rct代表电荷转移电阻,与催化剂表面电子传输有关。拟合得到的结果在表2中列出,各催化剂的Rs都为2.6 Ω左右,表明溶液电阻相似。然而Rct却各不相同,Co-10% Ru氢氧化物纳米锥的Rct最小,仅为4.33 Ω,说明其具有快速的电荷转移特性。而氢氧化钴纳米锥、Co-5% Ru氢氧化物纳米锥、Co-20% Ru氢氧化物和Co-30% Ru氢氧化物的Rct分别10.17 Ω、5.85 Ω、7.14 Ω、5.51 Ω。所以Ru的掺入有利于加快电子传输效率,但是破坏的形貌不利于电子传输。
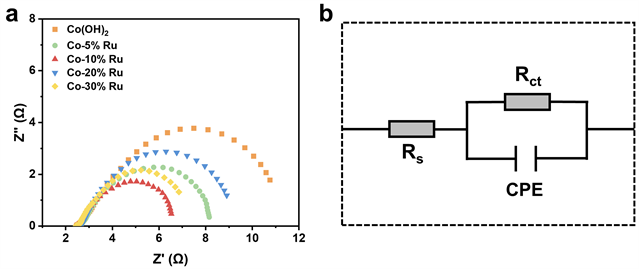
Figure 6. (a) Nyquist plots of hydroxide with different Ru content; (b) corresponding equivalent circuit model
图6. (a) 不同Ru掺入量的氢氧化物的尼奎斯特曲线;(b) 对应的等效电路模型

Table 2. The fitted values of resistances of Rs and Rct for the OER electrocatalysis
表2. OER催化剂Rs和Rct的拟合值
为了表征催化剂中活性位点的数量,通常通过计算双层电容(Cdl)来确定电化学活性面积(ECSA)。基于不同扫描速率下的循环伏安图(CV),以扫描速率为横坐标,CV曲线电压区间中点的充放电电流密度为纵坐标,绘制线性关系曲线,拟合得到的斜率即为Cdl的2倍。如图7所示,在非法拉第区间,电压范围为0.2~0.25 V (vs. Hg/HgO)进行扫描速率为20、40、60、80、100 mV·s−1的CV扫描,得到的电容电流密度与扫描速率的拟合曲线如图7(f)所示。Co-10% Ru氢氧化物纳米锥的斜率为37.67 mF·cm−2,大于氢氧化钴纳米锥(12.09 mF·cm−2),Co-5% Ru氢氧化物纳米锥(19.36 mF·cm−2),Co-20% Ru氢氧化物(16.32 mF·cm−2),Co-30% Ru氢氧化物(9.79 mF·cm−2)。当形貌还保持纳米锥时,随着Ru的掺入量增大,电化学活性面积也增大。但是Ru的掺入量过大破坏了纳米锥的形貌,电化学活性面积反而减小。尤其注意到Co-30% Ru氢氧化物的形貌破坏最严重,其电化学活性面积也是最小。因此,形貌对电化学活性面积具有显著影响,纳米锥具有较大电化学活性面积。
3.4. 析氧性能测试
为了测试所制氢氧化物纳米材料的HER性能,采用同样的三电极体系,在1 M KOH溶液中进行电化学测试。测试得到的极化曲线如图8(a)所示,可以看出随着Ru的掺入量增多,HER性能越来越好,Co-30% Ru氢氧化物的HER性能是最好的。这个规律在图8(b)中的过电势柱状图中也可以看出来,在10 mA·cm−2电流密度下,Co-30% Ru氢氧化物的过电势仅为230 mV,优于氢氧化钴纳米锥(516 mV),Co-5% Ru氢氧化物纳米锥(426 mV),Co-10% Ru氢氧化物纳米锥(389 mV)和Co-20% Ru氢氧化物(295 mV)。然而,塔菲尔斜率的规律却并非如此。如图8(c)所示,Co-10% Ru氢氧化物纳米锥的塔菲尔斜率最小,为105.56 mV·dec−1,表明其具有最快的电子传递速率。氢氧化钴纳米锥、Co-5% Ru氢氧化物纳米锥、Co-20% Ru氢氧化物、Co-30% Ru氢氧化物分别为175.81 mV·dec−1、126.38 mV·dec−1、154.02 mV·dec−1、113.51 mV·dec−1。可以看出,在不破坏纳米锥的前提下,Ru的掺入可以加快电子反应速率。然而,Ru的掺入量过大破坏了形貌时,塔菲尔斜率反而增大,阻碍了电子的传递。图8(c)中的尼奎斯特图表示HER反应过程中的电阻,其中半圆的直径越小,表示催化剂的表面电阻越小。其变化规律也说明了,Ru的掺入量越大,材料的电阻就越小。

Figure 7. (a)~(e) CV curves of different scan rates; (f) linear fitting of the capacitive current densities versus the scan rates
图7. (a)~(e) 不同扫描速率的CV曲线;(f) 电容电流密度与扫描速率的线性拟合

Figure 8. HER performance of hydroxide: (a) LSV curve; (b) comparison of overpotential at 10 mA·cm−2; (c) tafel slope; (d) Nyquist plots
图8. 氢氧化物的HER性能:(a);LSV曲线;(b) 10 mA·cm−2电流密度下的过电势比较;(c) 塔菲尔斜率;(d) 尼奎斯特曲线
4. 结论
本文采用共沉淀法,通过Ru原子部分取代Co原子来合成CoRu氢氧化物纳米锥。使用XRD、SEM、TEM、XPS等方法来表征合成的氢氧化物纳米锥的组成、形貌和价态等,并通过电化学工作站进行OER和HER测试表征其性能。随着Ru的添加量增大,锥的形貌逐渐被破坏。形貌对OER影响较大。在Ru少量掺入时,锥的形貌可以保持,Ru的掺入有利于OER性能的提高。然而,在Ru的掺入量继续增大时,形貌被破坏,OER性能反而下降,说明锥的形貌对OER性能起着决定性作用。在HER测试中,Ru的含量起决定性作用。Ru的掺入量越大,HER性能越好。然而在HER过程中,塔菲尔斜率依然与形貌密切相关。锥的形貌具有较小的塔菲尔斜率,也就是有更快的反应动力学。因此,应该在保持锥的形貌的基础上,尽可能提高Ru的掺入量。
基金项目
国家自然科学基金项目资助(U20A20123, 51874357)。