摘要: 目的:自身免疫性多内分泌腺病综合征是一种罕见病,通过病例报道分析疾病特点及治疗方法,提高临床医师对疾病的认识,促进疾病的治疗及改善预后。方法:报道1例以弥漫性甲状腺肿伴甲状腺功能亢进症和1型糖尿病为主要表现的APS II型。结果:根据临床表现及辅助检查,诊断为“自身免疫性多内分泌腺病综合征II型”:弥漫性甲状腺肿伴甲状腺功能亢进症、1型糖尿病。入院后予降糖、补液、纠酸及激素替代治疗,血糖控制平稳,甲状腺功能较前无明显变化。结论:自身免疫性多内分泌腺病综合征是指同一患者中存在2种及以上的内分泌疾病,起病隐匿,早期发现及规范治疗有利于改善预后。
Abstract:
Objective: Autoimmune polyendocrine syndrome is a rare disease, to improve clinicians’ un-derstanding of the disease, promote the treatment of the disease and improve the prognosis by analyzing the characteristics and treatment methods of the disease through case reports. Methods: A case of APS type II with diffuse goiter with hyperthyroidism and type 1 diabetes mellitus was reported. Results: According to the clinical manifestations and auxiliary examina-tion, the patient was diagnosed as “autoimmune polyendocrine syndrome type II”: diffuse goi-ter with hyperthyroidism and type 1 diabetes mellitus. After admission, hypoglycemia, fluid re-hydration, acid correction and hormone replacement therapy were given. Blood glucose control was stable, and thyroid function did not change significantly. Conclusion: Autoimmune polyen-docrine adenopathy syndrome refers to the presence of two or more endocrine diseases in the same patient; due to the insidious onset, early detection and standardized treatment is condu-cive to improve the prognosis.
1. 引言
自身免疫性多内分泌腺病综合征(autoimmune polyglandular syndrome, APS)是指由于自身免疫,同一患者中至少存在2种或多种内分泌疾病。PAS的特征是表现隐匿、受影响组织或器官的淋巴细胞浸润,最终导致器官衰竭 [1]。APS是罕见病,对于罕见病的报道,我们的目标是早期发现PAS、减少并发症、发挥最佳治疗效果和预后。现对我院收治的1例以弥漫性甲状腺肿伴甲状腺功能亢进症和1型糖尿病为主要表现的APS II型报道如下。
2. 资料和结果
2.1. 一般资料
患者,女,38岁,因“发现血糖高伴恶心呕吐5天”就诊于临沂市人民医院内分泌与代谢病科。患者5天前查体发现血糖高,约18 mmol/l,伴恶心、呕吐,呕吐胃内容物,伴乏力、心悸、盗汗,与我院门诊查血气示:PH 7.17,PCO2 31 mmHg,PO2 152 mmHg,BE −16 mmol/l;血常规示:CO2 10.3 mmol/l;尿酮体(++),遂以“糖尿病酮症酸中毒”收入科。患者既往体健,无药物过敏史及放射性物质接触史,无高血压、冠心病病史,无吸烟饮酒及不良嗜好史,月经正常,父母及子女体健。
2.2. 查体
体温36.1℃,脉搏130次/分,呼吸18次/分,血压101/66 mmHg。神志清楚,精神状态欠佳,甲状腺II°肿大,质软无压痛,未扪及结节,无血管杂音,双肺呼吸音清,未闻及干湿啰音,心率130次/分,节律齐,无杂音,腹部平坦,无压痛、反跳痛,肝脾未触及,双下肢无凹陷性水肿,病理征阴性。
2.3. 辅助检查
2.3.1. 影像学检查
心脏彩超、双侧颈部血管彩超、肝胆胰脾彩超、女性泌尿系彩超及下肢静脉彩超检查均正常,甲状腺彩超示:甲状腺实质弥漫性损害声像图。甲状腺静态显像示:甲状腺双叶体积增大,摄锝功能增强。24小时动态摄碘率见下图1。
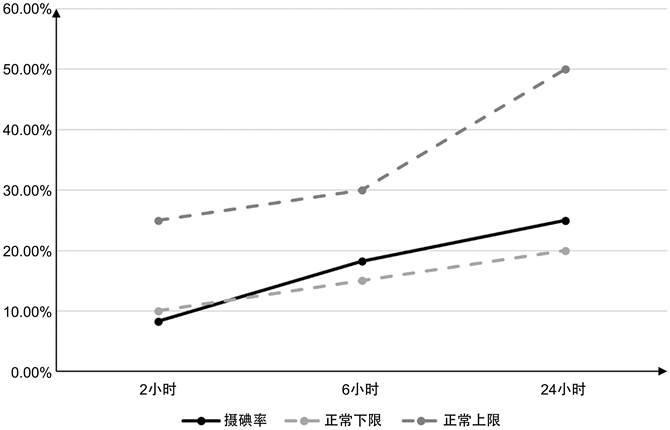
Figure 1. 24 hours dynamic iodine uptake rate
图1. 24小时动态摄碘率
2.3.2. 实验室检查
肝功 + 肾功 + 血糖 + 电解质示:空腹血糖11.67 mmol/l (正常值3.90~6.10 mmol/l),血钾3.46 mmol/l (正常值3.5~5.3 mmol/l),血钠135 mmol/l (正常值137~147 mmol/l),血二氧化碳20.1 mmol/l (正常值22~29 mmol/l),余指标正常。尿沉渣镜检示:尿酮体4+,尿葡萄糖4+。糖化血红蛋白9.1% (正常值4.0%~6.0%),C肽0.100 ng/ml (0.81~3.85 ng/ml),胰岛素抗体6.37 IU/ml (正常值0.41~20 IU/ml),谷氨酸脱羧酶抗体280 IU/ml (正常值0.51~30 IU/ml)。甲功示:游离三碘甲状腺原氨酸18.13 pmol/l (正常值3.5~6.53 pmol/l)、游离甲状腺素44.303 pmol/l (正常值11.5~22.73 pmol/l)、甲状腺过氧化物酶抗体 > 1300 IU/ml (正常值0~60 IU/ml)、促甲状腺激素受体抗体38.910 IU/L (正常值0~1.75 IU/L)。血常规、血沉、C-反应蛋白、肌钙蛋白、降钙素原、感染指标筛查、肿瘤标志物均未见异常。
2.4. 诊疗经过
入院后予糖尿病饮食管理,补液,纠酸,小剂量胰岛素泵静脉输注调节血糖,监测电解质补钾,同时予甲巯咪唑抗甲状腺素合成。患者酮症症状纠正后,改用门冬胰岛素三餐前皮下注射联合甘精胰岛素睡前皮下注射控制血糖,出院时血糖波动在8 mmol/l左右,甲状腺功能较前无明显变化,继续甲巯咪唑治疗,一周门诊复查空腹血糖波动在8~10 mmol/l,甲功示:游离三碘甲状腺原氨酸11.15 pmol/l、游离甲状腺素37.29 pmol/l。
2.5. 结果
根据临床表现及辅助检查,诊断为“自身免疫性多内分泌腺病综合征II型”:弥漫性甲状腺肿伴甲状腺功能亢进症、1型糖尿病。
3. 讨论
自身免疫性多内分泌腺病综合征(autoimmune polyglandular syndrome, APS)是指由于自身免疫耐受不良导致同一患者同时或者先后出现2种或2种以上自身免疫性内分泌腺病和非内分泌腺病的一组临床病症 [2],成人型APS的患病率为1:20,000,年发病率为1~2:100,000 [3]。根据临床表现和遗传机制等的不同,APS分为APS I型和APS II型 [1],还有学者指出存在的APS III型和APS IV型 [4],由于相似的遗传学背景,后两者归入APS II型。APSI是一种罕见的常染色体隐性疾病 [5],与自身免疫调节器(AIRE)基因突变相关,该疾病通常在儿童时期出现最初的表现,但是足够引起重视的临床表现出现的较晚,由于其临床表现复杂,需要引起临床医师的了解及关注。APSI的诊断遵循Whitaker [6] 所描述的三联征(慢性粘膜皮肤念珠菌病、甲状旁腺功能减退和肾上腺皮质衰竭)中至少三分之二的诊断标准。如果患者的兄弟姐妹有类似患者,只需要三联征的一个组成部分来做出诊断 [7]。APS I具有遗传易感性,因此在某些人群中会更常见,不同地区人群的发病率截然不同。例如,在美国,I型的患病率约为1:100,000 [8];在芬兰部分地区,其流行率约为每25,000例中有1例 [9];在挪威9万人中约有1例 [10]。对于APSI患者治疗,主要包括:激素替代治疗、抗感染治疗、免疫抑制治疗 [11]。
APS II型通常表现为:Addison病、1型糖尿病、自身免疫性甲状腺疾病,满足这3种疾病中的任2种即可诊断 [2]。此外,APS II型还表现为自身免疫性胃炎、白癜风、性腺功能减退等其他内分泌器官或腺体的自身免疫性疾病 [2]。有一项收集了360例APSII患者的临床、流行病学和血清学数据的研究 [8] 发现,APS中最常见的疾病组合是1型糖尿病和自身免疫性甲状腺疾病。而且在大多数患者中,1型糖尿病是APS的首次表现,约占所有患者的48%。Schulz L等 [12] 报道了1例因“体重减轻、恶心和呕吐”就诊的15岁男孩,经检查治疗后诊断为伴有Addison病、Graves病的APSII;李晶晶等 [13] 报道了1例Addison病联合甲状腺功能减退为主要表现的APS-II型;本文报道了1例因“发现血糖高伴恶心呕吐”就诊的患者,同时出现1型糖尿病和甲状腺疾病。
APSII型在美国的患病率为1:20,000 [14],其他国家罕有报道其发病率及流行病学。此病更常见于女性,男女比例为1:3 [15]。APSII在20~60岁时发病率最高,主要发生在第三或第四个十年。与I型相比,II型相对常见,而且II型遗传性更复杂,易受多种因素的影响。研究报道 [16],PAS II型与主要组织相容性复合体中的人类白细胞抗原(HLA)基因的某些等位基因密切相关 [17]。
APS II的自身免疫被认为是多因素的。病理机制研究表明 [14],未成熟树突状细胞在将吸收的抗原片段化后,会迁移至呈递其HLA I类或II类相关抗原片段的次级淋巴器官。抗原呈递一方面通过激活抗原特异性Th细胞(Th2)和刺激B淋巴细胞来刺激体液免疫反应,另一方面通过细胞毒性T淋巴细胞(Th1)刺激细胞免疫反应,当刺激过度导致免疫耐受性丧失时就会发生自身攻击,形成自身免疫性疾病,会对身体的免疫系统产生深远的影响。
APS II患者的治疗分三种情况 [18] [19]:一是Graves病的患者的治疗与单独患有该病的治疗方法一致;二是引起腺体功能减退的疾病如甲状腺功能减退、Addison病等,主要的治疗方案是激素替代治疗;三是对于存在自身免疫性甲状腺功能减退的患者,必须要在开始治疗甲状腺功能减退症前检查肾上腺功能。因为甲状腺素刺激了肝脏中糖皮质激素的代谢增加,所以对未经治疗的肾上腺功能不全患者开始甲状腺激素治疗可导致危及生命的肾上腺危象 [20]。
Gouveia S等 [21] 通过描述一组1型糖尿病(T1DM)患者存在其他自身免疫性疾病的特征中发现,女性的APS和自身免疫性甲状腺炎风险较高,病程与胃自身抗体直接相关,与谷氨酸脱羧酶抗体呈负相关。警示临床医师在T1DM患者的治疗过程中,有必要进行APS的筛查。既往有数据研究 [8] 表明,对自身免疫性内分泌疾病患者进行早期免疫遗传学筛查,可以提高识别有PASII风险的患者的可能性,目前筛查的重点主要是AIRE突变位点的检测和自身抗体,如抗干扰素抗体、抗细胞因子抗体等的测定。Frommer L等 [14] 的研究中也提过,对于APSII的患者可以选择遗传咨询,因为自身免疫性疾病可能有一些基因和环境因素的参与。
本文考虑到自身免疫性疾病与其他疾病相关联的倾向性较高,组成部分疾病时表现时间有差异以及慢性和亚临床病程,存在一种免疫内分泌病的患者都有可能发展另一种自身免疫性疾病,因此,旨在通过病例报告引起临床医师的重视。
NOTES
*通讯作者。