1. 引言
马兜铃属植物因其普遍含有马兜铃酸(Aristolochic Acids, AAs)而得名,作为中草药广泛参与临床疾病的治疗 [1] 。常见的马兜铃属中草药有马兜铃、细辛、关木通、广防己等 [2] 。AAs是一类硝基菲羧酸类化合物,也是马兜铃属中草药的主要活性成分,其占比最多的是马兜铃酸I (aristolochic acid I)和AAII (aristolochic acid II) [3] 。通过对马兜铃属中草药临床应用的研究,发现其对肾脏有广泛的毒性作用,1964年我国吴松寒就已发现大量服用木通会导致急性肾损伤;90年代初,比利时出现了百余名妇女的中毒事件,调查显示其“罪魁祸首”是服用了含有广防己的减肥方;1990年我国也出现了服用含有关木通的龙胆泻肝丸的群体性药害事件 [4] [5] [6] 。研究表明,单次摄入或多次摄入AAs均会导致以进展性肾纤维化和肾衰竭为特征的马兜铃酸肾病(Aristolochic Acid Nephropathy, AAN) [7] 。没有及时地停用药物,进行干预治疗,会引起肾脏的不可逆性损伤,发展成为慢性肾脏病,晚期只能通过透析、肾移植等肾脏替代治疗维持生命,采用这类治疗方法的患者治疗费用高,生活质量差,给病人带来极大的痛苦 [8] 。
Wnt/β-catenin信号通路是一类进化过程中高度保守的信号通路,参与发育和疾病过程,目前在哺乳动物体内发现了19种Wnt配体和15种受体及共受体 [9] 。Wnt/β-catenin信号通路在体内的传导过程是通过Wnt蛋白与受体Frizzled家族蛋白和LRP5/6受体结合,导致GSK3β的失活并阻止破坏复合体的组装,抑制β-catenin在胞质内的降解,引起β-catenin在胞质内积累并转运到细胞核,在核内β-catenin与T细胞因子(TCF)和淋巴增强因子(LEF)结合并启动以SNAIL1和ZEB1为代表的Wnt靶基因的表达 [10] 。本研究通过观察青木香与AAI造成的慢性AAN以及发展过程中Wnt/β-catenin信号通路的变化,探讨慢性AAN的病理变化和Wnt/β-catenin信号通路在AAN纤维化发展过程中的作用机制,为阐明AAN纤维化的机制和发展其临床治疗手段提供了参考。
2. 材料与方法
2.1. 药物、试剂及仪器
将AAI标准品(纯度96%,批号:211109M,四川维克奇生物),溶于二甲基亚砜(批号:814O036,北京索莱宝科技)与0.4%的羧甲基纤维素钠(Carboxymethylcellulose Sodium, CMC-Na) (批号:20201203,上海展云化工)中,制成2 mg/mL的AAI悬浊液。青木香(购自亳州中药材批发市场)用甲醇萃取、旋蒸,用0.4%的羧甲基纤维素钠进行复溶,得到AAI含量为2 mg/mL的青木香悬浊液。HE染色液(批号:20201104,北京索莱宝);Masson染色试剂盒(批号:20210428,北京索莱宝);β-连环蛋白(β-catenin)鼠多克隆抗体(批号:00100092,武汉三鹰生物);α平滑肌肌动蛋白(α-Smooth Muscle Actin, α-SMA)兔多克隆抗体(批号:PA1-26204,Thermo Fisher scientific公司);免疫组化(Immunohistochemistry, IHC) SP试剂盒(批号:2222B301,北京中杉金桥);DAB显色试剂盒(批号:20220718,北京兰杰柯科技有限公司) DMIL LED DFC425c型显微镜(徕卡)。
2.2. 实验动物
8周龄的雄性KM小鼠36只,体重(32 ± 5) g,在贵州中医药大学基础医学院实验动物中心饲养,常温环境,自由摄食、饮水。实验过程严格按照《实验动物福利伦理审查指南(GB/T35922018)》要求执行。
2.3. 动物分组及给药
将36只小鼠于笼中适应性喂养一周,自由进食水。随机分为3组,对照组、AAI组和青木香组,每组12只。对照组小鼠灌胃给药0.4% CMC 0.2 mL/2d,AAI组小鼠灌胃给药5 mg/kg/2d,青木香组小鼠灌胃给药青木香悬浊液5 mg/kg/2d。
2.4. 样本采集
用药开始后将对照组和模型组的小鼠分别于第4周和第8周各随机取6只,戊巴比妥钠腹腔注射麻醉,摘眼球取血后,颈椎脱臼处死,用PBS进行灌注,取出肾组织样本,沿矢状面分为两份,PBS冲洗后浸入4%多聚甲醛固定。
2.5. 组织病理学染色
将固定过的肾脏组织经乙醇梯度脱水、二甲苯透明、浸蜡、包埋后切片(厚度3 µm),进行苏木精–伊红(HE)与Masson染色,在光学显微镜下观察肾脏组织病理变化。
2.6. 免疫组化染色
将玻片放入60℃烤箱2个小时融化切片表面石蜡,放入二甲苯I、II、III各10 min,再用梯度乙醇进行脱水,置于PBS缓冲液中浸洗。用柠檬酸钠抗原修复液高温修复,滴加内源性过氧化物酶阻断剂(3% H2O2),室温孵育10 min,用PBS缓冲液浸洗3次。滴加100 μL山羊血清封闭液,室温孵育15 min,β-catenin抗体(1:200),α-SMA抗体(1:200)稀释,滴加100 μL,放入免疫组化孵育盒,4℃过夜,用PBS缓冲液浸洗。滴加100 μL生物素标记山羊抗小鼠/兔IgG抗体,室温孵育15 min,用PBS缓冲液浸洗。滴加100 μL辣根酶标记链霉卵白素工作液,室温孵育15 min,用PBS缓冲液浸洗。滴加新鲜配制的DAB显色液,室温孵育1~3 min,在镜下观察到阳性反应立即终止反应。用自来水冲洗玻片。苏木素复染。梯度脱水,依次放入二甲苯I、二甲苯II 5 min,中性树脂胶封片,光学显微镜下观察蛋白表达情况。
2.7. 数据分析与处理
免疫组化和Masson染色的图像使用ImageJ软件对阳性染色部位进行统计 [11] ,实验结果以SPSS 24.0软件进行统计分析,数据均以
± s表示,多组间统计学差异(方差齐性检验后)采用单因素方差分析(one-way-AVOVA)比较;P < 0.05表示差异有统计学意义。
3. 结果
3.1. 青木香与AAI对小鼠肾脏的毒性
通过HE染色观察慢性AAN的病理改变。结果显示与对照组相比,小鼠暴露于AAI和青木香4周后肾皮质形态结构紊乱,可见肾小管管腔扩张,部分肾小管上皮细胞出现刷状缘消失、细胞坏死脱落等改变,另外有少量肾小管上皮细胞表现为胞质浓染、细胞核增大等表现,肾小球未出现明显改变;暴露于AAI和青木香8周后肾小管管腔扩张数量较4周比增多,肾小管上皮细胞也出现了水肿、坏死和脱落,同时也出现了犬牙状分布的胞质浓染、细胞核增大的肾小管上皮细胞(见图1)。
 小鼠暴露于AAI与青木香4周与8周后肾脏病理改变的代表性图片。暴露于AAI与青木香后肾近曲小管上皮细胞出现水肿、脱落坏死,部分上皮细胞胞质浓染,呈犬牙状分布。
小鼠暴露于AAI与青木香4周与8周后肾脏病理改变的代表性图片。暴露于AAI与青木香后肾近曲小管上皮细胞出现水肿、脱落坏死,部分上皮细胞胞质浓染,呈犬牙状分布。
Figure 1. Kidney changes in mice exposed to AAI and cyanobacteria for 4 and 8 weeks after HE staining
图1. HE染色观察小鼠暴露于AAI与青木香4周与8周后肾脏的变化
3.2. 慢性AAN过程中Wnt/β-Catenin信号通路的改变
通过免疫组化观察小鼠暴露于AAI和青木香后肾脏中的β-catenin蛋白表达情况。结果显示,对照组的β-catenin蛋白免疫组化平均光密度值在4周和8周时变化不大。与对照组相比,小鼠暴露于AAI和青木香4周后肾小管中β-catenin表达增高,为对照组的1.2倍,主要聚集在肾小管上皮细胞的细胞质和细胞核内;与对照组相比,小鼠暴露于AAI和青木香8周后,β-catenin蛋白的表达进一步增高,为对照组的1.4倍,大量聚集在肾小管上皮细胞的细胞核内(见图2)。
 小鼠暴露于AAI与青木香4周与8周后肾脏β-catenin蛋白表达的代表性图片。对照组未出现明显的β-catenin蛋白的表达,暴露于AAI与青木香4周后肾近曲小管上皮细胞胞质和细胞核内出现β-catenin蛋白的表达,8周后β-catenin蛋白的表达进一步聚集于细胞核内;β-catenin免疫组化平均光密度值与对照组相比有明显升高。n = 5,*P < 0.05,**P < 0.01,***P < 0.005。
小鼠暴露于AAI与青木香4周与8周后肾脏β-catenin蛋白表达的代表性图片。对照组未出现明显的β-catenin蛋白的表达,暴露于AAI与青木香4周后肾近曲小管上皮细胞胞质和细胞核内出现β-catenin蛋白的表达,8周后β-catenin蛋白的表达进一步聚集于细胞核内;β-catenin免疫组化平均光密度值与对照组相比有明显升高。n = 5,*P < 0.05,**P < 0.01,***P < 0.005。
Figure 2. Changes in renal β-catenin protein expression in mice exposed to AAI and cyanobacteria for 4 and 8 weeks after immunohistochemical staining
图2. 免疫组化染色观察小鼠暴露于AAI与青木香4周与8周后肾脏β-catenin蛋白的表达变化
3.3. Wnt/β-Catenin信号通路与肾纤维化
通过Masson染色观察小鼠暴露于AAI和青木香后肾脏胶原纤维的改变。结果显示,与对照组相比,小鼠暴露于AAI和青木香4周后蓝染的胶原纤维数量和面积明显增多,通过对染色结果的胶原纤维容积分数进行统计分析后发现,AAI组和青木香组的胶原纤维容积分数显著增加;与对照组相比,小鼠暴露于AAI和青木香8周后肾皮质中的纤维数量和胶原纤维容积分数也出现了显著增加(见图3)。
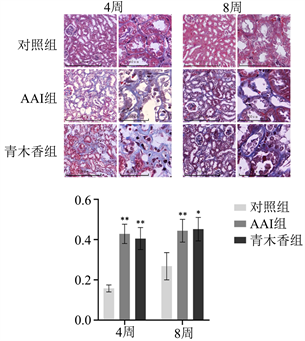 小鼠暴露于AAI与青木香4周与8周后肾皮质Masson染色的代表性图片。暴露于AAI与青木香4周和8周后,肾皮质胶原纤维的表达增多;与对照相比,胶原纤维容积分数出现了显著增高。n = 5,*P < 0.05;**P < 0.01。
小鼠暴露于AAI与青木香4周与8周后肾皮质Masson染色的代表性图片。暴露于AAI与青木香4周和8周后,肾皮质胶原纤维的表达增多;与对照相比,胶原纤维容积分数出现了显著增高。n = 5,*P < 0.05;**P < 0.01。
Figure 3. Change in collagen fiber expression in renal cortex of mice exposed to AAI and cyanobacteria for 4 and 8 weeks after Masson staining
图3. Masson染色观察小鼠暴露于AAI与青木香4周与8周后肾皮质胶原纤维的表达变化
通过免疫组化对暴露于AAI和青木香小鼠肾脏的α-SMA蛋白表达进行观察,结果显示,小鼠暴露于AAI和青木香4周后,与对照组相比,α-SMA蛋白的表达明显增高,聚集在犬牙状细胞内,为对照组的1.4倍以上;与对照组相比,小鼠暴露于AAI和青木香8周后,AAI组的α-SMA蛋白的表达超过对照组的1.6倍,青木香组也较对照组有明显的升高(见图4)。
 小鼠暴露于AAI与青木香4周与8周后肾脏α-SMA蛋白表达的代表性图片。对照组没有明显的α-SMA蛋白表达,暴露于AAI与青木香后肾近曲小管上皮细胞表达α-SMA蛋白;β-catenin免疫组化平均光密度值与对照组相比有明显升高。n = 5,*P < 0.05;**P < 0.01;***P < 0.005。
小鼠暴露于AAI与青木香4周与8周后肾脏α-SMA蛋白表达的代表性图片。对照组没有明显的α-SMA蛋白表达,暴露于AAI与青木香后肾近曲小管上皮细胞表达α-SMA蛋白;β-catenin免疫组化平均光密度值与对照组相比有明显升高。n = 5,*P < 0.05;**P < 0.01;***P < 0.005。
Figure 4. Changes in renal α-SMA protein expression in mice exposed to AAI and cyanobacteria for 4 and 8 weeks after immunohistochemical staining
图4. 免疫组化染色观察小鼠暴露于AAI与青木香4周与8周后肾脏α-SMA蛋白的表达变化
4. 讨论
青木香作为马兜铃属植物,在我国分布广泛,曾作为中草药和民族药入药 [1] 。研究表明,马兜铃属植物的毒性大部分源于其富含的AAI,主要损伤肾脏的肾小管尤其是肾近端小管,会引起近端小管上皮细胞坏死、脱落,进一步诱导肾小管上皮细胞纤维化 [12] 。因此,明确AAN过程中纤维化的改变和与Wnt/β-catenin信号通路之间的关系对于AAN的诊断和治疗有重要意义。
小鼠暴露于AAI与青木香4周以及8周后,大量肾小管管腔扩张,肾小管上皮细胞出现不同程度的损伤,细胞核固缩,还出现了部分另一种形态的肾小管上皮细胞,细胞呈犬牙状突起,胞质浓染,细胞核增大,与损伤后新生的肾小管上皮细胞形态一致 [13] 。说明AAI对肾脏有毒性作用,主要损伤肾小管上皮细胞,在慢性AAN的发展过程中,受损的肾小管上皮细胞出现自我修复,会有新生的肾小管上皮细胞的出现。而暴露于AAI和暴露于青木香后小鼠的病理改变表现相同,证明了AAI是引发AAN的主要毒性成分。
研究表明,慢性期的AAN会诱发肾小管尤其是近端肾小管上皮细胞坏死、脱落,并诱发肾小管上皮细胞EMT进而引发纤维化,也是马兜铃酸肾病预后不佳的重要原因,其引发纤维化的机制尚不明确 [14] 。而Wnt/β-catenin信号通路被发现参与了肾脏的疾病过程,在不同层面上干扰Wnt通路,如在输尿管阻塞小鼠肾间质纤维化模型中注射Ddk1 (一种Wnt拮抗剂)载体可以减少β-catenin的积聚和纤维化 [15] ;另一种Wnt拮抗剂Dapper3的缺失会导致输尿管梗阻肾纤维化动物模型β-catenin的紊乱、Wnt靶向的促纤维化基因的激活和纤维化表型的恶化 [16] 。这些结果都表明,Wnt信号通路与肾间质纤维化关系密切,在肾间质纤维化过程中发挥着重要作用。我们通过对Wnt/β-catenin信号通路的核心蛋白β-catenin的免疫组化研究发现,在慢性AAN发展的过程中,β-catenin的表达与对照组相比明显升高,4周时多聚集在胞质和细胞核内。当小鼠暴露于AAI8周时,β-catenin多聚集在细胞核内。当Wnt/β-catenin信号通路被激活后,胞质内的破坏复合体不能降解β-catenin,在胞质内过度堆积的β-catenin转移至细胞核内,引发T细胞因子的转录从而激活β-catenin/EMT途径 [17] 。结果表明,在AAN的发展过程中,也出现了Wnt/β-catenin信号通路的激活。我们通过Masson染色以及α-SMA免疫组化染色对小鼠暴露于AAI 4周和8周后的纤维化程度的观察,结果表明,小鼠暴露于AAI后其纤维化程度逐渐加重,最严重时达到对照组的2.7倍以上;α-SMA的免疫组化结果也显示小鼠暴露于AAI 4周和8周后α-SMA的表达显著升高,大量聚集与新生的犬牙状细胞内。因此,我们认为AAN的发展过程中会激活Wnt/β-catenin信号通路,促进肾小管上皮细胞EMT,参与了肾纤维化的过程。而新生的肾小管上皮细胞,这些细胞不仅参与了损伤肾小管的修复,也有少量细胞表达α-SMA蛋白,说明其也可能参与了AAN肾脏纤维化的过程。
综上所述,机体摄入AAI和青木香均可引起AAN的发生,两种药物引起的AAN病理改变相同。在慢性AAN的发展过程中,能够观察到Wnt/β-catenin信号通路的激活,该通路促进肾小管上皮细胞发生EMT转化,促进AAN纤维化的发展,但对于是哪一种Wnt通路的配体所激活的Wnt/β-catenin信号通路以及该信号通路与肾纤维化之间的关系还有待研究。
项目基金
省教育厅特色重点实验室(黔教合KY字[2021] 004);贵州省基础研究计划(黔科合基础-ZK [2022]一般465);2020省科技支撑(黔教合支撑[2020] 4Y209)。
参考文献
NOTES
*通讯作者。