摘要: 背景:目前瓣膜病已经成为严重危害人群健康的疾病,保守估计我国目前约2500万心脏瓣膜病患者。外科手术是解决病因的最佳途径。随着外科技术的日益发展,瓣膜病的外科治疗由20世纪70年代后期的闭式扩张分离术,至今,伴随着体外循环技术的发展,心脏停跳液的进步以及最重要的瓣膜的迭代,心脏瓣膜置换手术已然成为一项成熟的方式。不论是单个瓣膜的置换手术,还是联合瓣膜的手术,从手术数量以及死亡率来看,我国的瓣膜置换手术已然达到国际先进水平。然而,尽管目前心脏瓣膜置换手术技术越发成熟,手术死亡率显著降低。然而术后并发症的所带来的影响却不可忽视。心律失常是瓣膜置换手术最常见的并发症之一,轻者诸如房性早搏,还有大多数的心房颤动甚至可以自行转复,严重者诸如室性心动过速,室性颤动则是导致术后ICU住院时间延长,预后差,甚至是早期死亡的重要原因之一。目的:本研究的目的是通过比较正中开胸直视下瓣膜置换术术后发生心律失常与未发生心律失常的患者的相关指标,探讨能提示或导致术后心律失常危险因素,减少患者心律失常术后发生率。方法:回顾性分析194名自2021年1月1日起于我院行心脏瓣膜置换手术的患者(男80,女114),按照是否发生瓣膜置换术后的心律失常,将其分为实验组(发生心律失常患者,80例,男37,女47,平均年龄63.0岁)及对照组(未发生心律失常患者,114例,男43,女67,平均年龄62.0岁)。比较两组临床资料,术后是否发生心律失常的单因素分析采用卡方检验以及秩和检验,而后对于P < 0.05的变量采用logistic回归模型进一步分析与术后心律失常的相关性。结果:心脏瓣膜置换术后新发心律失常80例,在本研究中,患者年龄、既往糖尿病史、高血压史、脑梗病史、既往开胸心脏手术史、术前肌酐、血钾、血镁、高敏肌钙蛋白、心超EF值、术前白蛋白、尿素氮、甘油三酯、乳酸,术中是否发生室颤、术后尿素氮、血镁、乳酸、血红蛋白值在实验组和对照组之间并无差异,而术前白细胞值(P = 0.025)、BMI (<0.001)、既往COPD史(0.036)、手术时间及主动脉夹闭时间(P < 0.001)、术后血钾(P < 0.001)、肌酐(P = 0.014)、术后白细胞(P = 0.019)在实验组与对照组之间差异具有统计学意义,为可能导致术后发生心率失常的危险因素。结论:术前注重把握手术适应症,对于术后心律失常高危患者尽早采取预防措施,术中注重患者心肌保护,减少不必要的手术操作,降低手术时间;术后关注患者生命体征及相关化验指标,及时进行抗炎治疗,注意维持患者电解质平衡,监护患者心律变化,及时处理病情。能有效改善患者心律失常发生率以及预后情况,降低手术死亡率。
Abstract:
Background: At present, valvular disease has become a serious disease that endangers the health of the population, and it is conservatively estimated that there are currently about 25 million patients with valvular heart disease in China. Surgery is the best way to address the cause. With the increasing development of surgical technology, the surgical treatment of valvular disease has changed from closed dilation separation in the late 70s of the 20th century, and so far, with the development of cardiopulmonary bypass technology, the advancement of cardiac arrest fluid and the iteration of the most important valve, heart valve replacement surgery has become a mature method. Whether it is a single valve replacement surgery or a combined valve operation, from the perspective of the number of operations and mortality, China’s valve replacement surgery has reached the international advanced level. However, despite the current maturity of heart valve replacement surgery, surgical mortality has been significantly reduced. However, the impact of postoperative complications cannot be ignored. Arrhythmia is one of the most common complications of valve replacement surgery, mild such as atrial premature beats, and most atrial fibrillation can even be converted on its own, severe cases such as ventricular tachycardia, ventricular fibrillation is one of the important causes of prolonged postoperative ICU stay, poor prognosis, and even early death. Objective: The objective of this study is to reduce the incidence of arrhythmia in patients with arrhythmia after median open-eye valve replacement and patients without arrhythmia by comparing the relevant indicators of arrhythmia after median open-eye valve replacement with those without arrhythmia. Methods: A retrospective analysis was performed for 194 patients (80 males and 114 females) who underwent heart valve replacement surgery in our hospital since January 1, 2021, and they were divided into experimental group (80 patients with arrhythmia, 37 males, 47 females, average age 63.0 years) and control group (114 patients without arrhythmias, 43 males, 67 females, average age 62.0 years) according to whether arrhythmias occurred after valve replacement. The univariate analysis of whether arrhythmias occurred after surgery was compared between the two groups of clinical data, and the chi-square test and rank sum test were used for the variables with P < 0.05, and then the logistic regression model was used to further analyze the correlation with postoperative arrhythmias. Results: In this study, there were 80 new arrhythmias after heart valve replacement, and in this study, the age, previous diabetes history, hypertension history, cerebral infarction history, previous open heart surgery, preoperative creatinine, blood potassium, blood magnesium, high-sensitivity troponin, cardiac ultra-EF value, preoperative albumin, urea nitrogen, triglycerides, lactic acid, whether ventricular fibrillation, postoperative urea nitrogen, blood magnesium, lactic acid and hemoglobin values did not differ between the experimental and control groups, while the preoperative white blood cell value (P = 0.025), BMI (<0.001), previous COPD history (0.036), operation time and aortic clipping time (P < 0.001), postoperative potassium (P < 0.001), creatinine (P = 0.014), and postoperative leukocytes (P = 0.019) were statistically significant between the experimental and control groups, and were risk factors that may lead to arrhythmias after surgery. Conclusion: Preoperative attention should be paid to grasping the indications of surgery, preventive measures should be taken as soon as possible for patients at high risk of postoperative arrhythmia, and intraoperative attention should be paid to myocardial protection, so as to reduce unnecessary surgical operations and reduce the operation time. After surgery, pay attention to the patient’s vital signs and related laboratory indicators, timely carry out anti-inflammatory treatment, pay attention to maintaining the patient’s electrolyte balance, monitor the patient’s heart rhythm changes, and deal with the condition in time. It can effectively improve the incidence and prognosis of arrhythmia and reduce surgical mortality.
1. 引言
随着生活方式的改变,心脏瓣膜病获得了越来越多的关注。据研究表明,我国约有2500万心脏瓣膜病患者,每年约有8万台心脏瓣膜外科手术 [1] 。而其中瓣膜置换手术作为最常见,也是最重要的瓣膜病外科治疗方式,能有效改善患者预后,显著提高患者生存期。遗憾的是,瓣膜置换手术也有其不可避免的术后并发症制约着患者的生存率,其中心律失常作为最常见的术后并发症之一,与患者住院时间、术后死亡率息息相关。
有研究表明,术后心律失常发生率约在10%~70% [2] ,这缘于部分患者术前心功能差,且瓣膜置换手术一般创伤较大,瓣膜置换手术所需的体外循环建立,主动脉夹闭时间过长或二次转机会加重心肌损伤,会诱发大量炎性因子及儿茶酚胺的产生,导致血管痉挛,这些都会刺激患者心律失常的发生。
常见的术后心律失常包括心房扑动、心房颤动、房室传导阻滞、室性早搏、室性心动过速、心室颤动等。轻者术后可自行或借助药物恢复至正常心律,而严重者可至休克,甚至导致死亡 [3] 。研究可能会导致心律失常的危险因素,对于降低术后死亡率,降低住院时间,提升手术质量,改善患者预后就显得尤为重要。
目前现有的研究认为,由于体外循环易致电解质紊乱,术后低钾及低镁是导致心律失常的可能危险因素。低钾使心肌兴奋性及自律性增加,发生心律失常,甚至是恶性心律失常的可能性远远大于血钾正常的患者。而电解质紊乱还可能导致急性肾损伤,从而导致心房扩张,易于发生如心房扑动、心房颤动等房性心律失常 [4] 。而术中较长的体外循环时间及主动脉阻断时间同样也是导致术后心律失常的可能危险因素,这些因素都能导致术中心肌损伤,进而诱发术后心律失常发生。虽然目前有多个预测模型分析可能会导致瓣膜置换手术后心律失常的危险因素,但都无法达到一个满意的效果。
一般来说,一旦在瓣膜手术后,发生了心律失常,目前常用的治疗方法有如下几种 [5] [6] :优先纠正电解质紊乱,补充患者缺乏的血钾血镁至正常值。当改善了电解质紊乱过后,若心律失常仍未改善,对于心房颤动伴快心室率来说,胺碘酮在有效减慢心律的同时能较轻地抑制心肌功能,是目前常用于治疗术后心房颤动伴快心率的用药。术后发生的室性早搏 [7] ,可先用利多卡因治疗,当利多卡因疗效不佳时可改用胺碘酮。如发生室速,则需选用利多卡因治疗,如果更为严重的室颤,则需要紧急电除颤,给予胸外按压。如复律后则继续利多卡因维持,如未有改善,则需开胸心内按压,放置起搏器。
因此本文通过回顾性分析我中心194例瓣膜置换术后的患者,分组对比产生心律失常及未产生心律失常的患者,分析发现影响心脏瓣膜置换术后可能会造成心律失常的危险因素。
2. 临床资料与研究方法
2.1. 研究对象
194名自2021年1月1日起于我院行心脏瓣膜置换手术的患者(男97,女116,平均年龄60.1岁),将其分为术后发生心率失常患者(实验组96例,男80,女55,平均年龄62.0岁)及未发生心律失常患者(对照组117例,男84,女31,平均年龄58.4岁)。
2.2. 病例纳入标准与排除标准
2.2.1. 纳入标准
患者符合心脏瓣膜置换手术指征,并择期行正中开胸瓣膜置换手术。
2.2.2. 排除标准
① 行达芬奇机器人辅助下心脏瓣膜置换手术;② 主动脉夹层行Bentall术;③ 急诊手术中行瓣膜置换术;④ 经导管主动脉瓣置换术;⑤ 临床资料不完整或缺失的病历。
2.3. 外科技术
主动脉瓣瓣膜置换:
患者体位为平卧位,给予患者常规全身麻醉,常规动静脉穿刺置管,并给予气管插管,进行机械通气。消毒,铺洞巾。准备工作完成后,与麻醉医师沟通,手术开始。通过胸骨角位置,确定胸骨中线,逐层分离至胸骨,电锯行胸骨正中劈开。正中胸骨切开术后,切开心包悬吊,暴露心脏。给予全身肝素化,准备建立体外循环。单纯主动脉瓣置换经升主动脉插动脉灌注管,右心房插入单房管建立体外循环。右上肺静脉置左心引流管,并行循环降温,阻断升主动脉并横切。主动脉瓣手术通过左右冠开口灌注冷血心脏停跳液。而后将冰盐水纱布及冰屑置于心脏表面,心脏停跳完全后,瓣膜线间断缝合,置换主动脉瓣或二尖瓣,观察瓣膜功能正常后,用4-0Prolene线连续双层缝合主动脉切口。复温,充分排出左心系统气体,开放升主动脉阻断。4-0Prolene线连续双层缝合右房切口。并行循环复温,还氧债。至生命体征平稳后,逐渐停止体外循环。检查无活动性出血后鱼精蛋白中和肝素,依次拔除CPB管道,放置心包、胸骨后引流管,彻底止血,逐层关胸。
二尖瓣瓣膜置换:
患者体位为平卧位,常规行动静脉穿刺置管,术区皮肤消毒,铺无菌单。前胸正中切口,纵劈胸骨,切开心包并悬吊。全身肝素化,常规建立体外循环,右上肺静脉置左心引流管,并行循环降温,阻断SVC、AAO、IVC,经升主动脉根部顺行灌注冷血停跳液,心脏表面覆盖冰盐水纱布及冰屑行心肌保护,心脏停跳完全后斜切右心房,纵切房间隔,缝置牵引线显露左心房,探查病变二尖瓣情况后,切除病变瓣膜,测瓣器测量后瓣膜线间断缝合,置换瓣膜,观察瓣膜功能正常后,3-0Prolene线连续缝合房间隔。复温,充分排出左心系统气体,开放升主动脉阻断钳,心脏复跳。开放升主动脉阻断。4-0Prolene线连续双层缝合右房切口。并行循环复温,还氧债。至生命体征平稳后,逐渐停止体外循环。检查无活动性出血后鱼精蛋白中和肝素,依次拔除CPB管道,放置心包、胸骨后引流管,彻底止血,逐层关胸。
2.4. 观察指标
采集患者临床资料,包括性别、年龄、身高、体重、BMI、糖尿病病史、高血压病史、心血管手术史、慢性阻塞性肺疾病病史、术前左心射血分数、术前有无心律失常、术前临床生化指标(肌酐、总胆固醇、谷丙转氨酶、谷草转氨酶、血糖、炎性指标、血钾、血镁)、血气指标及超声心动图结果。术中情况包括手术时间、主动脉夹闭时间、手术瓣膜数量、输血量失血量。术后情况包括是否发生心律失常、有无低氧血症、电解质、酸碱平衡、血液生化等指标。同时收集患者机械通气时间及ICU住院时间。术后常规进行生命体征监测,必要时予以床旁心电图或24 h动态心电图检查。术后心律失常均根据以上监测及心电图检查确定。
心律失常诊断标准:① 当早搏次数在24 h内超过100次,即定义为患者出现心律失常。② 窦性心动过速指心律超过100次/分的时间大于3分钟,窦性心动过缓指心律低于60次的时间大于3分钟。余心律失常按照内科学各心律失常心电图定义。
对同一患者发生多种心律失常,统计心律失常的种类数,不重复计例数;对于每一种类心律失常发生例数,单独计例数。
3. 结果
术后新发心律失常84例(43.3%),其中只发生1种心律失常70例(83.3%),同时发生2种心律失常21例(25%),同时发生3种心律失常4例(4.76%),同时发生4种心律失常1例(1.19%)。术后发生心律失常种类以心房纤颤最为常见(45例,23.19%),窦性心动过速16例(8.25%),偶发室性早搏16例(8.25%),房性早搏14例(7.61%),心房扑动14例(7.61%),频发室性早搏6例(3.09%),交界区心律3例(1.54%),房性心动过速、室上性心动过速各2例(1.03%),交界性逸搏1例(0.54%),恶性心律失常阵发性室性心动过速8例(4.12%);具体数据见表1。

Table 1. Arrhythmia types after surgery
表1. 心律失常术后种类
两组基线资料如下,术后是否发生心律失常的单因素分析显示,术后心律失常组的术后最低血钾值显著低于术后非心律失常组(P < 0.05);BMI (P < 0.001)、既往COPD病史(P = 0.036)、术前白细胞(P = 0.025)、手术时间(P < 0.001)及主动脉阻断时间(P < 0.001)、术后最高肌酐值(P = 0.014)、术后第一天(P = 0.019)及第三天白细胞(P = 0.037)均显著高于术后非心律失常组(P < 0.05)。组间比较其余指标差异均无统计学意义(P > 0.05);具体数据见表2。
注:#:卡方检验;▽:秩和检验。
我们采用二元logistic回归模型,将术后是否发生心律失常作为因变量,将入院BMI、术前白细胞、既往COPD病史、手术时间、主动脉阻断时间、术后最高肌酐值、术后最低血钾值、术后第一天和第三天白细胞共9个观察指标作为自变量作二元logistic回归分析。结果显示,我们发现了BMI、术前白细胞、既往COPD病史、主动脉阻断时间、术后最高肌酐值、术后最低血钾值共6个指标与术后发生心律失常之间具有显著相关性(P < 0.05)。见表3。

Table 3. Binomial logistic regression analysis
表3. 二元logistic回归模型分析
最后,我们将BMI与术后左心室舒张末期容积进行线性相关分析,散点图绘制结果如下:
Person相关分析结果显示,BMI与左心室舒张末期具有相关性,相关系数r = 0.03,P = 0.032,具体见图1,表明BMI与左心室舒张末期成正相关。
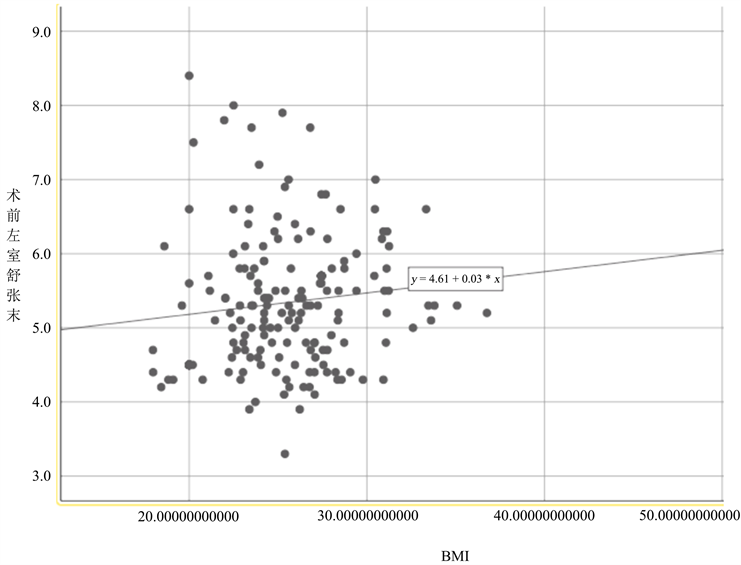
Figure 1. Pearson correlation analysis between BMI and left ventricular end-diastolic volume
图1. BMI与术后左心室舒张末期容积线性相关分析
4. 讨论
随着生活方式的改变,心脏瓣膜病获得了越来越多的关注。据研究表明,我国约有2500万心脏瓣膜病患者,每年约有8万台心脏瓣膜外科手术 [1] 。而其中瓣膜置换手术作为最常见,也是最重要的瓣膜病外科治疗方式,能有效改善患者预后,显著提高患者生存期。遗憾的是,瓣膜置换手术也有其不可避免的术后并发症制约着患者的生存率,其中心律失常作为最常见的术后并发症之一,与患者住院时间、术后死亡率息息相关。
4.1. 术前因素
在本研究中发现,BMI是导致瓣膜置换术后心律失常的独立危险因素之一。考虑与以下因素有关。当脂肪过度积累,充满了脂质的心肌细胞影响了心电活动 [8] 。Ademuyiwa S. Aromolaran等人在小鼠模型中发现,肥胖会导致动作电位(Action Potential Duration, APD)时程缩短,机制与肥胖导致了心肌细胞中Ik密度增加有关。当经历了瓣膜置换的手术后,高密度的Ik导致心肌细胞兴奋性提高,最终诱发心律失常。另外本研究发现,BMI值大的人,左心室舒张末期大小相应增大,BMI小的人左心室舒张末期大小相对减小,BMI与左心室大小呈相关性,推测BMI作用于心律失常的机制,也可能通过影响心脏功能或心脏失代偿导致。当心脏功能受损,心脏失代偿,心肌纤维环、心肌重构发生,导致心肌细胞电生理受到影响。在手术创伤刺激下,相比常人更易诱发心律失常。
尽管本研究中,年龄并非瓣膜置换术后的心律失常独立危险因素,然而迄今为止国内外文献研究中,高龄是所有有关心脏直视术后心律失常研究中一致发现的最有价值的预测因素 [9] [10] [11] [12] 。随着年龄增大,心肌细胞纤维组织增加。由Goette [13] 等人对接受了心脏直视手术的患者进行了右心耳活检,发现了高龄与较高程度心肌细胞纤维化有关。这种结构变化成为了发生心律失常的基础。本研究未体现出高龄带来的影响,考虑由于合并瓣膜疾病的患者往往伴有一定程度的心脏结构变化,进而影响心脏电生理,可能会掩盖年龄因素所带来的影响。
在本次研究中,患者既往慢性阻塞性肺炎病(Chronic Obstructive Pulmonary Disease, COPD)史常被认为是一个独立预测因子。本研究认为,COPD患者由于长期肺功能的缺失,血氧含量的下降,导致右心室及左心室顺应性下降,最终在瓣膜置换手术这一刺激下,比无COPD病史的患者更易诱发心律失常。除此之外,有研究认为COPD导致了交感神经兴奋、激活了氧化应激反应以及炎症反应,最终诱发了术后的心律失常 [14] 。
由于术前,机体循环内炎性标志物含量较低 [15] ,术前患者慢性炎症状态在术后心律失常的发生发展中往往被忽视。本研究发现术前白细胞含量是瓣膜置换术后新发心律失常独立危险因素之一。此处的炎性反应可能来源于全身炎性反应,如患者血脂异常或者糖尿病导致的血管炎性反应 [16] 。也可能来源于局部的炎性反应,如缺血性心肌病造成的心肌重构,理论上会造成心脏局部炎症反应 [17] 。
4.2. 氧化应激与炎性反应
本研究发现主动脉阻断时间是发生术后心律失常的独立因素。主动脉阻断时间增长对于行瓣膜置换手术的患者来说,意味着更严重的心肌缺血再灌注损伤。再灌注开始时,缺血再灌注的损伤即可发生。并持续至再灌注后数小时,甚至是数天的时间,对于本就长期处于瓣膜疾病的影响,受损的心脏功能打击是巨大的。而相比于其他危险因素,缺血再灌注往往更容易造成室性心律失常 [18] ,有动物试验证实,当患者发生缺血再灌注时,心室颤动的阈值明显降低,最终导致了缺血再灌注最主要的死亡原因 [19] [20] 。本文认为,由于心肌在主动脉夹闭的时间内缺血,心肌细胞暂时以厌氧反应供应ATP,最终导致了乳酸以及NAD+的积累,PH成酸性环境。此时细胞膜Na+/H+交换器(NHE)激活,胞内的H+离子排除,胞外Na+离子交换至胞内。与此同时,胞内高浓度的Na+离子通过Na+/Ca+交换为Ca+离子,最终导致了胞内高浓度的Ca+。而再灌注时,Ca+离子浓度会进一步加剧。Nauta RJ等人研究发现,术前在心肌停搏液中,加入Ca+离子拮抗剂可对于产生的缺血再灌注损伤产生保护作用 [21] ,也证实了本文观点。高浓度的Ca+离子最终诱导了心肌细胞凋亡,电生理重构,引发了心律失常。
除Ca+离子超载所诱发的心律失常以外,缺血再灌注所带来的活性氧自由基(Reactive Oxygen Species, ROS)同样也是造成术后心率失常的机制之一。ROS主要生成途径为缺血再灌注损伤 [22] 。而心肌细胞缺血时,心肌细胞抗氧化能力减弱,ROS大量释放。当ROS生成超过了心肌细胞抗氧化能力时,便会产生氧化应激反应。大量释放的ROS影响了线粒体功能 [23] ,这导致了再灌注时,心肌细胞进一步受损,引起心律失常增多。同时,高浓度的ROS可以诱导炎症反应,诱导心肌细胞坏死、凋亡。Anedda A等人研究发现ROS调节了多种信号通路及转录因子,导致了MAPK、NF-KB以及NRF2的激活 [24] 。同样ROS也造成了心肌细胞膜脂质过氧化,影响了其结构与功能。细胞膜通透性的改变,最终导致了心肌细胞结构功能的变化,电生理机制也因此受到影响,最终造成了心律失常。
现有研究普遍认为,炎性反应是导致术后心律失常的重要机制。体现在本研究中的便是手术时间成为了独立的危险因素。手术时间的延长导致了术后炎性反应的加剧。更长的手术时间意味着更多的手术操作,每次手术操作意味着一次创伤。结合本文另一个研究的因素也不难发现,术后白细胞的值同样也可以作为预测术后心律失常的独立危险因素,也体现了炎症在瓣膜置换术后心律失常中重要的作用。Liakopoulos研究发现 [25] ,术前给与一定量的他汀类药物,可以有效减少术后心律失常的发生率,这是由于他汀类的抗炎作用,同样也佐证了炎症是导致的心律失常一项重要的危险因素。常见炎性反应来源除手术所致全身炎性反应外,还包括心脏切口处局部炎性反应,以及体外循环(Cardiopulmonary Bypass, CPB)所致炎性反应等。本文认为其形成心律失常的机制不完全一致。全身性炎性反应导致术后心律失常机制有如下几种。一是炎性反应导致自主神经功能紊乱,通过神经–体液反应引起心律失常。Lazzerini等人在对类风湿病人研究时发现 [26] ,患有全身炎症病人,心律变异性(Heart Rate Variability, HRV)明显降低。HRV是机体自主神经主导的不规则心律,通常高HRV代表着研究对象处于更健康的状态,副交感神经主导着心律变化。当机体出现诸如焦虑、压力以及应激情况时,交感神经兴奋性增加,HRV降低,机体处于防御状态。这一研究也证实了在全身炎症影响下交感张力增加,诱发心律失常。二是炎性介质诱导了心肌细胞纤维化、坏死以及凋亡,影响细胞电生理,最终导致心律失常的发生。切口处局部炎性反应则是通过影响心脏传导不均匀性 [27] 。而CPB则是瓣膜置换手术不可或缺的工具,但同时也是造成心律失常的机制之一,现有研究认为,非CPB手术可以降低心律失常发生率 [28] 。本研究认为当CPB作为异物,激活了机体的炎性防御反应,最终诱导了心肌细胞的凋亡、坏死,影响了心肌电生理学,引起了心律失常的发生。虽然所激活的促炎因子不同 [15] ,但是殊途同归,都最终引发了炎性反应,影响了心肌电生理。
4.3. 肾功能损伤
尽管大量研究证实慢性肾脏疾病(Chronic kidney Disease, CKD),尤其是终末期肾病,由于慢性的液体容量超负荷、高血压以及肾素–血管紧张素–醛固酮系统(Renin Angiotensin Aldosterone System, RAAS)的激活,是术后心律失常危险因素之一 [29] ,但急性的肾脏损伤相关证据较为缺乏。本研究发现术后最高肌酐值是术后心律失常独立危险因素,这意味着急性肾功能的损伤与术后心律失常有一定关系。术后肾功能损伤的易感因素有很多,如高血压病史、糖尿病病史、高龄、高脂血症、CKD病史等。而术中ROS过多导致的氧化应激反应、术中损伤介导的炎性反应等最终导致了患者出现术后肾功能损伤 [30] 。本研究认为,当肾功能受损,肌酐含量增高,意味着肾小球滤过率下降,液体负荷量加大,增大了左心房压力,导致了左心舒张功能受损。而舒张功能受损则是心律失常形成原因之一。还有研究发现 [31] ,肾功能不全会导致左心低电压,造成传导速度降低,最终形成心律失常。另外还有一种可能的机制造成了出现肾术后功能损伤的患者罹患术后心律失常的可能性较普通患者高,那就是肾功能损伤所带来的炎性反应。Yasuyuki Iguchi在一项研究中发现 [32] ,给予肾功能不全的患者口服他汀类药物、血管紧张素转换酶抑制剂(Angiotensin-Converting Enzyme Inhibitor, ACEIs)以及血管紧张素II受体阻滞剂(Angiotensin Receptor II Blocker, ARBs)后发现,ACEIs以及ARBs的抗炎作用,不仅有助于保护肾功能,还减少了房颤的发生。尽管目前未发现炎性标志物的相关证据证明肾功能不全与术后心律失常之间的关系,但这对于我们未来研究手术后急性的肾损伤与术后心律失常关系的机制是一个启发。
4.4. 电解质及其他生化标志物
瓣膜置换手术术中及术后经常面对的酸碱平衡紊乱及电解质失衡同样也是造成心律失常的重要因素。本身心肌细胞的电生理,是通过心肌细胞膜的内外离子梯度差介导的,时间和电压依赖的电导变化。而电解质的紊乱,影响了离子浓度,导致了离子通道异常激活,进而破坏了离子内外梯度的平衡,最终造成了心律失常。细胞膜上离子通道类型种类复杂,一般认为主要有以下四种类型 [33] :电压门控离子通道、配体门控离子通道、牵张敏感性离子通道以及细胞器离子通道。其中供K+离子进出的通道是最复杂多变的,这是由于K+离子通道4个Alpha亚基都是由不同基因控制,构成了K+离子通道多样性,同时也影响着心肌电活动的不同方面。
本研究中可见低钾是瓣膜置换手术后心律失常的独立危险因素之一。游戏K+离子是胞内含量最大的阳离子,当细胞内K+离子含量降低时极大的影响了跨膜电位的形成,造成了心肌细胞兴奋性的降低,同时由于K+离子通道是电压门控的离子通道,低电压造成了K+离子通道的活性减弱,导致了整个动作电位时长的增长。且低钾降低了细胞电传导速度、增加心肌细胞自律性、有效不应期缩短、相对不应期延长等,这些机制可以引起快速性的心律失常,同时也可以解释低钾带来的两类心电图类型。当患者出现低钾血症时,早期的心电图变化往往理解为由低钾血症对复极化带来的影响所导致,患者心电图可示PR间期延长,可见U波出现,当严重低钾,即血钾K+离子浓度小于3.0 mmol/L时,可见T波U波融合现象,这在胸前V2、V3导联最明显。而到了晚期心电图变化,则认为时由传导异常引起,包括P波及QRS波的时限增加,P-R间期的轻度延长,以及房室传导阻滞,甚至是心脏骤停。最终,体现在患者身上,则是节律异常以及异位搏动的增加,Framingham的研究也证实了这一点,血钾浓度每降低0.48 mmol/L,患者发生室性早搏的概率将上升27% [34] 。同时低血钾也与房颤的发生有关系,一项针对253名手术患者的研究发现,术后低血钾与术后心房颤动风险增加相关 [35] ,这与本文数据观点一致。另外,低血钾所带来的传导速度降低,有效不应期缩短,容易形成折返性心律失常。
血镁当前也被认为是造成术后心律失常的危险因素之一。镁离子是在胞内含量仅次于钾离子二价阳离子,在许多基本生物过程中起着至关重要的作用,因为它参与了300多种代谢反应。在许多酶促反应中,镁与底物结合或直接与酶结合,从而改变其结构。同时作为非常重要的辅因子,参与多种心血管活动,例如心脏Mg2+敏感的K+通道。然而镁作为存在于细胞内的离子,其含量有时无法通过血清中镁离子的含量估算,造成“隐性低镁”的表现。镁导致心律失常的机制,本文认为有一下几点。一、镁是Na-K泵重要的辅助因子,镁的缺乏会导致Na-K泵活性降低,导致细胞膜内外电位的变化,并影响其他通道的活性,进而导致细胞电生理的变化。二、如前所述,由于镁调节部分K+离子通道活性,因此,缺镁可能导致细胞内外K+含量的变化,从而扰乱心肌细胞的静息膜电位并导致心律失常。目前已有研究发现 [36] ,静脉注射镁可以有效缓解室上行心动过速的发作,其机制是延长RR间期,减慢房室传导并恢复窦性心律。另外,镁也被用作伴有QT间期延长的尖端扭转性室性心动过速的治疗推荐用药。本文未显示血镁含量是造成术后心律失常的独立危险因素,考虑患者入院时以及在麻醉术中都会补充血镁含量,导致患者术后血镁较术前有上升,低镁带来的影响较为罕见。另一个原因如前所述,有时血镁含量无法真正反映胞内镁含量,往往出现“隐性低镁”的可能性,这让血镁数据的统计与最终结伦之间出现一定的误差。
5. 结论
我们回顾性分析了瓣膜置换手术术后导致心律失常的危险因素。这要求我们术前注意把握手术适应症,对于高危术后心律失常患者提前做好预防措施;术中注重心肌保护,避免过度操作;术后注意维持酸碱平衡,避免电解质紊乱,做好抗炎处理,监测患者生命体征,及时对症处理。
声明
该研究已获得病人知情同意,且所有作者均声明不存在利益冲突。
参考文献
NOTES
*第一作者。
#通讯作者Email: 2581511585@qq.com