1. 引言
急性痛风性关节炎是由尿酸钠晶体(MSU)沉积在关节或关节腔周围而引起的关节周围广泛的炎症性反应,是最常见的炎症性关节炎之一。痛风性关节炎急性发作的症状主要包括关节处的红肿、发热、疼痛,甚至可以导致关节功能的丧失 [1] 。研究表明,尿酸钠晶体优先沉积于第一跖趾关节、足中部、踝关节和膝盖 [2] 。痛风发作通常在7~10天内可自行消退,但是,随着时间的推移,长时间的高尿酸血症可导致炎症更频繁和更严重的痛风发作,甚至可导致关节畸形 [1] [3] 。目前,用于缓解痛风炎症和疼痛的最常用的治疗方法包括秋水仙碱、非甾体抗炎药(NSAIDs)、皮质类固醇,这些药物作用迅速,效果明显,但毒副反应大,常见恶心、呕吐、腹泻、过敏反应、皮疹和肾毒性及肝功能异常等,更有甚者会在患者中引起许多意想不到的副作用 [4] 。开发食源性、安全高效的消炎镇痛功效成分辅助治疗痛风性关节炎是未来研究的新方向。
壳寡糖(Chitooligosaccharide, COS),是壳聚糖和甲壳素通过化学水解或酶降解的主要降解产物,主要是由2~20个氨基酸通过β-(1-4)糖苷键连接的N-乙酰-D-氨基葡萄糖和脱乙酰氨基葡萄糖单元组成的生物聚合物。在过去的几十年里壳寡糖因为其具有水溶性好、容易被机体吸收和利用、抑制炎症反应 [5] 、神经保护、抗氧化 [6] 、抗肿瘤 [7] 、降血压、调节血糖 [8] 、抗衰老和提高免疫力等特性在生物医学、制药和农业领域中扮演重要角色。本研究通过向小鼠足垫内注射尿酸钠晶体诱发小鼠急性痛风性关节炎症状的模型来观察海洋活性物质壳寡糖抗痛风的作用。
2. 材料与方法
2.1. 材料
2.1.1. 实验动物
健康C57BL/6雄性野生型WT小鼠42只(6周龄,体重21~25 g)购于济南鹏悦,小鼠于青岛大学附属医院医学研究中心SPF级动物实验中心进行饲养。小鼠使用期适应环境一周,整个实验过程中给予普通饲料喂养。本研究涉及的所有动物实验均已通过青岛大学附属医院医学伦理委员会的审核批准(项目编号:QYFY WZLL 27753),所有实验过程均遵照《实验动物管理条例》的规定进行。
2.1.2. 实验材料
壳寡糖(山东海龙元生物科技有限公司,批号:2021041201,生产许可证号:SC13137078206130);秋水仙碱片(0.5 mg*20片,广东彼迪药业有限公司,批准文号:国药准字H20113208)
2.2. 实验方法
2.2.1. 尿酸钠晶体(MSU)的制备
称取0.25 g尿酸到广口瓶中加入45 ml的去离子水,再加入0.3 ml的氢氧化钠250℃搅拌机搅拌至完全溶解,直至都到无色透明溶液,用50 ml针筒,0.2 um滤膜,过滤后在25℃超净台中静置7天。7天后加入30 ml乙醇、30 ml丙酮3000 g离心2分钟,共离心3次后弃上清拧送瓶盖,铝盒平放,自然干燥21小时。
2.2.2. 急性痛风性关节炎模型的建立
将制备好的尿酸钠晶体溶于PBS中,配制成25 mg/ml的MSU混悬液,采用微量注射针将25 mg/ml,25 ul的MSU混悬液45˚方向注入小鼠足垫内,对照组小鼠足垫注入同样体积的PBS。且在实验前1周避免对小鼠剪趾等可能引起疼痛及炎症的操作。
2.2.3. 实验分组及具体方法
42只小鼠随机分成7组:对照组、MSU模型组、阳性药物对照组(0.5 mg/kg)、壳寡糖高剂量1组(1.6 g/kg)、壳寡糖中剂量组(0.8 g/kg)、壳寡糖低剂量组(0.4 g/kg)。连续给予上诉药物灌胃7天。为观察壳寡糖在MSU晶体诱导痛风性关节炎后的治疗给药效果,设置了壳寡糖高2剂量组(1.6 g/kg)。MSU诱导痛风性关节炎之前记录所有小鼠体重、测量每只小鼠右侧足垫厚度以及每只小鼠右足温度(测量位置一致),将小鼠放入热敏痛觉仪(49~51摄氏度)中,记录小鼠缩足、添足垫潜伏期,记录所有数据。
壳寡糖连续给药灌胃14天,第8天行MSU单侧后肢足垫MSU注射实验,壳寡糖高2组MSU刺激当天给药,注射MSU后0 h、3 h、6 h、12 h、24 h、48 h、72 h……连续7天用游标卡尺测小鼠右足垫厚度。测量小鼠足垫厚度时尽可能测量小鼠足垫的同一部位,为保证结果准确性,每一个时间的点每只小鼠足垫厚度可重复测量3次,取平均值。注射MSU后0 h、3 h、6 h、12 h、24 h、48 h、72 h对上述小鼠行热敏痛觉实验,记录小鼠缩足、舔足的潜伏期。注射MSU后0 h、3 h、6 h、12 h、24 h、48 h、72 h对上述小鼠行机械痛觉实验,记录小鼠缩足的机械痛阈值。记录注射MSU后0 h、3 h、6 h、12 h、24 h、48 h、72 h小鼠足垫处的温度。
2.2.4. 统计学方法
使用SPSS26.0软件包对实验数据进行统计分析和处理,两样本均数差别的比较采用独立样本t检验(Independent-Samples Test),多组样本均数的比较使用单因素方差分析(One-Way ANOVA),P < 0.05为差异显著有统计学意义,P < 0.01为差异极显著有统计学意义。实验数据均采用
进行描述表示。
3. 实验结果
3.1. 壳寡糖对尿酸钠致痛风性关节炎小鼠足肿胀的影响
在连续给药灌胃第8天后行小鼠右侧足垫MSU注射,壳寡糖高2组在MSU刺激当天给药。注射MSU后0 h、3 h、6 h、12 h、24 h、48 h、72 h……连续7天用游标卡尺测小鼠右足垫厚度。可发现:MSU晶体可明显引起小鼠足垫肿胀,且肿胀程度在48 h时达到最大(0.83 ± 0.14 VS 0.08 ± 0.05, P < 0.01)。与模型组相比,壳寡糖低剂量组小鼠足垫肿胀程度在24 h至144 h时均明显减轻(P < 0.05),高1剂量组在24 h、48 h、96 h、120 h、144 h时均明显减轻(P < 0.05),而MSU诱导痛风性关节炎后高2组小鼠足肿胀程度仅在96 h时明显减轻(0.37 ± 0.09 VS 0.51 ± 0.26, P < 0.05) (见表1,图1)。

Table 1. Effect of chitooligosaccharide surface on joint circumference of experimental gouty arthritis mice induced by sodium urate (mm,
, n = 6)
表1. 壳寡糖表对尿酸钠所致痛风性关节炎实验小鼠关节周径的影响(mm,
, n = 6)
注:与对照组比较##P < 0.01、#P < 0.05,与模型组比较**P < 0.01、*P < 0.05。
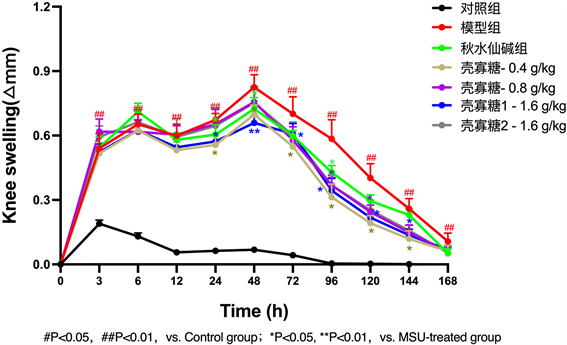
Figure 1. Effect of chitooligosaccharide table on joint circumference in experimental mice with gouty arthritis induced by sodium urate
图1. 壳寡糖表对尿酸钠所致痛风性关节炎实验小鼠关节周径的影响
3.2. 壳寡糖对尿酸钠致痛风性关节炎小鼠足肿胀处温度的影响
在连续给药灌胃第8天后行小鼠右侧足垫MSU注射,壳寡糖高2组在MSU刺激当天给药。注射MSU后0 h、3 h、6 h、12 h、24 h、48 h、72 h用红外动脉温度计测量小鼠足垫处的温度,结果可发现:注射MSU晶体后小鼠足垫肿胀处温度明显升高,且肿胀程度在6 h、48 h时达到最高(6 h时:35.13 ± 0.33 VS 28.07 ± 1.6,P < 0.01;48 h时:33.32 ± 2.71 VS 26.71 ± 1.71,P < 0.01),呈现双峰现象。与模型组相比,壳寡糖高1、高2、中、低剂量组小鼠足垫肿胀处温度在48h时均明显降低(P < 0.05) (见表2,图2)。

Table 2. Effect of chitooligosaccharides on temperature at the foot swelling of mice in each group after MSU stimulation (˚C,
, n = 6)
表2. 壳寡糖对MSU刺激后各组小鼠足肿胀处温度的影响(˚C,
, n = 6)
注:与对照组比较##P < 0.01、#P < 0.05,与模型组比较**P < 0.01、*P < 0.05。
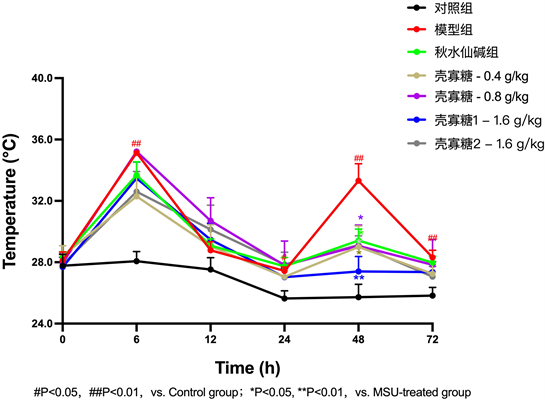
Figure 2. Effect of chitooligosaccharides on the temperature at the foot swelling site of each group of mice after MSU stimulation
图2. 壳寡糖对MSU刺激后各组小鼠足肿胀处温度的影响
3.3. 壳寡糖对尿酸钠致痛风性关节炎小鼠机械痛阈的影响
在连续给药灌胃第8天后行小鼠右侧足垫MSU注射,壳寡糖高2组在MSU刺激当天给药。注射MSU后0 h、3 h、6 h、12 h、24 h、48 h、72 h,将小鼠单独放置在高架网状地板上的透明有机玻璃房间里,并被试验前适应45 min后,用小鼠机械痛敏仪垂直施加力在MSU刺激后的足底中部表面,,用足够的力使细丝轻微弯曲3~5 s,观测小鼠右足的突然缩回、舔和剧烈摇晃的痛阈,结果可发现:1、注射MSU晶体后小鼠机械痛阈在6 h、12 h、24 h、48 h显著降低(P < 0.05),且在24 h将至最低(1.06 ± 0.44 VS 2.72 ± 0.86, P < 0.01);2、与模型组相比,给予壳寡糖灌胃后可显著缓解MSU诱导的机械疼痛(见表3,图3)。

Table 3. Effect of oligochitosan on the mechanical pain threshold at the foot swelling of mice in each group after MSU stimulation (g,
, n = 6)
表3. 壳寡糖对 MSU刺激后各组小鼠足肿胀处机械痛阈的影响(g,
, n = 6)
注:与对照组比较##P < 0.01、#P < 0.05,与模型组比较**P < 0.01、*P < 0.05。
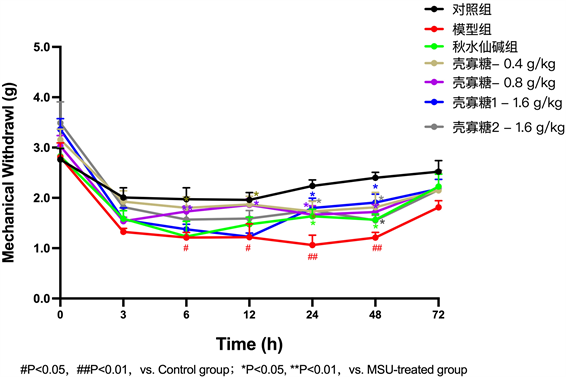
Figure 3. Effect of chitooligosaccharides on mechanical pain threshold at the swollen foot of each group of mice after MSU stimulation
图3. 壳寡糖对MSU刺激后各组小鼠足肿胀处机械痛阈的影响
4. 讨论
急性痛风性关节炎是尿酸钠晶体积聚于关节周围而引起的关节急性炎症性反应。尿酸钠晶体沉积于关节周围后可增加局部活性氧的产生和氧化应激、白细胞的浸润,特别是中性粒细胞的浸润;可释放IL-6和肿瘤坏死因子-α等促炎细胞因子,同时激活外周TRPA1和TRPV1通道等,从而引起关节和关节周围组织的炎症反应和疼痛 [9] [10] 。近年来,随着人们生活水平的提高以及饮食习惯的改变,痛风的患病率呈现出逐年上升且发病年龄越来越年轻化的趋势 [11] 。痛风发作的初期常常表现为急性痛风性关节炎的发作,常表现为患侧关节的红、肿、烧灼、剧痛且其疼痛难以忍受,甚至可导致行动受到限制,病情反复于1周左右可以自发缓解,但由于急性痛风性关节炎的发作常常为自限性,故相比于其他的慢性病常被人们忽视而没有积极治疗,但随着病程的进展其受累的关节关节炎持续时间也会逐渐延长甚至迁延不愈,并形成痛风石、出现关节畸形、肾脏损害、活动障碍等,最终发展为慢性难治性痛风 [1] ,因此对于急性痛风性关节炎的治疗显得极为重要。
壳聚糖是一种由β-(1-4)连接的N-乙酰-D-氨基葡萄糖和脱乙酰氨基葡萄糖单元组成的生物聚合物 [12] 。壳寡糖对免疫系统存在多元、多效性调节作用 [13] 。已经有研究表明,壳寡糖可以通过抑制NF-kB和MAPK信号通路来下调肿瘤坏死因子-α的水平、白细胞介素-6、诱导型一氧化氮合酶和环氧合酶-2的转录和翻译表达水平来实现抗炎作用 [14] [15] [16] 。梁瑜 [17] 等人通过给予大鼠踝关节注射尿酸钠晶体致大鼠踝关节肿胀结果发现关节肿胀度12 h达高峰后随着治疗时间的延长肿胀逐渐恢复,其中高剂量组于72 h后关节肿胀度尚低于秋水仙碱组,表明壳寡糖可以有效抑制尿酸钠所致大鼠的踝关节肿胀。梁瑜等人通过给予大鼠腺嘌呤以及乙胺丁醇灌胃构建大鼠慢性痛风性关节炎模型实验发现壳寡糖可以减少大鼠肾小管内MSU以及炎性细胞的浸润,减轻肾小管的损伤 [18] 。
本研究通过向小鼠足垫内注入MSU建立急性痛风性关节炎模型,注射PBS组小鼠足肿胀程度在3小时基本恢复正常,造模各组小鼠关节软组织周围水肿明显,关节周径均有增加,且在48小时时达到高峰,其中模型组最为明显,与临床急性痛风性关节炎发作基本一致,痛风性关节炎模型构建成功。采用红外温度计、机械痛仪、小鼠热敏痛仪监测小鼠痛风急性发作时期关节红、肿、热、痛等症状;发现给予壳寡糖灌胃后的小鼠足肿胀程度、肿胀处的温度、肿胀处的机械疼痛与模型组相比均有不同程度的下降,且在足肿胀程度实验中可发现与模型组相比,给予壳寡糖干预后壳寡糖低剂量组足垫肿胀程度在24 h至144 h时均明显减轻,高1剂量组在24 h、48 h、96 h、120 h、144 h时均明显减轻,而MSU诱导痛风性关节炎后壳寡糖高2组小鼠足肿胀程度仅在96 h时明显减轻。本研究结果与梁瑜等人研究结果一致。测量足肿胀处温度结果发现注射MSU后,温度可出现双峰现象,与模型组相比,壳寡糖干预后,在48 h时COS高1、高2、中低剂量组温度均较模型组低(P < 0.05)。在观测壳寡糖对尿酸钠致痛风性关节炎小鼠机械痛阈的影响结果可发现与模型组相比,给予壳寡糖灌胃后可显著缓解MSU诱导的机械疼痛。表明壳寡糖可有效抑制MSU所致的小鼠关节肿胀、显著减轻痛风性关节炎急性发作时的关节红肿热痛及功能障碍。本实验结果表明小鼠足垫内注射尿酸钠晶体可以成功诱导小鼠急性痛风性关节炎模型,壳寡糖在小鼠急性痛风性关节炎模型中可抑制急性痛风性关节炎的发作。