1. 引言
我们在全面迈向21世纪的同时,生物学发展也在不断进化。有关褪黑素的研究从20世纪五六十年代开始逐渐深入,范围不断扩大,研究技术日益先进,研究不仅限于人和动物,慢慢向植物、微生物等各个种属逐步延伸,也有越来越多更为严谨的实验数据作为支撑。随着社会发展,我们的研究早已不仅仅局限于发现褪黑素的存在或初识它的性质功能,而是致力于研究如何将他应用于生活中发挥作用。虽然褪黑素的研究起始于动物,然而随着研究的深入,发现植物中的褪黑素含量较动物更高,且作用更大。从研究中获悉,褪黑素除了可以对自身发挥广泛且重要的生理作用外,还拥有很强大的营养功能和药用价值,所以说不同植物组织中褪黑素适量积累非常重要。为了使褪黑素的功能得到充分利用,褪黑素已慢慢渗透到生活中的各方各面,将其开发成产品应用到食品保鲜、医疗卫生、健康保健等领域,因此人们开始广泛关注植物中的褪黑素有关信息。随着越来越多对褪黑素的研究,人们不仅研究了植物中褪黑素的特点,还包括合成途径、合成部位、含量变化及影响因素、生理功能等,催化褪黑素合成途径相关的基因也正在得到相继克隆表达。
2. 褪黑素概述
2.1. 褪黑素的发现
褪黑素(Melatonin,简称MT),最初是由Yale University的皮肤专家Lerner第一次从牛(Bovini)的大脑中的松果体组织匀浆中分离并提取出来的一类吲哚激素。经过观察发现该激素还可以令皮肤黝黑的青蛙和其他两栖动物体内的黑色素凝集从而致使皮肤颜色变浅,故称之为“褪黑素”,这即是褪黑素的来历 [1] 。后来Lerner等人鉴定了其化学结构,证明了它是色氨酸的衍生物(图1)。
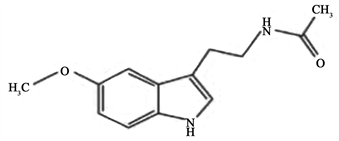
Figure 1. The chemical structure of melatonin [2]
图1. 褪黑素的化学结构 [2]
褪黑激素的分子式为C13N2H16O2,分子量约232.27,熔点在116℃~118℃上下,化学名称为N-乙酰基-5-甲氧基色胺(N-acetyl-5-methoxytryptamine, MT)。最开始认为褪黑素只存在于人和动物中,由松果体产生后分泌到脑脊液和血液中,在动物和人体中发挥重要功能,比如可参与调控生物体白天和黑夜的交替,改善睡眠质量,调节性行为和视网膜状况,改善生物体的免疫力,减慢机体衰老,辅助治癌抗肿瘤等,已被开发成产品并大量应用于人类保健行业,为医疗事业做出重要贡献。直至Blazer等从藻类中评估并分离出了褪黑素,才明确了天然褪黑素也存在于植物界,后来随着继续深入研究,发现褪黑素是一种广泛存在的小分子物质,不仅限于人和动物体内,相反它存在于绝大部分有机体中,包括动物、植物、细菌、真菌、微生物、藻类等 [1] [2] 。
2.2. 植物中褪黑素的研究进展
关于褪黑素的研究程度在不同物种之间是完全不同的。动物体内的褪黑素的合成位点及合成途径早已研究的比较清楚透彻,相较而言,植物体内褪黑素的研究则起步较晚。直到1993年,Van Tassel和O’Nill才首次利用RIA和GC-MS在高等植物牵牛花(Ipomoea nil)中检测到褪黑素,随后1995年,Dubbels等人通过RIA和HPLC-MS技术检测到包括番茄(Solanum lycopersicum)、香蕉(Musa × paradisiaca)、香烟(Nicotiana tabacum)、苹果(Malus pumila)在内的很多植物中都有褪黑素的存在 [1] [3] 。这几个研究结果的发表为植物中褪黑素研究打开了大门。到2009年,科研人员已经在140多种植物的根、基、叶、果实、花、种子等不同器官中均发现了褪黑素,且检测时利用的方法技术也不断改进,包括RIA、HPLC、LC-MS、GC-MS、ELISA、IAC等。还有很多研究下显示,褪黑素几乎存在于所有植物和相关制品中例如,褪黑素经常出现在各种蔬菜水果、中草药以及玉米,水稻,麦子等经济作物 [4] 。
2.3. 植物中褪黑素的含量
虽然现已有大量研究证实几乎所有的植物甚至相关制品中均含有褪黑素的存在,但其中的含量却有很大差异。褪黑素含量在不同品种、不同部位、不同发育阶段、不同的外界环境(如地理位置、生长环境及收获时间等)中都会有很大差异。此外,检测所用的技术也会影响测定植物中褪黑素含量时的准确性 [1] (如表1)。

Table 1. The content of melatonin in different plants
表1. 不同植物中褪黑素的含量
2.3.1. 不同环境下植物中褪黑素的积累
就外在环境而言,光照和温度是影响褪黑素合成的尤为重要的因素。据报道,很多植物褪黑素也和动物一样有昼夜节律的现象,在这一方面也已经有了很多实验结果证明确实如此。比如,凤眼兰在光周期生长中褪黑素含量不断升高,若将植株转移至黑暗环境下,褪黑素的含量明显下降;对不同长势的苹果进行检测,也有一定规律:成熟于树冠外围的苹果果皮中褪黑素含量高于内侧的,相比于生长在西北方向的苹果,那些结在东南方向的苹果由于接受光照更充足因而其果皮中褪黑素更多;当然并不是褪黑素含量在所有植物中都与光照呈正向关系。研究发现,短花期植物红叶黎也有昼夜节律性,不过和上述结果相悖,红叶黎中褪黑素积累巅峰集中于夜间或黑暗处理的4~6时,在白天或光照期几乎检测不到褪黑素或者只是维持在一个很低的水平 [5] 。因此,种种实验表明,大部分植物中褪黑素的积累对光照均有一定程度的敏感性,或是在光照时明显上升,或是在阴暗处积累的更多。当然也不免有的植物不存在昼夜节律的现象,比如芦荟、贯叶连翘等。
2.3.2. 不同种类植物中褪黑素的含量
研究表明,植物中褪黑素含量的多少很大程度上是由其基因型决定,不同的植物品种中褪黑素的含量具有很大差异。据资料显示,一般中草药中的褪黑素含量较高,例如褪黑素在金丝桃中可达4.3 ug/g;其次,在一些禾本科作物中褪黑素的含量也较高,例如水稻、玉米等;而在西红柿、香蕉、甜菜根等植物中含量较低,仅pg/gFW级别 [6] 。
2.3.3. 同一植物不同发育期的褪黑素含量
褪黑素与植物的生长发育状态有着十分紧密及关系,植物褪黑素含量在不同生长时期有很大差异。果实成熟度会影响褪黑素积累,比如番茄从青涩期到透红期完全发育成熟一般要经历六个过程,其褪黑素含量是逐渐升高的;还有樱桃果实,它的褪黑激素在胚胎发育和内果皮木质化阶段处于含量顶峰 [5] ;2013年,Lei等对苹果果实发育各个阶段的褪黑素水平变化进行了研究,发现在种子幼嫩期和果实膨胀期中较高,但是随着种皮木质化和果实逐渐成熟其含量反而减少;再比如曼陀罗花芽分化过程,随着花芽不断发育,褪黑素含量在减少。通过这些研究结果均可看出植物中的褪黑素含量与其生长发育时期有着密切关系。
2.3.4. 同一植物同一时期不同组织部位的褪黑素含量
褪黑素在每一植物中的各个组织均有分布,然而不同部位的含量不仅相同。一般情况下,褪黑素含量由高到低为:种子 > 叶片 > 根 > 花 > 果实,当然这并不是所有植物一定遵循的固定规律。
2.4. 植物褪黑素的性质
大量研究表明,褪黑素具有抗氧化能力。早在上世纪90年代就已经证明褪黑素是目前证明的最强的自由基清除剂和抗氧化剂,它可以去除有机体内大部分的活性氧自由基和活性氮自由基;它具有很高的亲脂性,较容易穿过高脂质的生物膜,可减轻羟自由基(OH)、超氧阴离子(O2−)、过氧亚硝基(OONO−)、过氧烷自由基(ROO)及单线态氧(O2)等含量 [7] [8] ;另外它还具有可以自由通过细胞膜、细胞质进入细胞核、线粒体的部分亲水性,因此可以很好的发挥抗氧化作用。通过分析其合成代谢过程,发现褪黑激素的代谢产物也可以清除自由基,这便是褪黑素与自由基之间进行一系列级联反应的结果。实验证明,与传统的抗氧化剂相比,褪黑素的抗氧化能力更强,它清除OH的能力大约是还原型谷胱甘肽(GSH)的4倍,是甘露醇的14倍,清除ROO的能力大约是维生素E (VitE)的2倍,很大程度上可以保护植物免受氧化损伤 [8] 。
2.5. 褪黑素的功能研究
经过对褪黑素的深入研究,发现无论是动物还是植物褪黑素,无论是内源还是外源补给褪黑素,都具有重要的生理作用。
2.5.1. 调节植物生长发育
褪黑素被认为起到植物发育调控物和生物兴奋剂的作用,并且发现褪黑素具有与生长素类似的化学结构和生理作用。植物中的褪黑素可诱导侧根和不定根的再生,促进离体细胞的膨大等,多次以金丝桃、羽扇豆等为材料进行外植体再生培养的实验均已证实。同时,褪黑素发挥作用时也具有IAA典型的两重性,Arnao、Murch等人使用一系列溶液浓度呈梯度配制的褪黑素和生长素中进行培养黄化羽扇豆的下胚轴,一段时间后观察并记录结果发现,在一定浓度梯度范围内,低浓度的褪黑素和生长素均可以刺激羽扇豆下胚轴生长,而两种激素的高浓度水平也都会引起相反的抑制作用 [5] ;2001年Murch等人以贯叶连翘作为外植体材料进行培养 [9] ,Virginia等对樱桃体外芽尖诱导生根进行实验,均有类似的发现,即低浓度褪黑素有利于不定根生成,而高浓度褪黑素会对生根有害 [2] 。目前,褪黑素在植物生根中起促进作用的报道越来越多,也在更多的植物(如水稻、辣椒、黄瓜以及豆类植物)中得到证实。
褪黑素除了促进不定根和侧根再生之外,还可以促进种子萌发率 [2] 。最初是由Posmyk等在2008年发现,利用红球甘蓝的种子为实验材料,选择干湿状态、大小等生理状态相似的种子分成若干等分,将其分别浸入含有浓度为1、10、100 μmol/L褪黑素的溶液中进行水引发处理,对照组为无水引发或者只进行纯净水处理,将其置于相同条件下进行培养,观察记录结果发现:对照组(无水培养)的种子发芽率为71.7%,红甘蓝(仅用水溶液处理)的种子发芽率为80.8%,而添加了1、10、100 μmol/L褪黑素的三种溶液中的种子发芽率分别为88.3%、87.5%、73.8%;Posmyk又对黄瓜进行渗透引发处理,发现加入25~100 μmol/L的褪黑素后,低温条件下黄瓜种子的萌发率可上升到98%,而不加入外源褪黑素的分组的萌发率仅有30%。因而证实了适当浓度的褪黑素的确可以提高种子发芽率,并且当时的研究学者认为之所以褪黑素发挥该作用是由于褪黑激素具有亲水和亲脂的两亲性质,可以轻松的进入植物种子内部并具有抗氧化能力,因此可以保护种子中的脂质免受氧化的损伤,从而提高其活力和萌发率。
2.5.2. 提高植物抗逆性
现在已经确定可将植物MT视为良好的内源性自由基清除剂,可直接去除OH、H2O2、ONOO−、NO、LOO、O2等ROS和RNS自由基,且它的抗氧化性相比维生素C、维生素E和谷胱甘肽等是最强的。褪黑素不仅是自由基的内源掠夺者、捕获活性氧(ROS)和其他自由基,还可以通过调节抗氧化系统的酶,如过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)及其他酶的活性,或提高相关基因转录水平,或增加相关抗氧化物质的含量,或参与多胺及其他物质的合成,成为植物抵御外部损害的第一道防线 [4] 。
正常自然环境下,植物的生长将不可避免地遭遇各种生物或非生物胁迫,例如病虫害就属于生物胁迫,非生物胁迫是指干旱、高温、低温、盐碱、重金属、化学物质、紫外线、电离辐射等,这些因素毫无疑问会对植物生长造成严重影响。近年来,科学家们发现,由植物自身合成的褪黑素和外源性褪黑激素均可提高植物适应不良环境的能力。
(1) 抵抗干旱、盐碱逆境的胁迫
充足的水分供给是植物正常生长代谢的基本前提,任何植物一旦缺水处于干旱环境下生长,将会导致产量下降。Zhang等对黄瓜进行研究,发现施加了外源褪黑素之后可以很大程度上减轻因为聚乙二醇对黄瓜种子的渗透负荷产生的抑制发芽效果,同时还可以刺激根系生长和根系吸水能力,打开气孔,加快蒸腾作用,保持体内水分平衡,维持正常生理代谢活动 [10] 。2018年李爱等人研究了褪黑素对紫苏在干旱胁迫下生长代谢状况的影响。将实验对象紫苏幼苗喷施不同浓度的褪黑素处理后培养在10%聚乙二醇-6000 (PEG-6000)营造的干旱逆境中,栽培一定时间后,分别测定每个相关指标进行分析。数据显示,紫苏幼苗生长状况在假造出来的干旱逆境下受到了严重抑制。但是当在该干旱胁迫下使用100 μmol/L褪黑素时,紫苏幼苗相对含水量与10% PEG-6000环境下相比明显上升了4.56%,此时达到顶峰状态;当褪黑素浓度为300 μmol/L时,幼苗叶片长和宽的比值也近乎最大,与仅在干旱环境中未使用褪黑素时相比升高了9.16%,超氧化物歧化酶的活性被大大激活,而在营造的干旱境况下至少要降低8.5%;同样干旱处理,若紫苏幼苗中使用500 μmol/L褪黑素后,丙二醛含量与10% PEG-6000干旱处理相比明显降低了43.92%,几乎为最小值;而过氧化物酶的酶活力与MDA相反,它大约上调了26.8%达到最大值,另外与没有褪黑素时相比可溶性蛋白含量降低8.52%成为最小值 [11] 。这些数据均表明,在干旱逆境中,褪黑素在一定程度上可以起到他提高植物抗氧化能力的作用,减轻干旱胁迫造成的氧化损伤,保持正常稳定的光合速率,保证植物正常生长代谢。
植物生长发育也受土壤状况的影响,过多的盐离子会给植物带来巨大损害,包括但不仅限于离子中毒、渗透或氧化威胁 [12] 。生长在高盐土地中的植物体内维生素、可溶性蛋白等含量均会变多以控制渗透作用。另外,Li等对盐胁迫下的湖北海棠进行研究,发现施用1 μmol/L外源褪黑素的时候可保护植物叶片中的叶绿素,保证海棠进行正常的光合作用,减轻海棠生长受抑制的程度。同时研究发现,褪黑素含量升高减轻盐胁迫下湖北海棠受伤害是通过不同的机制实现的,或是作为自由基清除剂直接消除H2O2等;或是通过提高抗氧化酶活性;除此之外,还发现可以提高海棠叶片中MdNHX和MdATK1基因的表达水平,说明褪黑素可调控NHX基因表达水平,Na+/H+反向转运蛋白(NHX)可将多余的Na+留液泡内,即通过盐离子区隔法来降低胞质中的高水平Na+,防止高含量的Na+对代谢酶有毒,从而起到提高植物耐盐性的作用。
(2) 抗低温和高温逆境
低温环境也是影响植物生长代谢的重要因素。Tan等人在20年前将种植于常温25℃下的芦荟转移至低温4℃一段时间后,发现褪黑素含量增加,推测植物中的褪黑素可以抵抗低温胁迫。04年Lei等在低温下培养提前用褪黑素处理的胡萝卜,取适量制成细胞悬浮液检测,发现在此低温环境下也可以保持细胞完整性,降低胡萝卜悬浮细胞的凋亡,但在此过程中细胞内活性氧(ROS)自由基并未明显减少,表明褪黑素抗低温的机制并不是通过直接清除自由基而发挥作用的。随后张贵友等人又开始进一步研究,将实验对象烟草制成的悬浮细胞加入褪黑素预处理,转接在含有0.6 mg/L 2,4-D的MS基本培养基中,先于26℃下培养5 d,再将温度控制在2~4℃培养烟草悬浮细胞,每48小时取样一次,用台盘兰染色法测定细胞死亡率。他们发现在低温下经褪黑素处理的烟草悬浮细胞与未经褪黑素预处理的对照组相比,实验组存活率更高,而发挥该功能的原理是因为褪黑素可以增强细胞中精氨酸脱羧酶的活力。据资料得知,游离多胺合成的关键酶其中之一便是精氨酸脱羧酶,在大部分高等植物中,多胺遇到各种逆境特别是低温会变得非常敏感,容易使细胞膜结构遭到破损,这也是植物遇冷害导致减产甚至死亡的根本原因,因此得出结论褪黑素抗低温主要是通过参与多胺的合成来调节植物抵御冷害的能力 [13] 。
伴随着全球气候日益变暖,各种植物不仅受到低温胁迫,高温逆境也会给植物带来巨大损害。徐向东等人向高温胁迫下的黄瓜幼苗注射50~100 gmol/L外源褪黑素,经过一段时间的培养后,测定叶片中的抗氧化酶系酶活力及抗氧化物质变化。分析结果发现,喷施褪黑素后的确可以提高黄瓜幼苗的高温耐受性,该过程主要是通过提升抗氧化剂如抗坏血酸和谷胱甘肽的含量或者激活与抗氧化反应相关的酶(APX,GR等)活性,并减少自由基(ROS)的生成,以保护细胞膜的稳定性并最终提高植物对高温的抗性 [10] [14] 。
(3) 抗重金属、化学物质氧化胁迫
由于现代生活中人类频繁的工农业活动导致土壤中有越来越多的重金属,例如Cu、Zn、Cr、Hg、Pb、Cd等,尽管铜和锌对于维持植物的正常生长非常重要,但是任何事情都是过犹不及的,植物蛋白质和酶结构中富含巯基基团,铜或锌过量后会与其结合,破坏蛋白质高级结构并使降低甚至丧失酶活性,损害植物的生长发育。早期,一些科学家了解到褪黑素及其合成前体都会一定程度上与Al,Cu,Cd或其他过量金属离子强结合,从而减轻金属离子对植物结构组织和蛋白质、核酸、脂质等生物大分子的破坏。Tan等(2007)研究发现向栽种在含有高浓度铜离子土壤中的豌豆施用外源褪黑素,豌豆成活率升高,故认为褪黑素可以提高植物修复重金属污染土壤的能力。。近几年,越来越多的研究表明,在重金属Cd,Pb,Zn等的压力下,藻类中褪黑激素的含量均可以增加,并且认为外源性褪黑激素减轻重金属胁迫对植物的破坏主要原因可能是用作抗氧化剂发挥作用 [4] [10] 。
(4) 抗紫外、电离辐射氧化胁迫
近年来,植物长期生长在强紫外线、电离辐射环境下,其形态结构、生长代谢必然受到不良影响。经研究发现,在UV-B辐射加强的条件下,水葫芦中的褪黑激素含量明显增加;另外,还研究了甘草根部在不同强度紫外辐射胁迫下体内的褪黑素含量变化情况,结果发现,分别经过3天强紫外线照射和15天弱紫外线照射的甘草根相比,前者甘草根部的褪黑素明显高于后者。随后,又有研究人员针对褪黑素在UV-B辐射下对植物起保护作用的原理进行研究。以绿豆幼苗为实验材料,在强UV-B辐射下进行培养,检测发现其叶片内POD、SOD、CAT、APX等抗氧化酶活性以及丙二醛含量均升高;但是若在UV-B强辐射的基础上再施用外源褪黑素复合处理时,会降低仅由强UV-B紫外线照射引起的丙二醛含量和一系列抗氧化酶活性升高 [15] 。这些实验结果均表明UV-B等辐射会对植物造成不同程度的氧化胁迫,产生过盛的自由基,引起植物细胞质膜过氧化,影响植物正常的生长代谢,而褪黑素具有抗氧化性,恰好可以在一定程度上减轻紫外等辐射胁迫对植物造成的损害。
2.5.3. 维持细胞膜的完整性,防止叶绿素的降解
在上述提到的干旱、高温、低温等逆境下,植物遭受的不同程度的损害往往是因为细胞结构尤其是细胞膜和生物大分子等受损,使得植物生长发育停滞造成严重减产,此时褪黑素可以防止质膜与核膜破裂,保证细胞膜良好的流动性,起到保护细胞膜的作用。与此同时,细胞膜还可以保护叶绿素。Arano等人对大麦叶片施用1 mmol/L褪黑素,发现该处理可有效缓解叶绿素的流失;2011年徐向东等人也选取黄瓜幼苗对其进行了相关研究,结果表明,高温逆境会导致黄瓜幼苗叶片中的净光合速率(Pn)下降,而细胞间CO2浓度(Ci)、气孔开放程度(Gs)和蒸腾速率(Tr)均会升高;但是外源补给褪黑素后,这些数据都发生了显著变化,其中Pn、Gs、Tr先升高后直线跌落,而Ci呈先减少后增加的相反趋势;再分析叶绿素荧光参数,得出结论,黄瓜叶片的原初光能转化效率(Fv/Fm)、PSⅡ反应中心电子传递效率(ETR)以及叶绿素含量等都明显减少,这也是植物叶片光合速率Pn下降的主要原因,同样经过褪黑素处理后再检测这些变量水平,明显可以看出Fv/Fm、ETR、叶绿素含量等得到提高,光合速率Pn也升高,该实验表明褪黑素可以减少叶绿素降解,保证植物正常的光合速率,延缓植物叶片衰老 [4] [14] 。
2.5.4. 调节植物的昼夜节律、光周期和发育繁殖
研究发现,植物中的褪黑素含量变化有着和动物体内类似的昼夜节律性。在短日照植物红叶黎(Chenopodium rubrun)中,褪黑素通常在光照开始前4~6小时之内达到顶峰,然后迅速下降,在黑暗时期结束之前恢复到最小值,且在光照阶段一直保持较低水平,因此褪黑素含量呈现昼夜节律,暗期较光期多 [2] 。
褪黑素参与调节植物的光周期,毫无疑问这种现象会影响植物开花,不过褪黑素影响的是开花幅度,而不影响开花时间。Kolar等向红叶黎喷施100 μmol/L和500 μmol/L不同浓度的外源褪黑素并进行12 h黑暗处理,可使红叶黎的开花率从82%分别降至61%、48%,不过需要保证在光期完毕前或者刚开始黑暗处理阶段才可有效发挥褪黑素抑制开花的作用,这表明褪黑素可以影响植物开花信号的早期传播 [6] 。
早有研究表明,动物体内的褪黑激素可作为一种信号分子调节促性腺激素的分泌,促进动物产卵受精;同样植物中的褪黑素也可以起信号传导分子的作用促进植物繁殖。研究报道,在金丝桃小孢子发育中,褪黑素含量呈递增趋势,巅峰时期出现在单核小孢子发育阶段。因此,褪黑素可通过影响小孢子发育进而调节花、种子等生殖器官的发育,促进植物繁殖;另外,褪黑素还可起到类似开关的功能,引诱植物从有性繁殖转变为无性繁殖 [2] 。
2.6. 褪黑素的应用
在了解清楚其强大的生物学作用基础下,如何将褪黑素应用到各行各业才是至关重要的。随着关于褪黑素的研究不断深入,发现它不仅可以保护植物免受外界不良环境的迫害等,更重要的是因为褪黑素本身具有抗氧化性,可清除自由基、调节抗氧化酶活性等,因此可以MT被开发应用到各个行业领域,具有广阔的发展前景。
2.6.1. 在生理药理方面的应用
相比于植物,实际上人们对褪黑素在人体和动物中具有的功能了解的更清楚深入。研究表明,褪黑素在人体中起着强大的生物钟的作用。褪黑素有一个很重要的作用是被认作是一种内源性同步因子,延缓机体衰老,增强老龄化后的免疫系统功能,提升免疫力和睡眠质量,并且已证实使用后无安定类药物的副作用。到目前为止,全球已有数百万人长期服用褪黑激素或有关制品,因此,将来我们很可能应用基因工程手段增加植物褪黑激素的含量,从而更好的人类健康做贡献。
2.6.2. 在临床医学方面的应用
褪黑素具有很强的药用价值,近年来越来越多的褪黑激素得以开发应用于疾病治疗,为医疗健康事业做出重要贡献。最值得一提的就是褪黑素可以调节生长因子的分泌,促进癌细胞衰亡、维持正常细胞的存活或减缓癌细胞的生长和扩散速度,起到抗癌的作用;也可以作为辅助治疗癌症药物,配合常规治癌药物使用可以达到增强疗效同时降低副作用的效果。
除了抗肿瘤,褪黑素还可以用于很多其他疾病的治疗,比如防治阿尔兹海默症(AD)、帕金森症(PD)等老年性疾病,稳定癫痫病的发作频率;另外,褪黑素还可以降低血脂,减少冠心病的发作,防治高血压进而保护心脏;褪黑素有预防糖尿病的功能 [16] 。
2.6.3. 在农作物生产中的应用
就褪黑素的生物学作用而言,一方面他可以通过促进生根、减慢叶片老化、保证农作物正常的光合速率等方式来调节作物生长发育;另一方面,褪黑素具有强大的抗氧化性,它可以通过减少活性氧等自由基、调节抗氧化酶的酶活力、参与相关基因表达等途径来抵挡外界恶劣环境,增强植物的抗逆境能力,因此现在大部分研究重点会集中于运用转基因技术等现代育种手段提高植物的内源褪黑素含量,从而可以增加农作物产量和产品质量。
2.6.4. 在畜牧业生产方面的应用
褪黑素可以通过调节小孢子的发育植物繁殖,当然也可以影响动物繁殖。近年来,褪黑素在畜牧业上的应用不断推进。研究表明,给季节性动物增加外源性褪黑激素的水平可以影响其生殖活动,褪黑激素可以抑制长时间日照繁衍动物的性行为,但是有利于短日照繁殖动物的性活动;在非季节性动物中,褪黑激素的分泌通常呈季节性变化。生活中,使用一定量的褪黑激素可提高母鸡体内的雌二醇激素水平并增加产蛋量,也可以通过调节猪、牛、羊等家畜的发情期、刺激卵母细胞的发育、提升精子质量等方式从而促进畜牧业的发展。
2.6.5. 在食品开发及保鲜方面的应用
功能性食品是近几十年来发展起来的一种新食品,是一种具有生理控制功能的加工食品。目前研究逐渐活跃,褪黑激素的应用范围和功能治疗效果已大大超出。目前,国内外由褪黑激素开发成的功能食品的主要呈现形式有① 常用的口服液、含片、颗粒冲剂、胶囊等;② 国外正在研发的微球,微胶囊,缓释/控释片剂,显然后者较为理想 [17] 。褪黑激素具有改善睡眠、镇静安神等多样且重要的生理和药理功能,很多国内外专家学者都对这一事实高度评价。美国食品药品监督管理局(FDA)已承认褪黑激素的确可以被认作常见的膳食补给物,而中国卫生部也批准将20多种含褪黑激素的产品用作改善睡眠的保健食品 [2] ,如脑白金胶囊。尽管褪黑素已被广泛应用到保健食品中,但是被用作食品添加剂的研究还不够深入,不过当前已在各种水果,饮料和粮食谷物等其它制品中检测到高水平的褪黑素,当人们定期食用这些食物时,可以在一定程度上起到补充外源褪黑激素的效果,且不会产生依赖性、成瘾性等副作用,对人类健康极为有益。
另外,随着人们生活水平日益提高,对日常的蔬菜水果甚至切花等领域的保鲜工作要求越来越严格。而褪黑素作为一种天然物质,恰好可以通过避免氧化损伤、保护细胞膜不破裂、调控果实成熟、延缓衰老等作用对这些园艺产品进行良好的保鲜处理,近年来关于褪黑素在这一领域的报道也陆续展开,进一步拓宽了褪黑素在植物领域的应用范围 [18] 。
3. 植物中褪黑素的合成代谢
3.1. 植物褪黑素的合成
众所周知,关于褪黑素的发现和研究均起源于动物,并且起初认为褪黑素是动物体内特有的物质,后来才发现各种植物、藻类等绝大多数生物有机体中也都含有大量褪黑素。近年来,有关植物褪黑素合成规律的研究报道也越来越多,研究更加深入,为更广泛的应用奠定基础。
3.1.1. 合成场所
由于褪黑素具有较高的水溶性和脂溶性,能够在细胞组织间自由移动,导致对其合成定位的研究加大了难度。研究显示,动物中褪黑素主要在线粒体中合成,Tan等2013年曾推测在植物中除了线粒体还与叶绿体也和褪黑素的合成代谢有关,这也是植物中褪黑素含量较动物体内高的原因。线粒体中可进行氧化磷酸化合成ATP,叶绿体中进行光合作用,这两个场所进行的反应容易产生ROS和氧化胁迫,因此为了减轻植物受损程度在这些场所合成褪黑素的推测是合理的。后来这一推测得到证实,正常情况下植物褪黑素主要合成部位位于叶绿体,然后运输到其他组织或器官中发挥作用,若出现T5H转录受阻等意外状况,也会有叶绿体转到线粒体中合成 [19] 。
3.1.2. 合成途径
尽管植物中褪黑素的合成途径起步较晚,但近些年已取得重要突破,相继发现并克隆了与其合成相关的基因。Murch等首次通过放射性同位素14C体外标记金丝桃的色氨酸,发现在褪黑素合成过程中涉及到的中间代谢物,包括IAA、色胺、5-HTP和5-HT等都检测到了14C,这说明植物与动物体内褪黑素的合成过程是类似的,其合成的起始物质都是Try [20] ,尽管具体过程并不完全一样。植物中褪黑素合成过程更易变通,因为植物自身可合成色氨酸,而动物必须从食物中获取后进行合成。由色氨酸起始到最终合成褪黑素,该过程至少需要经过4步连续的酶促反应,涉及到的催化酶包括TDC、T5H、SNAT、ASMT,这几种催化褪黑素合成的基因已经陆续在水稻、拟南芥等生物中得到克隆 [19] [21] [22] [23] 。褪黑素的合成路径并非单一的,存在多种合成路径,且主要路径中也存在分支点,即由5-羟色胺生成褪黑素的中间产物为5-甲氧基色胺,并非N-乙酰-5-羟基色胺;另外,该途径中还引入了咖啡酸-O-甲基转移酶(COMT) [5] ,因而可以看出植物褪黑素的合成更为复杂,有待深入研究,主要合成途径如下(图2)。
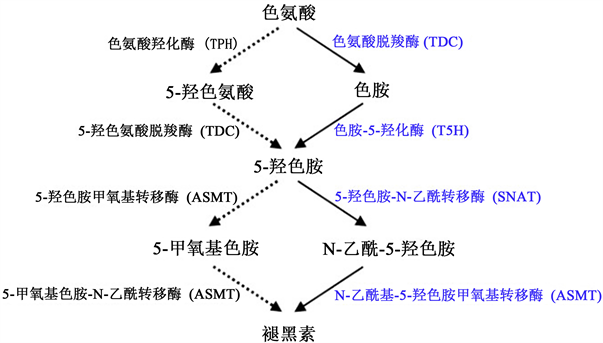
Figure 2. The main pathway and branch of melatonin synthesis in plants [1]
图2. 植物中褪黑素合成的主要途径及支路 [1]
3.2. 植物褪黑素的代谢
褪黑素在生物体内的含量相对较少,且褪黑素的积累易受到生物或非生物胁迫影响时产生变化,这说明褪黑素代谢起着十分关键的作用。在动物体内,褪黑素的分解主要定位于肝脏,主要途径是经过羟基化生成6-羟基褪黑素,最后以尿液形式排出;另外也可以通过其他途径代谢,比如陆续经过脱乙酰基酶、单胺氧化酶、醛脱氢酶/醇脱氢酶的催化最后生成5-甲氧基吲哚乙酸/5-甲氧基色醇;也可被氧化或 UV-B胁迫转化为N1-乙酰基-N2-甲酰基-5-甲氧基犬尿酰胺(AFMK)进而再转化为N1-乙酰基-5-甲氧基犬尿酰胺(AMK),此途径中间代谢物包括3-羟基褪黑素、2-羟基褪黑素、2-吲哚满酮、二氧环乙烷等。有关植物褪黑素合成过程中的几个重要基因已经陆续得到克隆,但是关于代谢机制的研究还很少。但已有资料表明,植物褪黑素的代谢与动物有异曲同工之妙,同样可通过酶促反应和非酶促反应(包括与自由基的级联反应等)实现。经研究人员证实,在水稻中的吲哚胺-2,3-双加氧酶(IDO)催化褪黑素形成AFMK代谢产物,将其转化到番茄中导致褪黑素含量下降,说明该基因促进褪黑素的代谢 [24] 。大多数植物激素及其次级代谢物均通过2-酮戊二酸依赖性双加氧酶(2-ODD)进行羟基化反应加速进一步代谢分解,植物褪黑素当然也不例外。某研究经过E. coli异位表达水稻2-ODD基因家族成员并纯化出蛋白质,结果表明其中四个2-ODD11、2-ODD19、2-ODD21和2-ODD33编码蛋白质时可以将褪黑激素代谢为2-羟基褪黑激素,而6-羟基褪黑激素和4-羟基褪黑激素都不是由2-ODD蛋白编码的,这说明分解为2-羟基褪黑激素途径可能是植物褪黑激素代谢的主要途径;同时在该实验中首次克隆了合成2-羟基褪黑素的酶M2H基因,通过酶动力分析,发现M2H的催化降解的效率远高于SNAT和ASMT的合成效率。M5H会先把植物褪黑素分解为2-羟基褪黑素,然后再与自由基进行级联反应等非酶促反应进一步分解为AFMK,但目前相关研究还比较少 [19] ,部分代谢过程见图3。
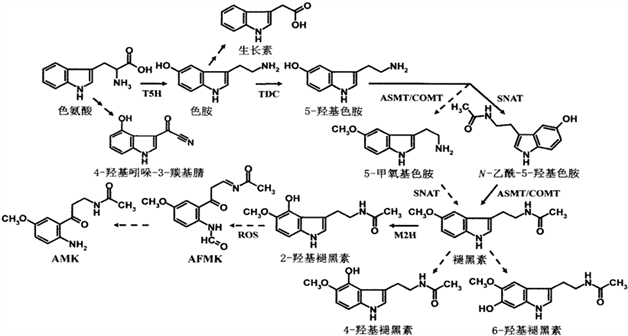
Figure 3. The main anabolic process of plant melatonin [19]
图3. 植物褪黑素的主要合成代谢过程 [19]
4. 讨论
植物褪黑素具有典型的抗氧化性,赋予其抗盐、抗旱、抗高温低温等多样的生理功能,因此近年来关于褪黑素的研究越来越受欢迎。本论文就是对高等植物中的褪黑激素的性质、功能、应用以及主要合成代谢途径进行综述,帮助熟知植物褪黑素的研究发展进程。褪黑素在不同植物、不同组织部位、不同环境下的积累均存在明显差异。为清楚了解褪黑素在植物中的含量变化以及功能,就必须研究其相关的合成及代谢机制,这也是使褪黑素在更多方面得到广泛应用的前提。由于褪黑素起初是在动物体内发现的,因此关于植物褪黑素的研究还不够深入,至于他的合成和代谢也仅限于主要途径,由起始物质Try经过4步酶促反应合成,色氨酸脱羧酶(TDC)定位在细胞质中、色胺-5-羟化酶(T5H)位于内质网中,前两种酶主要催化Try产生血清素,ASMT可催化血清素形成褪黑素,这几个关键基因也陆续被克隆转化 [25] ,为将来进一步研究褪黑素在植物中的发挥作用奠定基础。