1. 引言
在过去几十年里,过渡金属催化的交叉偶联反应在有机合成中发挥了重要作用,已经成为构建碳–碳键或碳–杂键的重要手段,被广泛应用于化工、农业、医药和有机材料等领域 [1] [2] [3] [4] 。随着研究的深入,探索新的偶联试剂以扩大底物范围是化学工作者的一个重要使命。有机砜是一类重要的有机合成中间体,广泛存在于各种功能材料、天然产物和生物活性分子中 [5] ,具有高化学稳定性和强吸电子特性。此外,砜基官能团易在温和的条件下引入和脱除,在有机合成领域具有极高的应用价值 [6] 。近年来,有机砜作为新型交叉偶联试剂在过渡金属催化反应中的应用取得了显著进展,为有机硫化物断裂碳–硫键以合成新的有机物提供了有效的策略。本文主要对近年来不同金属催化的砜的脱硫偶联反应进行了简要综述。
2. 镍催化的砜的脱硫偶联反应
自二十一世纪以来,经过合成化学家的不懈努力,越来越多的基团被开发应用于过渡金属催化的交叉偶联反应,比如卤素、三氟甲磺酸酯等各种与芳基金属配位体结合的离去基团。但砜基作为离去基团在现代交叉偶联化学中的应用价值却被忽略,可能是因为碳–磺酰基(C-SO2)键的反应性较低。然而,特定的催化体系和磺酰基官能团上特定取代基的结合,可以产生多种激活C-SO2键的新方法 [7] [8] 。
2.1. 有机砜与金属试剂的偶联反应
2004年,Snieckus等人报道了 [9] 镍催化的芳基磺酰胺的脱磺酰偶联反应(如图1所示)。该反应在温和的条件下便可使芳基磺酰胺与格氏试剂进行交叉偶联,以一种新颖的直接邻位金属化方式得到带有多取代基的芳基和联芳基化合物,尽管这种反应因对电子和空间效应较敏感,从而在一定程度上限制了官能团的多样性,但特殊的邻位基团效应预示着该方案可以有更广阔的应用前景,特别是对于构建联芳基化合物和1,3-二取代的芳基化合物,这是传统的亲电芳族取代方案无法反应获得的。
2012年,Li等人 [10] 报道了一种通过镍催化的Kumada交叉偶联反应制备烯烃和改性芳烯酮的新途径(如图2所示)。在该反应中,使用NiI2(PPh3)2/PCy3/THF催化体系对甲苯磺酰烷烃的羰基具有良好的耐受性,而产物的类型取决于砜基团的β位置是否存在氢原子。当在砜基中含有β氢时,对甲苯磺烷基烷烃与格氏试剂反应生成烯烃;相反,如果酮部分位于β位置,则通过脱磺酰交叉偶联过程获得芳基或烷基取代的芳基酮。该方案扩大了Kumada交叉偶联反应的底物范围,允许从甲苯磺酰烷烃与格氏试剂的反应中制备烯烃。
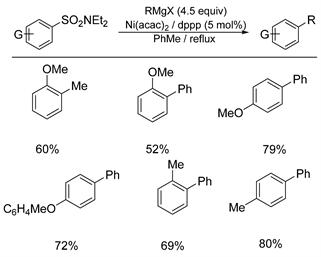
Figure 1. Nickel catalyzed desulfonyl coupling reaction of arylsulfonamides with Grignard reagents
图1. 镍催化芳基磺酰胺与格氏试剂的脱磺酰偶联反应
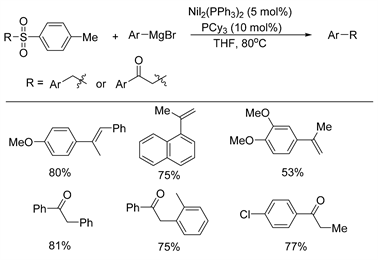
Figure 2. Nickel catalyzed desulfonyl coupling reaction of toluenesulfonyl alkanes with Grignard reagents
图2. 镍催化甲苯磺酰烷烃与格氏试剂的脱磺酰偶联反应
2014年,Wang课题组 [11] 报道了一种在NiCl2(dppp)催化体系下,N,N-二磺酰甲胺与芳基硼酸通过脱磺酰的Suzuki-Miyaura交叉偶联反应合成相应的联芳基化合物的新方案(如图3所示)。镍催化的N,N-二磺酰甲胺作为偶联底物反应效果要优于磺酰氯,而NiCl2(dppp)催化体系具有稳定易得、反应活性较高等优点也在有机合成中更有吸引力。该方案是首次利用该镍催化体系进行脱磺酰化与芳基硼酸的交叉偶联反应,为以后的合成工作者提供了新的研究思路。

Figure 3. Nickel catalyzed desulfonyl coupling reaction of N,N-disulfomethylamine with organic boron reagents
图3. 镍催化N,N-二磺酰甲胺与有机硼试剂的脱磺酰偶联反应
紧接在2018年,Baran等人 [12] 报道了在镍催化作用下,具有氧化还原活性的苯基四氮唑(PT)砜与芳基有机锌化合物的脱磺酰Negishi偶联反应(如图4所示)。通过对自由基实验和手性砜底物的外消旋化结果,证明了这种转化经历了自由基途径,即PT砜通过单电子转移还原生成的伯、仲和三级碳自由基与芳基有机锌化合物发生偶联反应,得到带有多种取代基的目标产物。该方案不仅可以通过自由基交叉偶联反应制备多种烷基氟衍生物,而且还能通过脱磺酰芳基化更直接地合成一些功能有机分子,表现出广泛的官能团容忍性,有效减少了药物分子的合成步骤,对于开发合成含氟药物有着重要贡献。

Figure 4. Nickel catalyzed desulfonyl coupling reaction of phenyltetrazole (PT) sulfones with aryl zinc reagents
图4. 镍催化苯基四氮唑(PT)砜与芳基有机锌试剂的脱磺酰偶联反应
同年,Crudden课题组 [13] 报道了镍催化的叔苄基砜的脱磺酰Suzuki-Miyaura交叉偶联反应(如图5所示)。该反应通过使用叔苄基砜作为新型的亲电底物断裂其C(sp3)-S键构建以季碳中心,成功地合成了结构多样化的对称和不对称的季铵产物,产率良好。由于季苄基中心基序在生物活性分子和天然产物中普遍存在,不仅证明了该脱磺酰交叉偶联反应在生物活性分子合成中的实用性,也证明了有机砜的顺序功能化策略可以为合成复杂分子提供一条新的合成路线。

Figure 5. Nickel catalyzed desulfonyl coupling reaction of tertiary benzylsulfone with aryl organoboron reagents
图5. 镍催化叔苄基砜与芳基有机硼试剂的脱磺酰偶联反应
2019年,Niu课题组 [14] 也开发了一种新型的镍催化的脱磺酰Suzuki-Miyaura交叉偶联反应,以α-氧代–乙烯基芳基砜作为新型的亲电底物制备了一系列芳基糖醇和无环乙烯基醚(如图6所示)。该反应在温和的条件下便可进行,并随后通过机理验证实验,发现α-氧代-乙烯基芳基砜中的α杂原子在反应中起着至关重要的作用。此方案制备的芳基环状物和无环乙烯基醚也在药物合成领域发挥了关键作用。
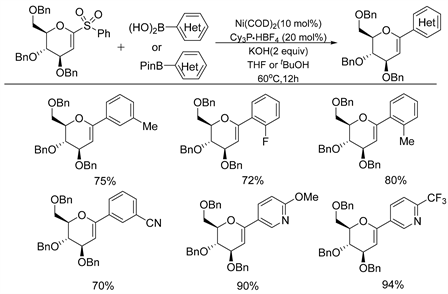
Figure 6. Nickel catalyzed α-desulfonyl coupling of oxo-vinylarylsulfones with aryl boron reagents
图6. 镍催化α-氧代-乙烯基芳基砜与芳基有机硼试剂的脱磺酰偶联反应
2.2. 有机砜与卤代烃的还原脱砜反应
受到Baran等人研究的苯基四氮唑(PT)砜与芳基有机锌试剂的Negishi偶联反应的影响,在2019年,Hughes与Fier等人 [15] 报道了以NiBr2和钳型胺配体为催化剂,锌粉为还原剂,DMI (1,3-二甲基-2-咪唑啉酮)为溶剂的条件下,四唑基烷基砜与芳基溴化合物的脱磺酰还原交叉偶联反应的例子(如图7所示)。其中使用锌粉还原烷基砜生成烷基自由基是该反应的关键步骤。该方案不仅可以避免芳基卤化物的预官能化,而且官能团耐受性较高,其中具有酸性氢的官能团如伯酰胺,无保护的吲哚和醇在反应中都具有良好的耐受性。因此该方法对药物发现和合成化学也产生了较大的影响。
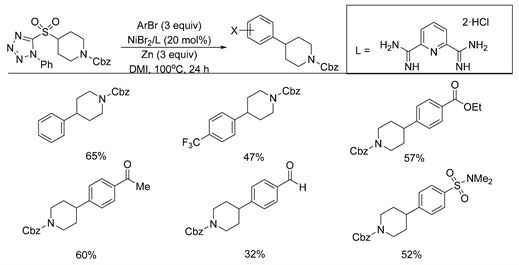
Figure 7. Nickel catalyzed desulfonyl coupling reaction of alkyl sulfone with aryl bromide
图7. 镍催化烷基砜与芳基溴的脱磺酰偶联反应
2021年,Hu课题组 [16] 开发了一种新的镍催化的吡啶基二氟甲基砜与芳基碘化物的脱磺酰交叉偶联反应,选择性的断裂C(sp2)-S键来形成C(sp1)-C(sp3)键(如图8所示)。反应条件温和,并对各种官能团和杂环表现出较好的耐受性。此外,这种方法不需要预生成芳基金属试剂,这对于合成应用来说是一个显著的优势。该方案不仅为形成二芳基提供了一种新的策略,也对氟烷基砜的新反应性与应用也有了新的认知。通过研究,发现杂芳基砜交叉偶联反应的选择性受到过渡金属催化剂和砜的杂芳基取代基类型的影响,这为之后的底物选择提供了更为明确的方向。
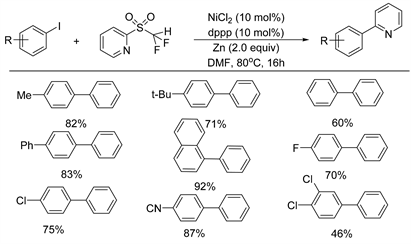
Figure 8. Nickel catalyzed desulfonyl coupling reaction of difluoromethylsulfones with aryl iodides
图8. 镍催化的二氟甲基砜类化合物与芳基碘化物的脱磺酰偶联反应
2.3. 分子内的脱砜偶联形成联芳基反应
1940年,Ramberg和Backlund [17] 首次实现了砜化合物的分子内脱硫偶联以构建C-C键。之后越来越多的化学家开发了通过消除砜分子内的SO2基团来构建C-X键的方法。
2018年,Yolimitsu及其同事 [18] 使用镍/NHC催化体系实现了二芳基砜类化合物的分子内脱硫偶联以构建联芳基化合物(如图9所示)。该反应中的砜需要2-氮杂芳基作为引导基团,且反应温度相对较高。不含2-氮杂芳基的二芳基砜的反应活性显著降低,这表明氮与镍催化剂的配位促进了氧化加成过程或者是2-氮杂芳基的吸电子能力稳定了二芳基Ni(II)络合物,加速了SO2的消除。此外,该催化体系也适用于烯基芳基砜的分子内脱硫偶联构建相应的烯基芳烃。这种分子内脱硫偶联方案为过渡金属催化砜的转化开辟了新途径。

Figure 9. Nickel catalyzed intramolecular desulfurization coupling reaction of diarylsulfones
图9. 镍催化的二芳基砜类化合物分子内脱硫偶联反应
2019年,Wei及其同事 [19] 报道了一种使用Ni(cod)2作为催化剂,在没有添加碱和还原剂的情况下,2-吡啶基苯基砜衍生物分子内脱硫偶联构建C-C键的反应(如图10所示)。作为导向基团的吡啶基通过Yolimitsu报告中提出的类似机制促进了C-SO2键的裂解,得到了各种联芳基化合物,该方案可以使用多种芳香族、杂芳族和脂肪族的砜作为偶联底物,不仅为磺酰基的催化转化提供了新的途径,而且对促进镍催化的C-S键活化做出了贡献。
通过研究,推测这种分子内脱硫偶联可能的机理为(如图11所示),最初在导向基团的帮助下,Ni(0)配合物与偶联底物1a配位形成中间体A。然后通过中间体A对C-S键的氧化加成形成中间体B。随后,脱硫反应产生相应的镍配合物C。最后镍配合物C经过还原消除,得到产物,同时再生Ni(0)催化剂。

Figure 10. Catalytic intramolecular desulfurization coupling reaction of 2-pyridylphenylsulfone derivatives
图10. 镍催化的2-吡啶基苯基砜衍生物分子内脱硫偶联反应
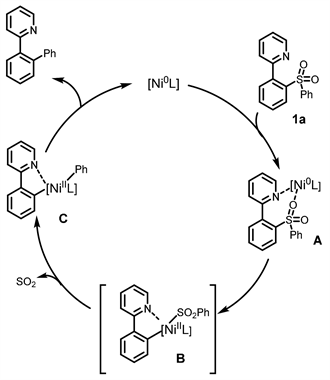
Figure 11. Mechanism of nickel catalyzed intramolecular desulfurization coupling of diarylsulfones
图11. 镍催化的二芳基砜类化合物分子内脱硫偶联机理
3. 钯催化的砜的脱硫交叉偶联反应
3.1. 有机砜与芳基硼酸的偶联反应
2013年,Nambo等人 [20] 开发了一种钯催化的脱磺酰交叉偶联反应,用来模块化制备三芳基甲烷(如图12所示)。该方案以苯基砜化合物作为亲电试剂,使用顺序催化芳基化反应分三步逐渐将苯基砜化合物转化为三芳基甲烷。涉及到两种类型的催化转化:前两步发生的C-H芳基化反应和第三步通过钯催化的脱磺酰Suzuki-Miyaura偶联反应。后来Nambo等人又使用氟化砜衍生物作为亲电底物发生脱磺酰交叉偶联反应得到了结构多样化的多芳基甲烷 [21] 。
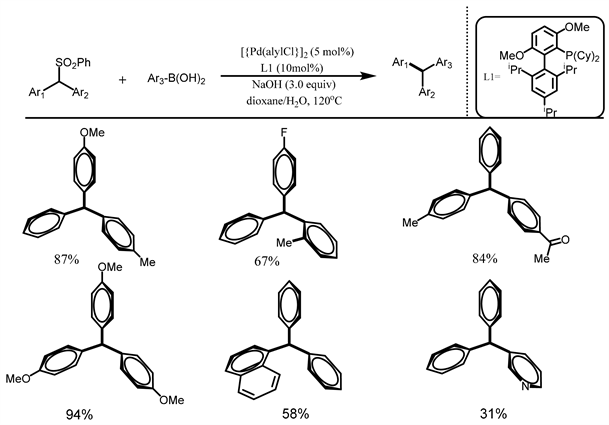
Figure 12. Palladium catalyzed desulfonyl cross coupling reaction of phenylsulfone compounds with aryl boric acid
图12. 钯催化苯基砜化合物与芳基硼酸的脱磺酰交叉偶联反应
2019年,该课题组 [22] 又报道了钯催化的α-氟苄基三氟甲酮的脱磺酰交叉偶联反应模块化合成α氟芳基甲烷的例子(如图13所示),为合成具有药用价值的氟甲基和二氟甲基芳烃提供了一种产率较高的合成路线。此方案突出了砜基化合物作为亲电试剂在模块化偶联反应的独特化学性质,为之后的相关反应提供了新型高效的底物范围。

Figure 13. Palladium catalyzed desulfonyl cross-coupling of benzyltrifluoromethanones with arylboric acids
图13. 钯催化苄基三氟甲酮与芳基硼酸的脱磺酰交叉偶联反应
同年,Moran课题组 [23] 通过钯催化的芳基三氟酮的Suzuki-Miyaura交叉偶联反应合成了不对称联芳基化合物(如图14所示)。该反应可以使用多种芳基三氟酮和芳基硼酸,得到带有相应的官能团的偶联产物,而二苯砜取代苯基三氟酮显著降低了产物的产率,这表明三氟基团对促进C-SO2键的活化很重要。最值得注意的是,三氟甲基砜在硝基芳烃和芳基卤化物之间表现出中等水平的交叉偶联反应性,能够通过顺序交叉偶联轻松合成不对称的叔苯基和季苯基的联芳基化合物。
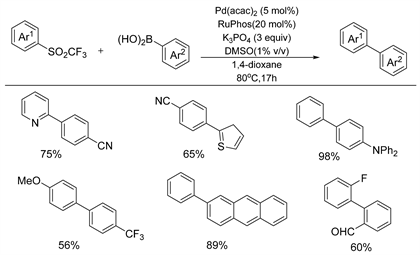
Figure 14. Palladium catalyzed desulfonyl coupling reaction of aryltrifluoroketone with arylboric acid
图14. 钯催化芳基三氟酮与芳基硼酸的脱磺酰偶联反应
3.2. 有机砜与卤代烃的偶联反应
杂环亚磺酸盐通常可以作为钯催化芳基/杂芳基卤化物偶联反应的有效试剂,得到高产率的目标联芳基产物。但复杂的杂环亚磺酸盐的制备和纯化一般比较困难,并且亚磺酸盐官能团的耐受性较低。而杂环烯丙基砜的制备简单方便,并且被证明是与各种芳基/杂芳基卤化物的有效偶联试剂。因此杂环烯丙基砜可以作为亚磺酸盐试剂的替代物。
2018年,Willis课题组 [24] 报道了使用Pd(OAc)2作为催化剂,P(t-Bu)2Me作为配体,Cs2CO3作为碱,杂环烯丙基砜通过脱烯丙基/脱硫交叉偶联过程参与钯催化与芳基溴化物的反应(如图15所示)。该催化体系下的烯丙基砜官能团可以耐受一系列合成转化,能成功地与各种药用相关底物偶联,证明了它们在苛刻的交叉偶联转化中的适用性。鉴于这些属性以及功能化杂环在药用化学和其他生命科学中的重要性,该方案将得到广泛应用。

Figure 15. Palladium catalyzed deallylation/desulfurization cross coupling of heterocyclic allylsulfones with aryl bromides
图15. 钯催化杂环烯丙基砜与芳基溴化物的脱烯丙基/脱硫交叉偶联
2019年,Larionov课题组 [25] 报道了在钯催化作用下二烯类环丁砜化合物作为新型二烯基化试剂,合成具有高立体选择性的烯基芳基化合物的例子(如图16所示)。经过研究,确认Pd(OAc)2/dppbz是最佳的催化剂,而KOMe是砜开环原位生成亚磺酸二烯的有效催化剂。该方法以二烯类环丁砜和芳基卤化物为原料,以较满意的产率合成了芳基化二烯类化合物。此外反应中添加碳酸盐可以实现与芳基三氟甲酯的交叉偶联。
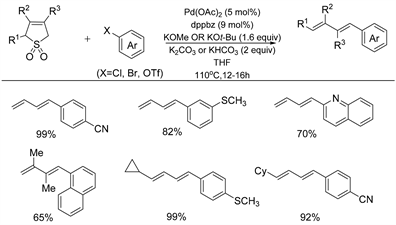
Figure 16. Palladium catalyzed desulfurization cross coupling of sulfolanes with aryl halides
图16. 钯催化环丁砜类化合物与芳基卤化物的脱硫交叉偶联
4. 其他过渡金属催化砜的脱硫交叉偶联
除了常用的金属镍和金属钯可以作为有效催化剂催化砜的脱磺酰偶联以外,其他过渡金属也在砜的脱磺酰交叉偶联领域发挥了重要作用。近几年,包括铜、铁、钴以及锰等过渡金属都在该领域有着出色的表现,使砜的多种衍生物被利用开发。
2016年,Chen课题组 [26] 报道了在温和条件下锰催化的脱磺酰开环氰化反应和炔基芳砜与环丁醇衍生物的乙炔基化反应,得到的目标产物具有中等至极好的产率(34%~87%) (如图17所示)。在室温下,将氰基和乙炔基分别作为C1或C2单元选择性地引入到所得酮的γ位置。这种转化基于一个共同的序列:a)环丁醇通过C-C键裂解的氧化开环;b)对带有芳基磺酰基的三键的自由基加成;c)自由基介导的C-S键裂解。通过单碳链生长策略,分别获得了稀有的脂肪族腈和炔烃。该方案具有广泛的底物范围,可耐受各种官能团,例如卤素,芳基,烷基,三氟甲基和甲氧基等,区域选择性地提供γ氰化和炔化烷基酮,并为生产脂肪族腈和炔烃提供温和但有效的方法。
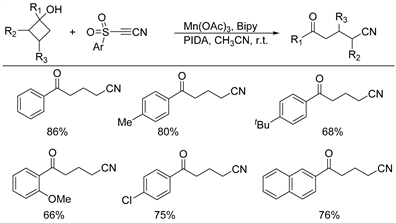
Figure 17. Manganese catalyzed desulfonyl cross coupling reaction of alkynyl arylsulfones with cyclobutanols
图17. 锰催化炔基芳砜与环丁醇的脱磺酰交叉偶联反应
2018年,Hu课题组 [27] 报道了在铁催化下,2-吡啶基二氟甲基砜与芳基锌试剂发生脱磺酰反应,通过烷基C-S键裂解得到二氟甲基芳烃(如图18所示)。二氟甲基已被用作生物活性分子中羟基的相似替代基团。然而,直接引入CF2的合成方法相对较少。以20 mmol%的Fe(acac)3为催化剂,TMEDA为配体,THF作为溶剂,和芳基锌试剂进行芳香族二氟甲基化反应。在使用二苯基锌的情况下,目标二氟甲基芳烃的收率为好。其中间位和对位取代的芳基锌的反应获得了优异的产率。但具有邻位取代基的芳基锌的产率较差,而中性电子、富电子和缺电子芳基锌均能适用于二氟甲基化反应。该课题组提出了一种自由基机理(如图19所示),表明了反应是由还原铁物种A的形成引发的,而该还原铁物种是由芳基锌试剂还原预催化剂Fe(acac)3与TMEDA作用下产生。铁物种A和砜底物1反应形成自由基阴离子B,该自由基阴离子经历裂解产生了二氟甲基自由基。二氟甲基自由基与铁络合物C通过自由基复合作用形成中间体D。随后还原消除得到产物2。
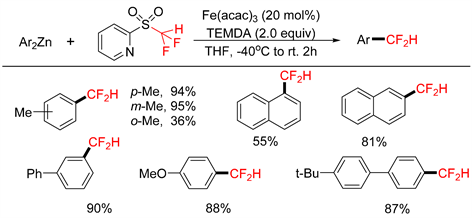
Figure 18. Iron catalyzed disulfonyl cross coupling reaction of 2-pyridyldifluoromethylsulfones with aryl zinc reagents
图18. 铁催化2-吡啶基二氟甲基砜与芳基锌试剂的脱磺酰交叉偶联反应
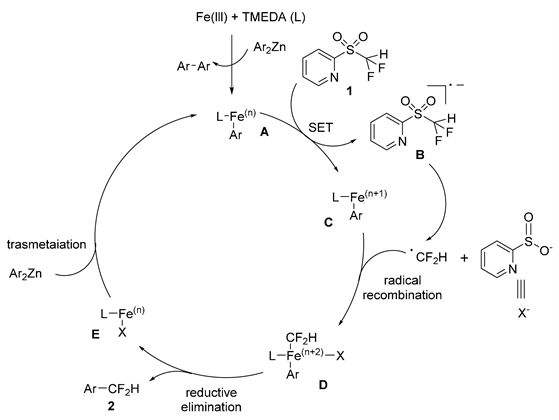
Figure 19. Iron catalyzed desulfonyl coupling process of difluoromethyl sulfones
图19. 铁催化的二氟甲基砜的脱磺酰偶联机理过程
5. 总结
本文针对各种过渡金属催化的砜试剂的脱磺酰交叉偶联反应进行了系统的综述。由于砜比其亚砜类似物具有更多的极性和不稳定的C-S键,因此它们可以更好作为脱硫交叉偶联反应中的亲电试剂。而如何开发利用砜化合物来实现砜官能团更高效的原子经济转化一直是有机合成界研究的热门领域,近年来,过渡金属催化的砜的脱硫交叉偶联成为了有机合成中最有效的反应之一,随着该反应的深入研究,一些新型的砜基化合物也逐渐吸引了合成化学家的注意,相信在未来,关于砜作为过渡金属催化偶联反应的亲电试剂应用会越来越广泛。
NOTES
*通讯作者。