1. 引言
微藻的细胞结构简单、生长繁殖速度快,在自然水体中广泛存在 [1] [2] ,是一种种类繁多、资源丰富、生长速度快并具有极大的应用价值的生物资源。微藻广泛分布于海洋、河流和湖泊等水体,是这些系统中初级生产力的主要组成部分;甚至存在于极地、冰川、沙漠和盐碱地等各种极端生境,成为这些生境中的“先锋植物” [3] 。微藻及其代谢产物可以用于污水处理、食品的加工、生物药品的研制、生物饵料应用、可持续利用能源生产研发等方面,具有重要的经济和社会价值,在国内依然具有着非常巨大的发展空间。但目前微藻的生产仍存在着种种问题,在优良品种的筛选、培育与推广、培养方法及场所的选择和优化、应用价值的挖掘及市场开拓等方面,均有大量工作亟待开展 [4] 。
小球藻(Chlorella vulgaris)营养价值高兼具保健功能,在一些国家和地区已有很大程度的开发和利用,先后开发成蛋白源饲料、食品、饮料、医药制品 [5] 。近年来,我国也开始重视对小球藻的开发利用,但在养殖业上的可利用价值没有引起足够的重视 [6] 。小球藻一般以个体形式单独存在,但也会以粘质层的形式沉入水底或粘着在器皿底部。小球藻唯一的生殖方法是依靠细胞内原生质体分裂形成似亲孢子,每一个孢子都会长成一个新的个体 [7] 。现已有研究表明,小球藻中含有大量的蛋白质、多种维生素、生物多糖、不饱和脂肪酸、叶绿素、类胡萝卜素及人体所需的各种矿物质等 [8] ,小球藻蛋白质含量高达63%,18种氨基酸总量高达55%,其中小球藻碳水化合物含量为10%~20%,脂类含量为5%~10%,小球藻的叶绿素含量为3%~5%,是自然界中最高的。小球藻的虾青素含量可高达2.2 mg/g,小球藻细胞还含有丰富的维生素A、B、K和叶酸。并被广泛的应用于医药保健、食品加工、生物饲料、污水处理以及基因工程等领域 [4] 。
鱼腥藻(Anabaena)隶属蓝藻门(Cyanophyta)念珠藻目(Nostocales),是一种典型的固氮微生物,主要由两种形状不同的细胞组成,其中形状较小的为营养细胞,形状较大的为异形细胞。很早以前人们就发现了藻类对植物具有肥效作用 [9] [10] 。1939年人们发现生长在稻田的固氮蓝藻可以使水稻连年保持较高的产量 [11] 。此外,鱼腥藻大多数菌株都可以通过光合作用来进行高效地固氮和固碳,同时还能利用太阳能进行产氢。因此,人们希望可以通过这种绿色无污染的生物途径获得可持续性的新型清洁能源。而且现研究还表明鱼腥藻对水体中的低浓度铀和重金属的净化效果较好,在防治污染方面具有广阔的应用前景 [12] 。
水华鱼腥藻(Anabaena flos-aquae)是造成淡水水体水华即导致水体富营养化的主要藻种之一,分布极广,而且能够产生藻毒素,直接和间接的危害到人类。目前,已发现水华鱼腥藻能产生6种鱼腥藻毒素(anatoxins),均为神经性毒素,以肝毒素和鱼腥藻毒素为主,可以作用于动物的肝脏并引起中毒死亡 [12] 。对于水华鱼腥藻的防治工作也是环境保护的重点方向。但水华鱼腥藻作为固氮蓝藻中的一类也可以应用到水稻田间固氮,作为天然氮肥。研究中当水稻田中当蓝藻大量覆盖水面时,可以有效抑制杂草生长 [13] 。藻类生长受水体中氮磷比的影响,当氮磷比为2时,蓝藻可以大量繁殖生长,进而抑制杂草的生长。同时水华鱼腥藻可以应用于对氨氮的降解,研究表明水华鱼腥藻在包埋固定的方式下,对氨氮降解能力有明显较好的效果 [14] 。
栅藻(Scenedesmus)是绿藻门绿球藻目栅藻科中的一属,因为其繁殖速度较快、对环境适应性较强、并具有很强的耐污性的特点,所以是有机污水氧化塘生物相中的优势种类,所以被用作处理污水的首选微藻之一。同时还因为其特殊的细胞壁结构和较高的重金属富集能力等特点,被应用于水体重金属修复。而与其他能源微藻相比,栅藻更是具有含油量较高 [15] 、适应性好、CO2利用率高等优势,因而常常被众多的研究者选为能源微藻的研究对象,是一种具有巨大潜能的生产生物柴油的藻类。
本实验中,希望通过在相同环境下对四种微藻的生长速度的记录以及比较,从而探究在相同培养条件中这四种微藻的优势品种,从而为生物防治、微藻规模培养、污水处理等方面提供有效数据,满足相关市场和研究的需要。
2. 实验材料与装置
2.1. 实验材料
2.1.1. 实验藻种
小球藻藻种、鱼腥藻藻种、水华鱼腥藻藻种、栅藻藻种由鲁东大学藻类研究所提供。
2.1.2. 实验设备
所做试验中,需要测量各种藻类的数值,为保证实验的严谨性和数据的准确性,需要用到:分光光度计、数字式照度仪、血球计数板、电子天枰、10 ml移液枪(见表1)。

Table 1. Experimental instruments and factory companies
表1. 实验仪器和出厂公司
2.2. 实验装置
由所做实验的目的以及变量控制方面要求,需要设计尽量符合条件的实验装置:满足良好适应不同种类的微藻相同的生长环境条件。保持装置内空气流通,隔绝与培养缸外空气的接触,保持气密性。便于取样和检测的装置构造条件。装置应尽量避免因设备问题所导致的藻种污染。
本次实验中所用到的实验装置:58 cm*10 cm*56 cm的藻类培养缸、电磁炉、通气空气泵、通气设备等。
2.3. 实验思路
本实验的思路是设置尽量相同的实验环境条件,并尽量统一光照条件和温度条件,在同一实验场所内分别设置4组(1号——水华鱼腥藻、2号——小球藻、3号——鱼腥藻、4号——栅藻)相同培养条件的实验组。测量实验组的OD值和细胞密度的变化并绘制折线图,通过比较折线图的斜率来确定各实验组的最大生长速率,从而确定生长速度。并对4组数据进行生长速度的比较。
3. 实验步骤
3.1. 营养配置
藻种培养基的配置
配制四瓶5000 mL的统一培养基:取四只5000 mL规格的三角培养瓶,清洗消毒后分别加入5000 mL的自来水,并对自来水进行化学或物理消毒。称取配制培养基所需的药品,药品的用量及浓度(见表2)。

Table 2. Amount and concentration of drugs
表2. 药品的用量及浓度
将称量好的NaNO3、柠檬酸铁和微量元素溶液分别放入四个5000 mL三角培养瓶中,将称取的KH2PO4分别放入另外四个500 mL的三角培养瓶中,并加入少量蒸馏水溶解。
用牛皮纸密封培养瓶的瓶口,放在电磁炉上加热进行高温消毒,沸腾后取下,待培养液冷却至室温后,将三角瓶中的KH2PO4培养液对应的倒入另外四瓶培养瓶中。按此步骤配制四瓶培养基。
3.2. 藻种接种、培养与扩种
3.2.1. 藻种的接种与培养
将盛有高温杀菌的KH2PO4的培养瓶放置在实验台上,冷却至室温后,进行接种操作。首先在周围空气中喷洒酒精进行消毒,然后小心取下牛皮纸盖和橡皮筋,保持盖口向上放在实验台上。
将准备好的藻种迅速倒入培养瓶中,快速盖上牛皮纸盖并套好橡皮筋。左右轻轻摇晃培养瓶,使藻种分散,注意不要让培养液接触到牛皮纸盖。待摇晃充分后放在有一定光照但光照不过于强烈的地方,培养7天。
培养期间每日摇晃培养瓶防止藻种堆叠在一起而过于密集,从而导致无法充分吸收养分进行生长。当藻种生长至适宜浓度可移至阳光较强的地方进行培养。
3.2.2. 藻种扩种培养
对藻种进行消毒接种后,在适宜的环境下培养7 d并使藻液达到一定的浓度时,对藻液进行进一步扩种。预先准备好四个相同的58 cm*10 cm*56 cm规格的藻类培养缸,接入通气设备并对缸内进行充分消毒,在缸口封好保鲜膜。倒入已经消毒好的淡水19.5 L,再用保鲜膜密封好。将培养好的藻种按以上步骤倒入缸中。再将按照培养方案配置好的四组培养基,在酒精喷洒消毒后的环境中迅速倒入培养缸中并用消过毒的玻璃棒充分搅拌使其混合均匀。打开通气装置,并将培养缸放置在同等阳光照射环境中。
3.3. 测量初始接种浓度
第一次实验测试之前,藻种培养7 d后转移到藻类培养缸中,用移液枪在酒精喷洒消毒的环境在四个缸中分别取部分藻液,用分光光度仪、血球计数板以及显微镜来分别测量处于此时的小球藻藻液、鱼腥藻藻液、水华鱼腥藻藻液、栅藻藻液的OD值和单位体积内的细胞密度,测量结果(见表3)。

Table 3. OD values of each algae solution and cell density in each unit volume
表3. 各藻液的OD值和单位体积内的细胞密度
并以此数据作为下面实验中藻种的原始数据。
3.4. 四种藻的分缸培养
分别设置4组(1号——水华鱼腥藻、2号——小球藻、3号——鱼腥藻、4号——栅藻)实验组,将其放置于阳光温度均适宜的同一场所。在同一时间,将藻种分别放入培养缸中,分别放入配置好的且所含相同的营养液,搅拌均匀使其充分生长。培养过程中定时对培养缸内藻种进行搅匀,防止其贴壁生长影响生长状况和光照条件。
3.5. 数据测量与处理
在实验培养期间,每间隔一天就分别测量1~4号培养瓶中微藻藻液的OD值和细胞密度,记录后绘成折线图,进行观察比较。同时按时对各缸进行镜检,防止藻种污染并及时止损。
实验最后进行干重的测量,测量方法如下:
1) 在消毒环境下,在四个缸中分别取一定比例的藻液(因使用20 L的培养缸所以本次实验取2 L的藻液,按10%的比例来计算整缸的干重)。
2) 对抽取出的藻液用滤网进行初步过滤。
3) 准备四张滤纸并将其剪成与抽滤装置中的抽滤口相符合的大小,将其分别放入四个洁净干燥的培养皿中,并分别对其进行称重。得到G1 (滤纸加培养皿的重量)
4) 将抽滤装置安装好,测试其气密性,将滤纸放置于过滤杯与漏斗基座的卡槽中,将初步过滤的藻液倒入过滤杯中,打开抽滤泵,进行抽滤。
5) 在抽滤过程中用蒸馏水将杯壁上的残留藻液冲下,避免误差。
6) 抽滤完成后,将滤纸分别放入对应的培养皿中,放入烘箱中进行烘干,在60℃的高温下烘干至恒重。
7) 等烘箱完全冷却至室温后,快速将培养皿盖好并取出。放置室温后,用精密电子天平进行称量。得到G2。
8) 进行数据处理:
。
4. 实验结果
通过分别测量四种藻液吸光度和细胞数来跟踪测定各藻生长状况并进行数据比较,测出四种藻液各自的干重并进行比较分析(见图1~8)。

Figure 1. OD change of Anabaena algal bloom over time
图1. 水华鱼腥藻随时间增长OD值的变化
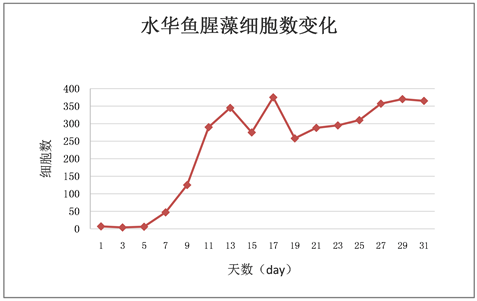
Figure 2. Change of cell number in Anabaena algal bloom over time
图2. 水华鱼腥藻随时间增长细胞数的变化
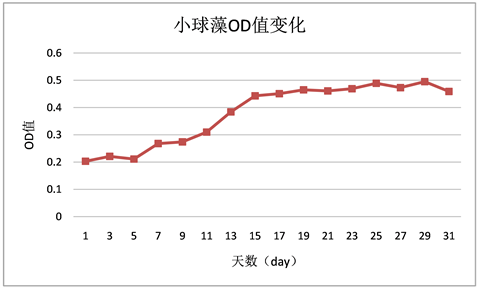
Figure 3. OD change of Chlorella growth over time
图3. 小球藻随时间增长OD值的变化
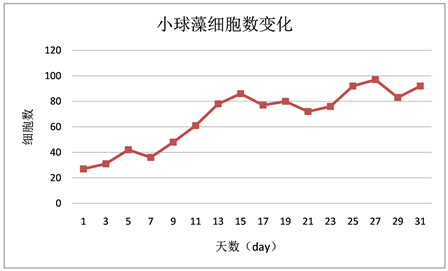
Figure 4. Changes of cell number in Chlorella over time
图4. 小球藻随时间增长细胞数的变化

Figure 5. OD change of Anabaena growth over time
图5. 鱼腥藻随时间增长OD值的变化
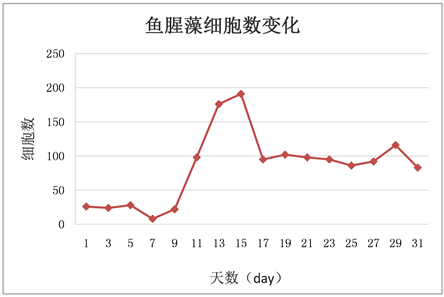
Figure 6. Changes of cell number in Anabaena over time
图6. 鱼腥藻随时间增长细胞数的变化

Figure 7. OD change of Scenedesmus growth over time
图7. 栅藻随时间增长OD值的变化

Figure 8. Change of cell number in Scenedesmus over time
图8. 栅藻随时间增长细胞数的变化

Figure 9. Comparison of OD values of four kinds of algae (Anabaena algal bloom, Chlorella, Anabaena, and Scenedesmus) over time
图9. 四种藻(水华鱼腥藻、小球藻、鱼腥藻、栅藻)随时间增长OD值的变化比较
相同生长环境同等营养条件下,小球藻OD值变化较稳定,呈稳定增长状态,没有太大起伏。栅藻OD值变化起伏较大,主要发生在9 day至13 day之间,在9 day到11 day之间快速上升,而从11 day到13 day之间又有所回落,随后再次上升。水华鱼腥藻OD值变化一直起伏波动较大,但在13 day至17 day之间起伏相对较大。鱼腥藻OD值变化较稳定,呈稳定增长状态,无太大起伏,随偶有波动但影响不大。
微藻生长过程中小球藻的OD值一直高于其他三种微藻,其次是栅藻,OD值增长速率在小球藻之下鱼腥藻和水华鱼腥藻之上,虽有时波动过大也在合理范围之内。鱼腥藻与水华鱼腥藻的OD值变化幅度相差不大,但相对来说水华鱼腥藻OD值增长速率较高于鱼腥藻(见图9)。
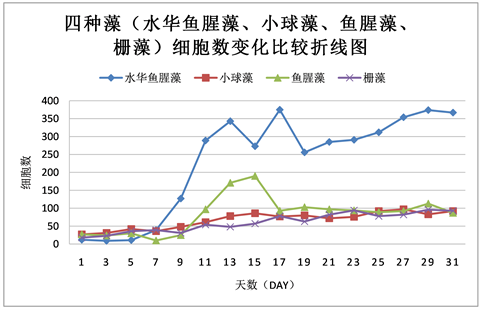
Figure 10. Comparison of cell number changes of four species of algae (Anabaena algal bloom, Chlorella, Anabaena, and Scenedesmus) over time
图10. 四种藻(水华鱼腥藻、小球藻、鱼腥藻、栅藻)随时间增长细胞数的变化比较
相同生长环境同等营养条件下,小球藻细胞数变化较稳定,呈稳定增长状态,没有太大起伏。栅藻细胞数变化较稳定,呈稳定增长状态,无太大起伏,随偶有波动但在合理范围以内。水华鱼腥藻细胞数变化起伏较大,在7 day至13 day之间和15 day至17 day之间一直处于快速增长状态,在13 day到15 day之间与在17 day到19 day之间快速回落,而从11 day到13 day之间又有所回落,随后再次上升。鱼腥藻细胞数起伏波动在13 day至17 day之间相对较大。鱼腥藻OD值增长较稳定,无太大起伏,随偶有波动但影响不大。
各微藻细胞数变化折线的比较发现:微藻生长过程中前五天四种藻除水华鱼腥藻外都保持着较低速率的增长。水华鱼腥藻的细胞数在5 day之前一直处于不增长的状态,从5 day开始增长并在7 day之后迅速增长并一直保持着高于其他三种微藻的状态,中间虽有较大的上下波动但影响不大。其次是鱼腥藻,在9 day至15 day之间有一段快速增长期,细胞数增长速率在水华鱼腥藻之下小球藻和栅藻之上。小球藻与栅藻的细胞数在实验过程中均呈稳定增长的状态,无太大波动。但相对来说小球藻细胞数增长速率高于栅藻(见图10)。

Table 4. Measurement of dry weight of the four microalgae
表4. 四种微藻干重的测量表
在四种藻中水华鱼腥藻的干重值为最高,鱼腥藻次之,再是小球藻,而栅藻干重值最小。其中水华鱼腥藻数值已经是小球藻的两倍,是栅藻的三倍之多(见表4)。这一结果比较符合图10的分析。
因为实验在冬季进行,所以在本次实验中,平均光照强度:245;平均室温:9.6℃。
5. 分析与讨论
本实验的目的是为了探究水华鱼腥藻、小球藻、鱼腥藻、栅藻这四种微藻分别在相同培养条件下,各类微藻的生长情况并对其各自的生长速度进行比较。探究在相同环境中这四种微藻中的优势品种,从而满足相关市场和研究的需要。
培养这四种微藻时外界实验环境对微藻生长情况产生了一定的影响,因实验期在沿海的冬季进行,虽光照条件可以得到基本保障,光照强度处于良好状态但较低的温度也对微藻的生长产生了一定的影响。从实验结果可以看出较低的温度对四种微藻的生长都有所影响,其中小球藻和栅藻生长所受温度的影响较大。但由于小球藻在低温条件下的适应能力较好,在较低温度下依然能生长并保持较好的光合速率 [16] ,而已知的是栅藻在中温35℃左右下生长最好,并对低温的氮磷要求较高 [17] [18] ,所以理论上小球藻生长状态要明显比栅藻好一些,与实验得出数据相符合。
同时由结果中的图1到图8的折线可以看出,四种微藻的OD值和细胞密度一般都不是一直上升的状态,有时会出现一定程度的起伏,对实验过程进行原因分析后认为可能存在以下几种可能性:1) 由于实验中的光照条件主要依赖于太阳光照,因此阴天等环境可能会对微藻的生长产生一定的影响,同时实验室中的温度、湿度等不可控的条件变化也有可能会对测量结果产生一定的影响。2) 由于培养缸体积过大,在测量取样前虽然都用消毒过的玻璃棒进行了充分搅拌,但由于器材条件所限,一些易于沉积的微藻也无法完全保证测量的准确性。导致数据出现波动。
而从图9与图10比较来看,四种藻OD值与细胞密度状态不符,而干重测试结果明显更符合细胞密度的分析,考虑到中期时水华鱼腥藻和鱼腥藻就因浓度升高而集结成块状、片状,达到了生长周期中的最大值,而在这个时期中鱼腥藻最易于沉降 [19] 。从而导致有些藻沉积在培养器皿底部,造成OD值的不准确,所以最终按细胞数和干重来确定结果更为准确。
根据实验结果分析,这四种微藻(水华鱼腥藻、小球藻、鱼腥藻、栅藻)在相同的培养条件下,水华鱼腥藻明显处于优势地位为其中的优势藻种,栅藻明显处于劣势地位。四种微藻生长速度的比较结果为:水华鱼腥藻 > 鱼腥藻 > 小球藻 > 栅藻。
从本次实验中,可以清楚地看到水华鱼腥藻恐怖的生长速度,而且水华鱼腥藻作为蓝藻水华中比较具有代表性的藻种 [20] ,能够释放出大量可以对环境和人类健康造成严重危害的多种鱼腥藻毒素,破坏水体原有生态系统,甚至可以使水体丧失其基本功能。在地表水体富营养化愈加严重的今天,我国作为水体富营养化程度最严重的国家之一,更加直接的面对着水华所造成的危害,我们应尽量加强有关此方面的研究,并积极寻找水华鱼腥藻的应用方向,尽早解决水华的治理问题并实现变害为宝。
6. 研究的局限性
小球藻生长在近岸淡水水域,受海洋地理、水文、生态环境影响极大。培养室局部的温度、光照差异对小球藻生长具有影响,小球藻的研究中光照强度会受天气影响,影响实验数据的准确性。培养室中培养器材具有局限性,培养规模较小,无法更充分体现小球藻的光合速率等。研究人员可能会以为自身的文化或对某些现象的看法而产生偏见,对实验现象的数据和结果有误差和偏见,可能会影响研究的合理性。
NOTES
*通讯作者。