1. 引言
金枪鱼(Tunas)属硬骨形目,鲭科动物,别名为吞拿鱼,活跃于上层大海洋。金枪鱼肉属红色肉,高蛋白、低脂肪,富含ω-3脂肪酸,氨基酸(尤其蛋氨酸、胱氨酸)、维生素(Va、Vd等)、矿物质(Fe、Zn等)等,营养价值较高 [1] 。金枪鱼作为是世界上公认的高端经济深海鱼类,主要被加工为生鱼片和各类罐藏食品,在其被加工成食品的过程中会产生大量的副产物 [2] 。其中,在利用金枪鱼肉工鱼罐头和鱼柳时,会产生大量含有风味物质和营养成分的蒸煮液,极具开发价值。
目前对于金枪鱼蒸煮液大多是直接酶解,陈启航等 [3] 以金枪鱼蒸煮液作为原料,先通过单因素实验考察水解度受到的影响,再利用响应面优化酶解工艺条件,最后采取正交法确定最适的杀菌条件。结果表明,研制出的金枪鱼调味汁中氨基酸态氮含量可达0.68 g/100mL。鲍伟等 [4] 通过采用电子鼻和HPLC等方法,发现金枪鱼蒸煮液的添加可以有效提高猪肉的气味和滋味。何键东等 [5] 为了确定提取金枪鱼鱼油的最佳酶解工艺条件,以金枪鱼蒸煮液作为原料,以鱼油提取率为考察指标,先使用胰蛋白酶对蒸煮液蛋白进行水解,再采用响应面分析方法确定了最佳酶解工艺条件。李可欣等 [6] 先分析测定了金枪鱼蒸煮汁的营养成分和抗氧化活性,接着通过对不同脱腥方法的比较分析确定了最佳脱腥工艺,最后创新性的制备了金枪鱼风味的沙拉酱。从已有的报道可以看出目前对金枪鱼蒸煮液的综合利用水平较低,企业很少对这些副产物进行高效利用,有的企业将其浓缩后售卖,甚至丢弃,这直接影响了金枪鱼的加工利用率 [7] 。关平彦等 [8] 探究了三种酶(中性蛋白酶、胰蛋白酶、风味酶)在不同加酶量下酶解金枪鱼加工副产物的过程,结果显示:金枪鱼下脚料添加量为2 g,料液比1:5时,酶解过程风味蛋白酶转化率最大值16.79%;胰蛋白酶转化率最大值16.63%;中性蛋白酶转化率最大值16.57%。柯红乔等 [9] 探究了五种蛋白酶(木瓜蛋白酶、中性蛋白酶、typsin、pepsin、Alcalase 2.4 L)对金枪鱼头蛋白的酶解过程。筛选出羟基自由基清除力最强的是Alcalase 2.4 L蛋白酶解液,并通过响应面试验确定最佳酶解条件:酶解时间340 min,酶解温度54℃,加酶量0.38%,羟基自由基清除率为63.67%。张华丹等 [10] 以金枪鱼加工副产品为原料,采取双酶酶解法提取粗鱼油并考察了料液比、蛋白酶A、B添加量和反应时间对粗鱼油提取率的影响,确定最佳工艺条件:料液比1:3,蛋白酶A、B添加量均为1.5%,反应时间各为3 h和2 h,粗鱼油提取率约为6.58%,其理化指标符合粗鱼油二级标准。章超 [11] 以DPPH自由基清除率作为指标,探究四种酶(舍雷肽酶、木瓜蛋白酶、中性蛋白酶、胰蛋白酶)对金枪鱼肉干粉的酶解过程,确定胰蛋白酶为最佳的酶解用酶,并利用超滤对酶解产物进行分级,结果表明:分子量小于3 kDa的多肽组分具有较高的DPPH自由基清除活性。通过单因素和正交实验,优化酶水解的工艺参数,确定最佳酶解反应条件:pH为8.0,酶解温度为37℃,酶解时间为2 h,液固比为5:1,测得酶解后分子量小于3 kDa多肽的DPPH自由基清除率为87.62%,多肽含量为16.6%。课题组前期创新性的从金枪鱼蒸煮液中提取了蛋白、鱼油,之后再通过发酵将剩余部分制成调味料 [12] [13] [14] ,提升了金枪鱼蒸煮液的利用价值。通常情况下,相较于蛋白,多肽具有抗氧化、降血压、抗菌、提高免疫力等相对较好的生物活性功能 [14] [15] 。
本课题组以金枪鱼蒸煮液蛋白为原料,通过响应面设计确定最佳酶解工艺,对最优条件下制备的多肽进行超滤分级并对其抗氧化活性进行测定,以期为金枪鱼多肽的抗氧化性研究提供更多理论依据。
2. 实验部分
2.1. 实验材料和仪器
金枪鱼蒸煮蛋白,本实验室提供,具体制备方法参照已发表论文。甲醛(36%~38%)为食品级;碱性蛋白酶、氢氧化钠、邻苯二甲酸氢钾、硫酸亚铁、过氧化氢、Tris-HCl、邻苯三酚、氯化亚铁、菲洛嗪、二苯代苦味肼基自由基(DPPH)、水杨酸–乙醇均为分析纯。
紫外可见分光光度计,UV-1800PC型,上海翱艺仪器有限公司;傅里叶变换红外光谱仪,Nicolet iS 10,赛默飞世尔科技有限公司;冷冻离心机,Happy-TL18型,山东济南福的机械有限公司;真空冷冻干燥机,FD-1A-50型,北京博医康实验仪器有限公司。
2.2. 实验方法
2.2.1. 蛋白质的酶解
将金枪鱼蒸煮液蛋白与去离子水按照一定的配比充分溶解后,调节反应条件并置于磁力搅拌器上酶解,结束后,根据GB 5009.235-2016中的比色法测定氨基酸态氮的含量 [16] ,进而计算酶解度。
(1)
2.2.2. 单因素实验
以酶解度为指标,分别探究酶解时间(0.5 h、1 h、2 h、3 h、4 h、5 h)、酶解温度(35℃、40℃、45、50℃、55℃、60℃)、溶液pH (6、7、8、9、10)、加酶量(金枪鱼蒸煮液蛋白质量的0.1%、0.5%、2.0%、3.5%、5%、6.5%、8%)、料液比(1:3、1:6、1:9、1:12、1:15)对其的影响。
1) 酶解时间对酶解度的影响
取适量蛋白粉于烧杯中,用9倍去离子水溶解,加入一定量的碱性蛋白酶(蛋白粉质量的3.5%),置于50℃搅拌器上,分别反应0.5 h、1 h、2 h、3 h、4 h、5 h,完成后放在沸水浴中灭酶7 min,取出冷却后高速离心,测定上清液中氨基酸态氮含量。
2) 酶解温度对酶解度的影响
取适量蛋白粉于烧杯中,用9倍去离子水溶解,加入一定量的碱性蛋白酶(蛋白粉质量的3.5%),置于不同温度(35℃、40℃、45℃、50℃、55℃、60℃)搅拌器上,反应3 h后放在沸水浴中灭酶7 min,取出冷却后高速离心,测定上清液中氨基酸态氮含量。
3) 溶液pH对酶解度的影响
取五组适量蛋白粉于烧杯中,用9倍去离子水溶解,分别调节溶液pH为6、7、8、9、10,加入一定量的碱性蛋白酶(蛋白粉质量的3.5%),置于55℃搅拌器上,反应3 h后放在沸水浴中灭酶7 min,取出冷却后高速离心,测定上清液中氨基酸态氮含量。
4) 加酶量对酶解度的影响
取七组适量蛋白粉于烧杯中,用9倍去离子水溶解,分别加入一定量的碱性蛋白酶(蛋白粉质量的0.1%、0.5%、2.0%、3.5%、5%、6.5%、8%),调节溶液pH为8,置于55℃搅拌器上,反应3 h后放在沸水浴中灭酶7 min,取出冷却后高速离心,测定上清液中氨基酸态氮含量。
5) 料液比对酶解度的影响
取适量蛋白粉于烧杯中,用不同比例V (H2O/mL):M (蛋白粉/g) = 1:3、1:6、1:9、1:12、1:15的去离子水充分溶解,加入一定量的碱性蛋白酶(蛋白粉质量的3.5%),调节溶液pH为8,置于55℃搅拌器上,反应3 h后放在沸水浴中灭酶7 min,取出冷却后高速离心,测定上清液中氨基酸态氮含量。
2.2.3. 响应面设计
以酶解度作为响应值,根据单因素对酶解度影响的实验结果,利用响应法优化酶解工艺,确定最优酶解条件。因素水平设计见表1。

Table 1. Factors and levels of response surface experiment
表1. 响应面试验设计因素水平
2.2.4. 超滤分级
将1.2.3最优条件下制备的多肽进行超滤分级,分别用1 kDa、3 kDa、10 kDa大小的超滤管进行低温高速超滤,收集不同片段(<1 kDa、1~3 kDa、3~10 kDa、>10 kDa)的多肽溶液,用Folin-酚法 [17] 测定其浓度,−18℃冷冻保存,备用。
2.2.5. 不同分子量肽段的抗氧化活性测定
DPPH自由基清除能力测定 [18] [19] :DPPH与醇溶液反应呈现紫色且稳定,可在517 nm处得到最大吸光值。在室温避光条件下,将2 mL不同分子量多肽溶液和2 mL DPPH溶液在小试管中混合均匀,反应0.5 h后测定其吸光值,记为Ai;再用同样方法测得无水乙醇的吸光值Ai0;最后将样品溶液换成无水乙醇,测定吸光值,记为A0。
(2)
羟自由基清除能力测定 [20] :向1 mL不同分子量多肽溶液中,依次加入1 mL FeSO4溶液(9 mmol/L)和1 mL水杨酸(9 mmol/L),再加入1 mL H2O2溶液(8 mmol/L)用以开启反应,涡旋混匀,37℃水浴半小时后在510 nm处测定其吸光值,记为Ai;再将H2O2溶液换成去离子水,测定吸光值,记为Ai0;最后将样品液换成去离子水,测定吸光值,记为A0。
(3)
超氧自由基清除能力测定 [21] :先在25℃水浴中将Tris-HCl (50 mmol/L, pH 8.2)溶液预热25 min,取4.5 mL于试管中,然后依次加入1 mL不同浓度不同分子量大小的多肽溶液和0.3 mL邻苯三酚溶液(3 mmol/L),25℃水浴条件下反应5 min后迅速加入1 mL盐酸(8 mol/L)以终止反应,在299 nm处测定其吸光值,记为Ai;将HCl代替邻苯三酚溶液,测定吸光值,记为Ai0;用去离子水代替样品溶液,测定吸光值,记为A0。
(4)
Fe2+螯合能力测定 [22] :向1 mL不同浓度不同分子量的多肽溶液中加入0.05 mL FeCl2溶液(2 mmol/L),涡旋混匀,再加入0.2 mL菲洛嗪溶液(5 mmol/L),室温静置10 min后在562 nm处测其吸光度,记为Ai。以去离子水代替菲洛嗪溶液测定吸光值,记为Ai0;以去离子水代替样品溶液,测定吸光值,记为A0。用EDTA-2Na做阳性对照并以去离子水进行调零。
(5)
3. 结果与讨论
3.1. 酶解条件优化
3.1.1. 酶解时间对酶解度的影响
如图1所示,当酶解时间从0.5 h延长至3 h时,酶解度随着酶解时间的延长逐渐提高,但在3 h以后酶解度增长缓慢并达到平衡。其原因一是由于酶解时间的延长,可酶解位点逐渐减少,另一方面则是由于碱性蛋白酶活性的下降 [23] 。考虑到酶解时间过长会对金枪鱼蛋白酶解液的色泽和风味产生影响,因此选择3 h作为后续的酶解时间。

Figure 1. Effect of enzymatic hydrolysis time on enzymatic hydrolysis degree
图1. 酶解时间对酶解度的影响
3.1.2. 酶解温度对酶解度的影响
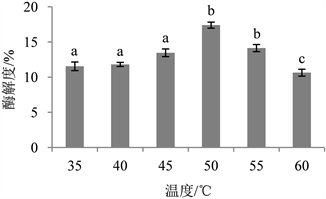
Figure 2. Effect of enzymatic hydrolysis temperature on enzymatic hydrolysis degree
图2. 酶解温度对酶解度的影响
由图2可知,前期酶解度随着温度提高而缓慢上升,当温度升高至50℃时酶解度达到最大值,为17.39%。继续升温,随着酶解温度的升高,酶解度呈现显著降低趋势。这是因为酶解温度作为影响酶催化活性的重要因素之一,温度过高或过低均会抑制酶的活性甚至使酶失活,这与孙雪芹等 [24] 探究酶解温度对中华鳖肉水溶蛋白影响的分析结论一致,因此选用50℃作为后续实验的酶解温度。
3.1.3. pH对酶解度的影响
pH会影响蛋白酶的催化能力和酶底物复合物的解离,进而影响到酶和底物的结合以及酶的催化效果。由图3可知,前期酶解度随pH的增大呈现升高趋势,当pH = 8.0时,酶解度达到最大值17.76%,继续增大pH,酶解度则出现了下降情况。这是因为碱性蛋白酶的最适作用pH = 7.0~9.0 [25] ,当pH值过低时会导致蛋白之间的静电斥力减小而发生聚集沉降,pH值过高又会使蛋白变性且黏度增大,还会造成环境污染,增大生产成本,因此选择pH = 8.0作为后续实验条件。
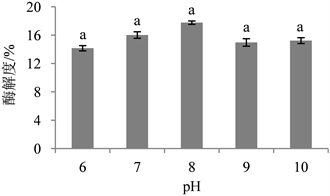
Figure 3. Effect of pH on enzymatic hydrolysis degree
图3. pH对酶解度的影响
3.1.4. 加酶量对酶解度的影响
由图4可知,前期酶解度随着加酶量的增加而显著升高,由于酶促反应与底物的量有很大关系 [26] ,当酶的添加量达到3.5%以后,蛋白粉被大量消耗,酶解反应因缺少底物而终止,酶解度无明显变化。这与吕远奇等 [27] 探究加酶量对鹿茸蛋白酶解度影响的实验结果一致。因此酶的添加量选择3.5%。
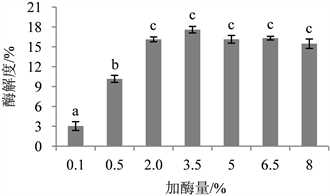
Figure 4. Effect of enzyme dosage on enzymatic hydrolysis degree
图4. 加酶量对酶解度的影响
3.1.5. 料液比对酶解度的影响
由图5可知,当料液比从1:3升至1:9时,酶解度随着料液比的增加而增大;当料液比大于1:9后,酶解度逐渐降低。这主要是因为前期随着料液比的增加,蛋白酶与底物充分接触,蛋白酶解度呈上升趋势,当料液比超过一定范围时,酶在持续反应中被逐渐消耗,底物接近于饱和状态,致使反应减慢,同时料液比的增大会削弱酶对底物的作用并出现粘稠现象,进而抑制酶解作用。林婉茹 [28] 等通过对马鲛鱼鱼头蛋白的酶解工艺研究发现酶解度随料液比的增加呈现先升高后下降的趋势,与本实验结论一致,因此选择1:9为最佳实验条件。
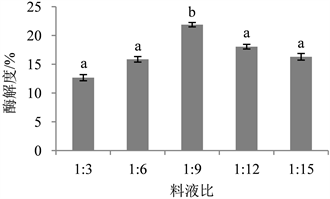
Figure 5. Influence of solid-liquid ratio on enzymatic hydrolysis degree
图5. 料液比对酶解度的影响
3.2. 响应面条件优化
基于单因素实验结果分析,选择酶解时间、酶解温度、加酶量、料液比四因素进行了Box-Behnken [29] 试验设计,结果见表2,对表2进行的方差分析结果见表3。

Table 2. Response surface test design scheme and response value
表2. 响应面试验设计方案及响应值

Table 3. Analysis of variance of response surface model
表3. 响应面模型的方差分析
注:P < 0.05,差异显著。
由表3可知,该模型p < 0.01,说明回归模型显著,失拟项p > 0.05,差异不显著,所以该模型拟合度较好,用于预测金枪鱼蒸煮液中蛋白酶解的条件优化较为可靠。通常,F值越大对应的响应值会越大,对于结果的影响也就越大 [30] ,所以,由F值得出各因素对酶解度的影响顺序依次为D (时间) > B (加酶量) > A (料液比) > C (温度)。通过软件对料液比(A)、加酶量(B)、酶解温度(C)、酶解时间(D)等四个因素进行回归拟合,得到二次多项回归方程:
回归方程反应的是响应值被各个因素影响的方向和作用效果 [31] ,回归方程的二次项的系数都为负且对应响应面开口朝下,图6中响应面的曲线弯曲弧度变化和交互作用对结果的影响变化呈现正比例关系,说明交互作用不明显。
对上述方程式解逆矩阵得出金枪鱼蒸煮液中蛋白酶解的最佳工艺条件为:料液比1:15,加酶量为2.8%,酶解温度48.7℃,酶解时间6 h,此条件下,酶解度的预测值为25.79%,考虑到实际实验中的条件控制,经过多次重复实验,将最佳工艺条件微调为:料液比1:15,加酶量3%,酶解温度50℃,酶解时间6 h,得到酶解度为(24.63 ± 0.29)%。
3.3. 不同分子量肽段的抗氧化活性
3.3.1. DPPH自由基清除能力测定
研究表明,自由基与人体健康密切相关。DPPH作为一种稳定的自由基,在517 nm处的吸光值会呈线性下降变化,从而显示出实验样品的抗氧化能力 [32] 。从图7可以看出,随着浓度的增大,各肽段的清除能力也在不断升高,所以不同的肽段均具有一定的DPPH自由基清除能力。同时结果表明,分子量越低,其DPPH清除能力越强,<1 kDa多肽样品的DPPH清除能力最强,当其浓度为2 mg/ml时,其清除率可达到77.66%。
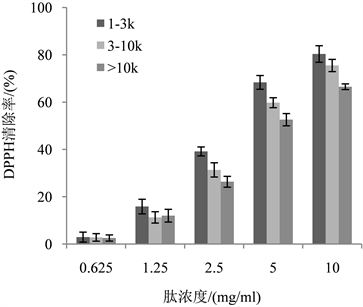
Figure 7. DPPH clearance rate of different protein peptide components
图7. 不同蛋白肽组分的DPPH清除率
3.3.2. 羟自由基清除能力测定
羟自由基(•OH)作为一种对人体危害性较大的活性氧,可以对组织中的糖类和蛋白质等物质进行氧化性破坏,从而造成组织细胞的坏死 [33] 。四组多肽溶液对•OH的清除率结果如图8所示。总体来说,多肽溶液对•OH的清除能力变化和其浓度变化呈正比例关系,相对分子量越小表现出的抗氧化能力就越强,当相对分子量<1 kDa,浓度为2 mg/ml时,清除率可达到91.95%。

Figure 8. •OH clearance rate of different protein peptide components
图8. 不同蛋白肽组分的•OH清除率
3.3.3. 超氧自由基清除能力测定
在弱碱环境中,邻苯三酚可以进行自氧化反应,产生超氧自由基,超氧自由基作为强氧化剂,可氧化不饱和脂肪酸为类脂过氧化物,通常情况下生物体内超氧自由基的产生与清除保持相对平衡 [34] ,且在299 nm处有最大吸收峰。由图9可以看出清除率和肽浓度成正比关系,说明两者之间存在着量效关系,因此多肽溶液对超氧自由基具有一定的清除能力。比较四个组分的清除能力,可以得出,分子量越小,清除能力越强。
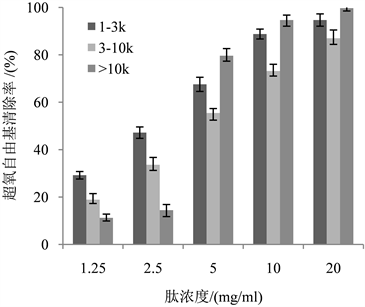
Figure 9. Superoxide radical scavenging rate of different protein peptide components
图9. 不同蛋白肽组分的超氧自由基清除率
3.3.4. Fe2+螯合能力测定
铁是人体必需微量元素,对人体细胞呼吸和能量代谢调节具有重要的作用,人体缺铁可能会导致一些疾病,但一些安全的铁补充剂如多糖铁螫合物等在机体内生物利用度不高。因此,最近越来越多的研究人员将注意力集中在铁肽螯合物上,在现有大量的研究揭示了通过酶水解各种蛋白质产生的多肽对铁离子具有较好的鳌合作用 [35] 。菲洛嗪法 [36] 是常用的测定Fe2+螯合能力的方法,本实验采用此法进行研究金枪鱼蒸煮液蛋白肽对其的螯合能力,结果如图10所示。可以看出,Fe2+的螯合能力随着蛋白肽浓度增大而增大,当蛋白肽浓度增加到一定程度时,后期螯合速率逐渐平缓;同时发现分子量越小对Fe2+的螯合能力越强,尤其当相对分子量<1 kDa时,IC50达到0.59 mg/ml,说明小分子的蛋白肽对于Fe2+具有较好的螯合能力。
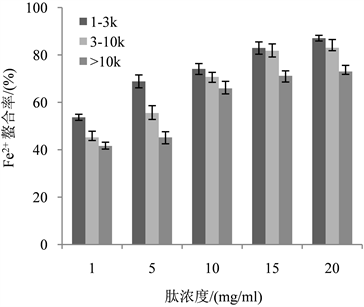
Figure 10. Fe2+ chelation rates of different protein peptide components
图10. 不同蛋白肽组分的Fe2+螯合率
4. 结论
本文以酶解度为指标,使用碱性蛋白酶对已制备的金枪鱼蒸煮液蛋白进行酶解,通过单因素实验探究各因素对酶解度的影响并采用响应面法对酶解工艺进行优化,得到最佳的酶解工艺条件:料液比1:15,加酶量3%,酶解温度50℃,酶解时间6 h,酶解度可达(24.63 ± 0.29)%。通过超滤将多肽分为不同大小的组分探究其抗氧化能力,结果表明:<1 kDa多肽样品的DPPH清除能力最强,当其浓度为2 mg/ml时,其清除率可达到77.66%;多肽溶液对超氧自由基具有一定的清除能力,且分子量越小清除能力越强;<1 kDa的多肽样品对于Fe2+具有较好的螯合能力,IC50可达0.59 mg/ml。
致谢
感谢课题组的大力支持和帮助,使本人的实验能够快速展开并取得一定成果。