1. 引言
阪崎氏肠杆菌是肠杆菌科的一种,是乳制品中较新发现的一种致病菌。由其引发的婴儿、早产儿脑膜炎、败血症及坏死性结肠炎散发和暴发的病例已在全球相继出现,导致的死亡率可达40%~80%,已引起世界多国相关部门的重视。国际食品微生物标准委员会(ICMSF)在2002年将阪崎肠杆菌列为“严重危害特定人群生命、引起长期慢性实质性后遗症的一种致病菌” [1] [2] [3] 。2004年安徽阜阳劣质婴儿配方奶粉事件时,国内首次从87份婴儿配方奶粉中分离到11株该菌,检出率达12.6% [4] 。金黄色葡萄球菌是人类的一种重要病原菌,隶属于葡萄球菌属,可引起许多严重感染。美国疾病控制中心报告,由金黄色葡萄球菌引起的感染占第二位,仅次于大肠杆菌 [5] [6] [7] 。中国每年发生的此类中毒事件也非常多,也是乳制品中重要的检测项目 [8] 。目前我国微生物检测主要基于国家标准方法GB 4789《食品安全国家标准 食品微生物学检验》,该方法步骤较多,操作过程复杂,检测过程需要3到5天的时间,难以满足食品快速检测需求,因此急需建立一种针对乳制品的,能够快速准确检测其中重要致病菌阪崎氏肠杆菌和金黄色葡萄球菌的方法 [9] 。
免疫磁珠是对具有超顺磁性的微粒表面进行化学修饰,使之与特异性抗体牢固结合,成为能捕获特异性抗原的磁珠。将免疫磁珠与待测溶液混合,如有相应抗原存在,免疫磁珠就会将其捕获,形成抗原–免疫磁珠复合物,并在适当的磁场条件下分离出来,达到富集目标抗原的目的 [10] [11] [12] 。本研究将免疫磁分离技术和量子点免疫层析技术相结合,首先通过免疫磁珠将目标菌特异地从复杂的基质及背景菌群中分离并富集,再加入到量子点免疫层析试纸条上进行检测,可以去除食品基质和杂菌的干扰,将待检样品富集浓缩到更小体积,从而大大提高了检测灵敏度和准确度,具有简便、快速、经济等特点。本研究免疫磁分离结合量子点试纸条利用生物素–链霉亲和素体系联级信号放大同时检测阪崎氏肠杆菌和金黄色葡萄球菌的方法目前尚未见报道,具有创新性,对快检技术的发展有一定的推动作用。本研究的建立对于原料乳及奶制品的阪崎氏肠杆菌和金黄色葡萄球菌在基层现场的筛查和防控具有重要意义。
2. 材料与方法
2.1. 材料与设备
磁珠购于赛默飞世尔科技公司;硝酸纤维素膜(NC膜)购于Millipore;玻璃纤维素膜购买于Ahlstrom、特定类型的样品垫、吸水垫、PVC 底板购买于上海杰一生物技术有限公司;实验用单抗及多抗都由深圳三方圆生物科技有限公司提供;量子点微球由南京诺唯赞生物科技有限公司合作研发;实验菌种阪崎氏肠杆菌及金黄色葡萄球菌均由南京市产品质量监督检验院(南京市质量发展与先进技术应用研究院)微生物实验室保藏;其他缓冲物质以及甲醇、二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)、牛血清白蛋白(BSA)、酪蛋白、乙醇胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)等试剂购自于阿拉丁公司;4-(N-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(SMCC)试剂购自于AAT Bioquest公司。
单维往复式划膜仪;三维平面喷膜仪;压壳机;数控高速斩切机;滚切机;恒温培养箱;旋转混合仪;蓝博荧光检测仪。
2.2. 实验方法
首先分别将阪崎氏肠杆菌和金黄色葡萄球菌两种菌的单抗与链霉亲和素偶联,然后将单抗–链霉亲和素复合物与磁珠连接,形成免疫磁珠用来提取样品中的目标菌。在查阅相关资料以及原有实验室研究基础上 [13] [14] [15] ,研究纳米荧光材料量子点与生物素的标记方法,并利用免疫层析方法,结合垫上使用量子点与生物素结合物。NC膜上包被检测线两条,均使用目标菌的多抗,质控线一条使用兔抗鼠二抗,从而完成检测方法的组建。本研究通过一系列标记及偶联方法的研究和探索,将新型的纳米荧光材料量子点及生物素–链霉亲和素体系与免疫层析法结合,实现阪崎氏肠杆菌和金黄色葡萄球菌联级信号放大和超灵敏联合检测,减少了食品基质和杂菌的干扰,实现了样品富集浓缩、信号放大及联合检测,从而大大提高了检测灵敏度和准确度,研究方法详见图1。
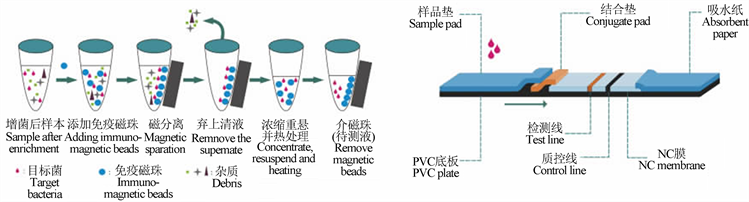
Figure 1. Schematic diagram of the detection process of immunomagnetic separation combined with immunochromatography
图1. 免疫磁分离结合免疫层析方法检测过程示意图
2.2.1. 方法研究思路
在研究前期,借助量子点粒径不同则荧光色彩不同的特点,以磁珠标记抗体,不同粒径量子点标记抗体,然后在检测液中形成磁珠–单抗1-目标菌–单抗2-不同色量子点捕获探针,以荧光检测仪器检测不同颜色的荧光强度来完成检测,优点为操作简单,在检测液环境中即可完成检测,可以减少免疫层析一系列操作。但因当前荧光检测仪器受限等问题,无法同时精确的分析出不同荧光强度,所以检测限比较低,仅能达到7 × 108 CFU/mL,不能满足检测需求,所以需要增加免疫层析操作,进行二次浓缩及减少基质干扰,同时可将荧光检测模式从同时检测不同色荧光强度为较为成熟的检测单一荧光强度。
根据文献调研及实验室研究,加入免疫层析后采用的方法为磁珠偶联单抗后进行目标菌富集,免疫层析试纸结合垫上为量子点与多抗结合物,NC膜上包被检测线两条均为目标菌的单抗,质控线上为兔抗鼠多抗,检测限可达到4 × 106 CFU/mL,但同时检测需使用多对抗体,不同类抗体互相作用会对检测造成一定影响。所以本研究进一步优化加入了生物素–链霉亲和素体系,一方面1分子链霉亲和素可以连接4分子的生物素,亲和能力高,可以实现联级信号放大,另一方面可以减少数对抗体的使用,简化检测过程的同时提高了灵敏度,实现高灵敏的联合检测,具有一定的创新性。
2.2.2. 免疫磁珠的制备及优化
1) 磁珠活化与偶联
磁珠活化与偶联方法参照崔希 [16] 等人方法:取5 mg磁珠用MES缓冲液(0.01 mol/L, pH 6.0)洗涤4遍,磁分离后移除上清液;加入MES缓冲液现配的EDC和NHS溶液(10 mg/mL)各0.5 mL,室温下在旋转混合仪上活化1 h (15 r/min),磁分离后移除上清液,用1 mL MES缓冲液重悬;在离心管中迅速加入200 μL上述刚活化的磁珠,磁分离后吸出上清液,向离心管中添加1 mL硼酸盐缓冲液(0.01 mol/L,pH 8.5)稀释的一定浓度的抗体与链霉亲和素结合物;室温下在旋转混合仪上反应4 h (15 r/min),磁分离移除上清液后,加入1 mL1% BSA硼酸盐缓冲液,室温下在旋转混合仪上反应2 h (15 r/min);磁分离后移除上清液,用硼酸盐缓冲液0.1%吐温20洗涤3遍。最后用0.5 mL硼酸盐缓冲液吐温20 (含0.5% BSA)重悬磁珠,置于4 C备用。
2) 在实际样本中的捕获效果
称取100 mL灭菌新鲜牛奶置于无菌的三角瓶内,添加培养好的阪崎氏肠杆菌及金黄色葡萄球菌模拟污染,至两种目标菌浓度均约为104 CFU/mL,37℃,160 r/min摇床培养8 h,取5 mL上层清液到离心管里,添加自制的免疫磁珠500 μL,在旋转混合仪上室温反应20 min,结束后放入磁场分离3 min。将对照组、分离上清液、洗涤液、磁珠重悬液作合适倍数稀释,取100 μL涂布于选择性培养基上(对照组同时涂布琼脂培养基计算菌落总数),每种菌各平行制备3个样品。37℃培养12 h后,对目标菌阪崎氏肠杆菌、金黄色葡萄球菌及杂菌分别计数,计算捕获效率。
2.2.3. 量子点免疫层析试纸的制备
1) 量子点的制备和标记方法的建立
量子点作为一种较为灵敏的荧光纳米材料,食品基质对其影响也会更加灵敏复杂,所以原材料的研发和标记方法的建立也就及其重要。实验室选择水热法和微波法两种不同的方法,研发制备较为先进的石墨碳量子点。其中水热法产率较低,但过程可控度较高。微波法简单易操作产率较高,但得到的量子点粒径不均匀,易成团结块,会对后续的检测实验造成极大地误差。经过多次的探索和试验,在传统水热法基础上,用有机试剂代替水,全程控制制备过程在一个碱性环境中,即得到了分散较为均匀、粒径较一致的石墨碳量子点且产率也得到了提高。针对研发的原材料量子点的特性,实验室采用目前应用较为广泛的EDC-NHS交联剂方法和单一的SMCC试剂方法,对量子点的标记进行研究。结果发现在预实验阶段SMCC试剂标记生物素的效果较EDC-NHS交联剂方法标记效果稳定,有效值较高,且量子点粒径及分散系数较小,说明在标记生物素技术上,SMCC试剂法对本研究研发的石墨碳量子更为适用。在原有标记方法基础上,经过后期不断的性能验证和优化,确定生物素与量子点在SMCC试剂作用下偶联后,加入5%的酪蛋白和1%的乙醇胺可以更好的封闭未标记的位点,减少特异性反应。另外在操作过程中适用离心等会使量子点聚集的步骤后,要及时加入后续溶液超声分离,用粒径分析仪等相关仪器对粒径和分散系数进行检测,保证数值在一定的范围内,确保量子点与活性材料标记均匀,减小检测实验误差。最后将量子点标记物稀释到最优浓度,使用喷金仪喷到处理后的标记物垫上,即完成量子点的标记 [13] 。
2) 量子点免疫层析试纸的组建
因为检测体系的组建与NC膜上包被的两条检测线抗体浓度,量子点标记的生物素浓度以及标记后喷到结合垫上的喷垫浓度密切相关。所以建立了正交实验,以104 CFU/mL拟污染后,本方法磁珠富集提取过的样品作为阳性样本检测每个组合的精密性、最低检测限、IC50等相关性能,选择出的最优浓度组合为:NC膜上检测线1包被阪崎氏肠杆菌抗体浓度为0.6 mg/mL;检测线2包被金黄色葡萄球菌抗体浓度为0.45 mg/mL;标记生物素浓度25 μg,喷垫到结合垫上的浓度0.4 mg/mL的反应模式。以上各成分浓度确定后,又以多组对照实验,确定阪崎氏肠杆菌检测线1和金黄色葡萄球菌检测线2距离为2.5 mm,检测线1与质控线的距离为8.5 mm,检测线2与质控线的距离为11 mm,反应最优。
根据优化后的整合结果,建立检测信号–浓度模型,并对组合好的试剂盒进行性能评测:最低检测限,精密性,线性范围,回收率,热稳定性以及与法检的对比检测结果等。
3. 结果与讨论
3.1. 免疫磁珠在实际样品中的捕获效果
自制免疫磁珠在牛奶基质中对阪崎氏肠杆菌和金黄色葡萄球菌的捕获效率分别为93.4%和95.8%,说明自制磁珠及磁珠富集试剂方法可行,也说明磁珠偶联的抗体特异性较高适用于本实验,抗体联结链霉亲和素后未影响抗体性能,可实现目标菌的高效富集。
3.2. 定量检测模型
通过检测拟污染阪崎氏肠杆菌及金黄色葡萄球菌浓度均为2×103、5×103、5×104、105、106、107、108 CFU/mL再用磁珠提取后的溶液作为标准物质,构建标准曲线如图2及图3所示。因为微生物检测量通常呈倍数级增加,为了减少系统或检测偏差的影响,增加准确度,采用浓度值取以10为底的对数值的方法对标准曲线进行处理,构建定量检测模型。阪崎氏肠杆菌检测信号-浓度公式为y = 0.7113x – 2.3391,R2为0.9878,金黄色葡萄球菌信号–浓度公式为y = 1.2328x – 4.1568,R2为0.9885,定量检测即将样本检测相关数值带入曲线和计算公式中,换算得到检测浓度 [17] 。
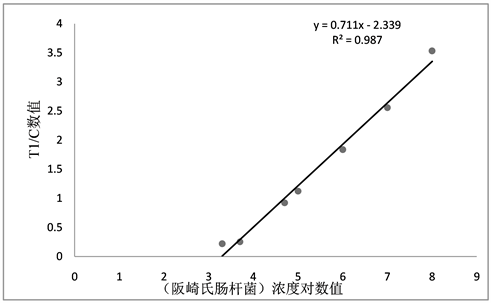
Figure 2. The concentration logarithmic standard curve of Enterobacter sakazakii
图2. 阪崎氏肠杆菌浓度对数标准曲线
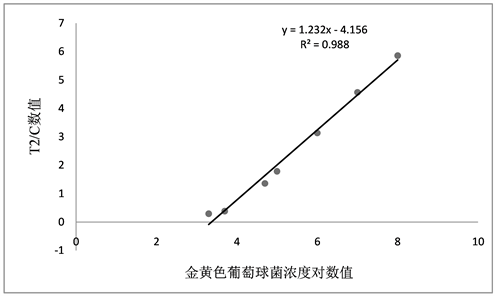
Figure 3. Staphylococcus aureus concentration logarithmic standard curve
图3. 金黄色葡萄球菌浓度对数标准曲线
3.3. 性能验证分析
根据优化后的整合结果,建立了定量检测信号–浓度模型,并对组合好的试剂盒进行性能评测:最低检测限,回收率,热稳定性结果如下所示。
3.3.1. 最低检出限
按照相关检测技术要求,需检测20次空值样本来计算最低检测限浓度,但不符合本方法实际检测要求。在建立定量检测模型及标准曲线建立过程中发现,当拟污染量低于2 × 103 CFU/mL时,检测信号偏低且无法呈现线性,拟污染量在2 × 103~5 × 103 CFU/mL之间时信号增长呈线性,相较高浓度检测曲线K值偏小,但仍在可检测范围内。以上两种实验现象可表明2 × 103 CFU/mL浓度左右为本方法的最低检测限,所以以实际检测为基础,本方法两种菌的最低检出限均为2 × 103 CFU/mL。
3.3.2. 回收率
分别将拟污染浓度为4 × 103、105、107 CFU/mL经过本方法磁珠富集后的低、中、高值质控作为阳性的添加样本进行添加回收实验,考察试剂盒的回收率以及整体回收率。


Table 1. Recovery experiment results of Enterobacter sakazakii
表1. 阪崎氏肠杆菌回收实验结果

Table 2. Recovery experiment results of Staphylococcus aureus
表2. 金黄色葡萄球菌回收实验结果
根据结果可知(表1,表2)整体回收率在95.9%~122.1%之间,在可接受范围内,检测较为准确,说明建立的检测方法较为科学。
3.3.3. 热稳定性
根据稳定后工艺制作一批本实验的量子点试纸条,保存条件分别为4℃对照组,37℃保存3天、37℃保存6天,37℃保存10天为实验组,进行热加速破坏实验,量子点试纸条热稳定性结果如下表3所示:

Table 3. Results of stability assessment
表3. 稳定性考核结果
由数据结果可知,热加速实验中,各实验组最低检出限、线性以及质控品检测值均在可控范围内,热加速可稳定在10天以内,根据换算4℃可稳定保存1年 [18] 。
4. 结论
本研究建立了免疫磁分离结合量子点免疫层析及亲和素链霉素信号放大的方法,借助量子点及亲和素链霉素体系较传统胶体金免疫层析方法灵敏度提高近2000倍,可实现大批量、多种检测环境的阪崎氏肠杆菌和金黄色葡萄球菌联合快速检测,目前国内鲜有研究将一系列技术应用于食品基质的微生物检测中,所以本项目具有一定的创新型和社会经济效益。减少了一定的实验室前增菌操作,降低了实验对微生物检测高环境要求的限制,对于低浓度如10 CFU/mL菌污染的样品,经过6 h预增菌后,仅需约60 min即可完成磁分离和试纸条检测,高浓度的污染样品,无需前增菌即可检测。检测费用低,每个试纸条仅需50元,不需要专业操作人员,因此,本方法特别适于在基层快速筛查致病菌,食品安全防控可以前置与落实。
另外随着检测仪器的进步及本方法的再优化及研发,可以完成借助多粒径多色量子点实现纯液体环境的简便检测,同时可以联合检测多种菌,这也是本方法目前的研究方向,可以为其他研究提供一定的思路。也将组织多个实验室共同验证此方法的可行性,并进行实际实验研究,在区域内的商超、食材原产地、农批市场进行预使用实验,收集原始数据,不断完善改进,将技术落地服务市场监管 [19] [20] 。
基金项目
江苏省市场监督管理局科技计划项目(项目编号:KJ204128)。
NOTES
*第一作者。
#通讯作者。