1. 引言
肺癌是一种起源于肺组织内的恶性肿瘤,其恶性程度与其他肿瘤相比较高。据统计数据表明,在所有的恶性肿瘤中,肺癌的发病率占11.4%,而其死亡率占18%,因此肺癌一直都是引起癌症死亡的首要原因 [1] 。肺腺癌是非小细胞肺癌中的一种,约占肺癌的40% [2] 。早期的肺腺癌患者并没有特异性的临床症状,往往发现的时候已步入中晚期,我国肺癌病例的发现以临床晚期居多,2012~2014年,中国III~IV期肺癌的占比为64.6%,错过了最佳的治疗时间 [3] 。目前的关于肺腺癌的治疗方案包括手术治疗、化学治疗、放疗、靶向治疗及免疫治疗等常规治疗方案,虽然肺腺癌的治疗技术在持续进步,但是患者五年生存率并没有得到显著的提升 [4] 。因此,研究者们寻找有潜力的分子治疗靶点用于对肺癌的治疗显得尤为关键。
ANLN (anillin actin binding protein)是一种具有独特多结构域的保守蛋白,能够与其上下游的多个配体机相互作用,参与细胞的分裂,从而调控对肿瘤细胞的增殖、迁移和侵袭产生影响 [5] 。在人类基因组中,ANLN基因(NM_018685)位于7p14.2,它含有24个外显子,编码分子量为123 KDa的1125个氨基酸残基 [6] [7] [8] 。ANLN参与了肿瘤的发生和进展,本文采用了A549细胞中敲除ANLN基因,探讨ANLN敲除对肺腺癌细胞在裸鼠体内生长的影响,从而为寻找新的治疗肺腺癌的方法提供思路及实验支持。
2. 材料和方法
2.1. 材料
本实验选用的是A549肺癌细胞(上海市干细胞技术有限公司)。本实验中经由靶向ANLN-siRNA基因敲减技术得到的实验组(ANLN-A549)及对照组(Ctrl-A549)细胞均由广州源井生物科技有限公司制备。Anillin抗体、GAPDH抗体购于Affinity公司。RIPA裂解液购于上海鼎国生物技术有限公司。FBS胎牛血清、PBS缓冲液、DMEM高糖培养基、胰蛋白酶-EDTA (0.25%)均购于美国Gibco公司。经海南医学院医学伦理委员会批准,选用5周龄BALB/c-nu裸鼠16只,由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘) 2019-0004,并在海南医学院实验动物中心完成动物实验。
2.2. 方法
2.2.1. 细胞培养
A549细胞培养条件:首先配制完全培养基(89%DMEM高糖培养基 + 10% FBS胎牛血清 + 1%双抗),然后配制A549细胞悬液,后移至细胞培养瓶中,最后放置于CO2浓度为5%的细胞培养箱中,37℃恒温培养。
2.2.2. 靶向ANLN-siRNA设计及ANLN-A549细胞株的构建
本实验中ANLN-siRNA载体质粒由广州源井生物科技有限公司其专利技术进行构建,首先取对数生长的状态的A549细胞,制备为单细胞悬液,放入离心机,经1000 r/min的速度离心5分钟后,经PBS洗涤离心后,细胞重悬于电转移液中,移入电击杯中,用10 μg ANLN-siRNA质粒,充分混匀,在冰上放置半小时后,进行电穿孔(电压450 V/cm,电容25 μF,时间:0.9 ms),转染后的细胞为实验组(ANLN-A549),同时以空载体电转染为对照组(Ctrl-A549),室温条件下放置半小时,将细胞转移至含完全培养基的细胞培养瓶中,放置于细胞培养箱中,在5% CO2的状态下37℃恒温继续培养,实验组和对照组在转染两天后进行RT-PCR检测。
2.2.3. 小鼠皮下种瘤实验
把16只裸鼠随机分为实验组(ANLN-A549)及对照组(Ctrl-A549);把处于对数生长期的Ctrl-A549组和ANLN-A549组细胞制成不含血清细胞悬液,计数并调整浓度为2 × 107个/mL。分别注射于实验组、对照组裸鼠右侧腋下,注射量为每只裸鼠注射0.1 ml。根据A549细胞的成瘤能力,每3天观察并测量实验组及对照组裸鼠的瘤体大小及长径、短径,并根据长短径计算瘤体体积(长径 × 短径2/2),收集每次记录数据。培养至一定时间后,取出裸鼠皮下瘤体并拍照,装入冻存管中并放入超低温冰箱(−80℃)保存,以备后续实验。
2.2.4. 蛋白印迹法(WB)
收集实验组、对照组裸鼠瘤体,用液氮研磨完后,加入400 ul RIPA强蛋白裂解液(蛋白酶抑制剂:磷酸酶抑制剂 = 100:1:1)裂解5分钟,然后在13,500 r/min、4℃条件下离心15分钟。离心结束后,轻轻吸取上清液移至EP管中,将其置于冰上备用。根据配胶说明的方法进行配制10%分离胶和5%浓缩胶。将蛋白样品进行电泳先采用80 V恒压30分钟,待Marker分离后,改为100 V恒压40分钟。然后湿转于无水甲醇浸过的PVDF膜,转膜后将膜用TBST洗3次,每次10分钟。转膜后,将膜放置盒子上,用TBST溶解5%的脱脂奶粉配制封闭液进行封闭,摇床缓慢摇动2小时。封闭后将膜用TBST洗3次,每次5 min。加入一抗(ANLN抗体,稀释比1:1000);孵育:一抗用TBST稀释,4℃摇床孵育过夜。一抗孵育后将膜小心的用TBST洗3次,每次约5分钟左右。加入二抗(GAPDH抗体,稀释比1:3000);孵育:稀释后的二抗孵育2 h。二抗孵育后将膜小心的用TBST洗3次,每次约5分钟左右。最后利用增强化学发光法(ECL)显影。
2.2.5. RT-量化PCR实验
采用Eastep® Super总RNA提取试剂盒提取实验组及对照组瘤体总RNA,然后逆转录合成cDNA。使用cDNA合成试剂盒配制混合液(5 × gDNA digester Buffer 2 μL + gDNA digester 1 μL + RNA 500 ng + RNase free ddH2O To 10 μL),吹打混匀,并42℃孵育2 min。孵育后再反应管中加入2 × Hifair® II SuperMix plus,吹打混匀。然后再25℃孵育5 min,42℃孵育30 min,85℃孵育5 min后逆转录产物。量化PCR扩增系统如下:Hieff® qPCR SYBR® Green Master Mix (Low Rox Plus) 10 μl,正反引物各0.4 μl (见表1),cDNA 2 μl,无RNA酶水补充至20 μL。实时荧光定量PCR检测(RT-PCR):采用两步法,反应体系20 μl,PCR反应条件(表2)。采用2−ΔΔCt法进行数据分析,统计各基因表达差,以均数 ± 标准差表示,用t检验或单因素方差分析方法。

Table 2. Two-step reaction procedure
表2. 两步反应程序
2.3. 统计学分析
本实验采用SPSS 22.0软件对数据进行分析。两组数据间对比用t检验,实验数据用平均值 ± 标准差表示,多组数据之间的对比用单因素方差分析,当p < 0.05时,其差异具有统计学意义。
3. 结果分析
3.1. 基因敲除细胞株构建
使用ANLN-SiRNA质粒,构建ANLN第二个外显子(E2)敲除的肺腺癌A549细胞株,为对结果进行验证,我们设计了不同引物(图1(A)),提取DNA后通过PCR扩增,图1(B)的条带1显示实验组敲除目的基因后的一个短的条带(566 bp),条带2显示对照组一个正常的条带(1272 bp)。条带3、4使用的R2引物位于ANLN的第二号外显子区域,因此条带3基因敲除的细胞系没有扩增,条带4对照组的A549显示正常大小的条带(581 bp)。条带5、6使用的F2引物位于ANLN的第二号外显子区域,因此条带5基因敲除的细胞系没有扩增,条带6对照组的A549细胞显示正常大小的条带(712 bp)。随后我们使用F1、R1引物对实验组和对照组进行测序,结果显示,实验组的基因的DNA显示缺失了706 bp (见补充图1),证明模型构建成功。

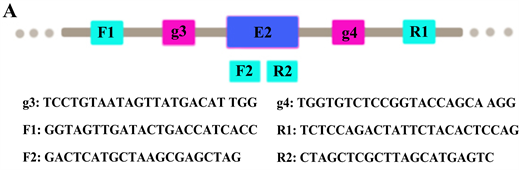 注:(A) 构建ANIN第二号外显子敲除的SiRNA以及对其结果验证的示意图,g3和g4分别代表进行第二号外显子敲除的先导序列,F1、R1、F2、R2是对敲除结果进行验证的PCR引物,F1位于g3的5’端外侧,R1位于g4的3’端外侧,F2、R2位于第二号外显子区域。使用不同PCR引物对基因敲除细胞系进行验证。(B) 条带1、2为F1/R1引物下的测序结果(注:条带1重复两次);条带3、4为F1/R2引物下的测序结果(条带4重复两次);条带5、6为F2/R2引物下的测序结果(注:条带6重复两次)。
注:(A) 构建ANIN第二号外显子敲除的SiRNA以及对其结果验证的示意图,g3和g4分别代表进行第二号外显子敲除的先导序列,F1、R1、F2、R2是对敲除结果进行验证的PCR引物,F1位于g3的5’端外侧,R1位于g4的3’端外侧,F2、R2位于第二号外显子区域。使用不同PCR引物对基因敲除细胞系进行验证。(B) 条带1、2为F1/R1引物下的测序结果(注:条带1重复两次);条带3、4为F1/R2引物下的测序结果(条带4重复两次);条带5、6为F2/R2引物下的测序结果(注:条带6重复两次)。
Figure 1. Construction of a gene knockout A549 cell line using ANLN-SiRNA
图1. 使用ANLN-SiRNA构建基因敲除的A549细胞系
3.2. 裸鼠皮下成瘤实验结果
分别在裸鼠皮下移植ANLN-A549实验组、Ctrl-A549对照组细胞后,选取7个不同时间点对裸鼠皮下肿瘤进行测量(分别为接种后第6天、9天、12天、15天、18天、21天、24天),测的肿瘤体积对照组分别为7.77 ± 3.09 mm3、25.06 ± 2.88 mm3、63.39 ± 8.25 mm3、116.43 ± 10.04 mm3、171.75 ± 32.01 mm3、367.59 ± 56.63 mm3、701.74 ± 145.59 mm3,而实验组分别为0.96 ± 0.43 mm3、3.58 ± 1.14 mm3、8.61 ± 1.39 mm3、19.93 ± 3.07 mm3、40.23 ± 5.75 mm3、67.10 ± 4.66 mm3、130.93 ± 40.75 mm3,两组不同时间节点肿瘤体积大小均有明显差异(p < 0.05,图2(B))。将皮下接种A549细胞的两组裸鼠在接种后第24天进行安乐处死,从16只裸鼠皮下取出肿瘤瘤体并进行称重,结果显示实验组瘤体重量(0.112 ± 0.030 g)较对照组(0.564 ± 0.118 g)明显减小(p < 0.05,图2(A)和图2(C))。

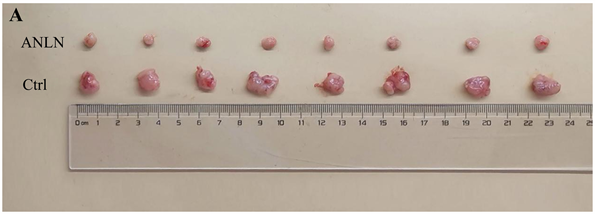 注:(A)为在裸鼠皮下成瘤实验中第24天取出的肿瘤组织,(B)为不同时间节点测量的肿瘤组织体积的统计学处理结果,(C)为(A)肿瘤组织重量的统计学处理结果。**为p < 0.01;***为p < 0.001;****为p < 0.0001。
注:(A)为在裸鼠皮下成瘤实验中第24天取出的肿瘤组织,(B)为不同时间节点测量的肿瘤组织体积的统计学处理结果,(C)为(A)肿瘤组织重量的统计学处理结果。**为p < 0.01;***为p < 0.001;****为p < 0.0001。
Figure 2. Subcutaneous tumor formation experiment in nude mice
图2. 裸鼠皮下成瘤实验
3.3. 蛋白印迹法(WB)实验结果
WB检测ANLN-A549实验组和Ctrl-A549对照组裸鼠皮下肿瘤中ANLN的蛋白量的变化,相比于Ctrl-A549组,ANLN-A549组的ANLN的蛋白含量减少,具有统计学意义(p < 0.05,图3)。
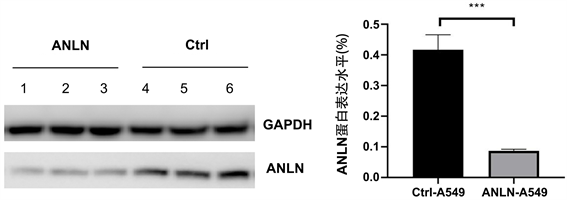 注:ANLN-A549和Ctrl-A549在裸鼠皮下成瘤后ANLN蛋白的表达水平及统计学结果。**为p < 0.01;***为p < 0.001;****为p < 0.0001。
注:ANLN-A549和Ctrl-A549在裸鼠皮下成瘤后ANLN蛋白的表达水平及统计学结果。**为p < 0.01;***为p < 0.001;****为p < 0.0001。
Figure 3. Western blotting experiment
图3. 蛋白印迹法(WB)实验
3.4. RT-PCR实验结果
RT-PCR检测ANLN-A549实验和Ctrl-A549对照组裸鼠皮下成瘤后,肿瘤中ANLN的mRNA表达量的变化,ANLN-A549组较Ctrl-A549组中ANLN的mRNA表达量减少,具有统计学意义(p < 0.05,图4)。
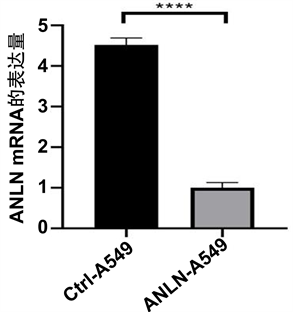 注:ANLN-A549和Ctrl-A549在裸鼠皮下成瘤后ANLN中mRNA的表达水平。**为p < 0.01;***为p < 0.001;****为p < 0.0001。
注:ANLN-A549和Ctrl-A549在裸鼠皮下成瘤后ANLN中mRNA的表达水平。**为p < 0.01;***为p < 0.001;****为p < 0.0001。
Figure 4. Real-time fluorescence quantitative polymerase chain reaction experiment
图4. RT-PCR实验
4. 讨论
肺癌是目前全球最致命的恶性肿瘤之一,其一直以来居高不下的发病率及致死率给人类健康带来严重威胁,同时也加重了社会的经济负担,其中所有肺癌患者中,肺腺癌患者约占80%~85% [9] [10] [11] 。Chen等人利用生物信息学研究发现,ANLN升高与肝细胞癌的进展相关,他们敲除肝肿瘤细胞的ANLN基因后发现,肝肿瘤细胞的有丝分裂受到损伤,从而抑制肿瘤细胞的生长。动物实验研究表明,向Anln+/+,Anln+/−,和Anln−/−三个转基因小鼠的尾静脉中注射两种不同的原癌基因(c-Myc/NRAS),随后发现在三种小鼠中,Anln−/−小鼠由原癌基因引起的肝癌发生率降低,但是表现为正常肝细胞数量增加和细胞核的多倍体化 [12] 。作者指出,ANLN的存在与肝细胞癌的发生密切相关。Chen等人对TCGA资料库中膀胱尿路上皮细胞癌(BLCA)患者的临床信息进行分析,结果发现在BLCA组织中ANLN表达上调,而且相比于ANLN表达量低的患者,ANLN表达量高的BLCA患者的预后较差。而ANLN的过表达可以激活JNK信号通路,进而使肿瘤细胞的增殖,侵袭和迁移增强,同时抑制BLCA细胞的凋亡 [13] 。Zeng等人在BLCA肿瘤患者的肿瘤组织中发现ANLN的表达增高,然后通过设计体外细胞实验,将J82和5637肿瘤细胞中的ANLN片段进行敲减,实验发现敲减后的肿瘤细胞停留在G2/M期,从而导致肿瘤细胞的侵袭、增殖、转移能力下降 [14] 。Zhou等人对71个乳腺癌肿瘤标本进行免疫组化分析,结果显示ANLN在癌组织中表达较癌旁组织升高。随后通过基因敲减技术抑制ANLN基因在ZR-75-30和MDA-MB-231细胞中的表达,结果验证了敲减后的肿瘤细胞较未敲减的肿瘤细胞在增殖、侵袭及迁移等能力下降 [15] 。这些结果表明ANLN的升高可以导致癌症的发生。
我们通过构建ANLN-siRNA质粒,电转法转染A549细胞,得到了敲除ANLN基因的A549细胞,然后皮下接种到裸鼠体内,同时对裸鼠成瘤后不同时间节点肿瘤体积进行测量,结果显示,实验组裸鼠皮下形成的肿瘤明显小于对照组,并且在最后的时间节点上,我们提取裸鼠实验组及对照组的皮下肿瘤,对肿瘤的重量进行测量,对照组的肿瘤重量要大于实验组肿瘤的重量,再次证明了敲除ANLN对A549细胞增殖能力的影响。根据我们对裸鼠取瘤后瘤体的蛋白免疫印迹(WB)法及RT-PCR实验进行验证,得出的结果显示,实验组裸鼠瘤体中ANLN的蛋白含量及mRNA的表达量较对照组都明显降低,证明了A549细胞在裸鼠体内增殖能力强弱与ANLN的表达相关。Suziki等人通过对肺癌患者的肺癌组织标本进行组织微阵列芯片实验,发现肺癌组织细胞核中ANLN高表达,然后通过生存分析发现与患者的5年生存率与高表达的ANLN之间存在明显关联。然后通过ANLN的小干扰RNA降低了肺腺癌细胞中的ANLN表达,结果导致了肺腺癌细胞的死亡 [16] 。我们的结果与其相一致,在动物水平验证了ANLN与肺腺癌发生发展的总要作用。
实验证明降低ANLN在A549细胞中的表达,导致A549细胞在裸鼠体内的增殖能力下降。因此,我们认为ANLN的表达可以影响肺腺癌细胞在动物体内的增殖能力,ANLN为临床上对肺腺癌患者,提供一个有效的分子治疗靶点。同时,我们仍需要进一步的实验来验证敲除ANLN对其他肺腺癌细胞株的影响,并在以后的研究中阐明ANLN分子的作用机理,为将来治疗肺腺癌来提供实验和理论基础。
基金项目
2022年,IncRNA MALAT1对非小细胞肺癌(NSCLC)免疫微环境的影响及其调控机制(Effect of IncRNA MALAT1 on the Immune Microenvironment of Non-small Cell Lung Cancer (NSCLC) and Its Regulatory Mechanism),SQ2022MSXM1128,海南省自然科学基金高层次人才项目。
补充图

Supplementary Figure 1. The sequencing results of the experimental group showed that the second exon of ANLN and part of its surrounding intron region were deleted
补充图1. 实验组的测序结果显示ANLN第二号外显子及其周围的部分内含子区域被删除
NOTES
*第一作者。
#通讯作者。